阿魏菇凝集素分离纯化及理化性质的研究
2014-12-25杨爱霞李应彪许程剑
杨爱霞, 李应彪, 许程剑
(石河子大学 食品学院,新疆 石河子832000)
阿魏菇,又名阿魏侧耳(Pleurotus ferulae Lenzi)阿魏蘑,属担子菌亚门层菌纲伞菌目侧耳科侧耳属[1],是干旱草原上具有代表性的蕈菌。原产于新疆草原、戈壁野生阿魏根茎上,国内仅分布于新疆塔城、阿勒泰地区。其子实体肉质肥厚,鲜嫩可口并且香味浓郁。而且此类菌含有丰富的蛋白质、碳水化合物、维生素、矿物质[2-3]以及凝集素等,阿魏菇还在抗肿瘤[4-5],抗疲劳,抗诱变等免疫调节方面都有良好的开发利用前景。
凝集素是一类具有选择性地、非共价可逆结合细胞表面糖链的蛋白质或糖结合蛋白[6]。它广泛存在于植物、动物等生物细胞膜上、细胞质内和细胞外基质中。其最大的特点在于它们能识别糖蛋白和糖脂。凝集素对糖的特异结合性决定了它在动植物体内具有一些重要而特殊的生物学功能,利用这些功能,可以提取出大量对生物养殖、生物工程、疾病防治等方面展示出广阔的应用前景的凝集素。由此可以看出对新疆阿魏菇凝集素的提取与理化性质研究的必要性是显而易见的。
1 材料与方法
1.1 材料与试剂
材料:阿魏菇:采于新疆阿勒泰天山地带;小鼠:石河子大学医学院动物饲养中心提供。
试剂:硫酸铵(分析纯):天津市光复科技发展有限公司产品;Tris(纯度>99.9%);丙烯酰胺(电泳级):北京鼎国长生生物技术有限公司产品;甲叉双丙烯酰胺(电泳级):北京鼎国长生生物技术有限公司产品;D-半乳糖(分析纯):上海蓝季科技发展有限公司产品;无水乙醇(分析纯):天津市富宇精细化工有限公司产品;乙二胺四乙酸(分析纯):上海试剂一厂产品;DEAE-cellulose52(离子交换剂),琼脂糖凝胶:北京鼎国生物技术有限责任公司产品;D36mm透析袋(XH419):北京鼎国生物技术有限公司产品。
1.2 仪器设备
Q/TEDUC台式高速冷冻离心机:力康发展有限公司产品;SH21-1恒温磁力搅拌器:上海梅颖浦仪器仪表制造有限公司产品;BT-200E恒流泵:上海琪特分析仪器有限公司产品;QT-58A智能核酸蛋白检测仪:配有可变式恒流泵;上海琪特分析仪器有限公司产品;BSZ160-LCD自动部分收集器:上海琪特分析仪器有限公司产品;FDU-1200真空冷冻干燥机:Tokyo Rikakikai,LTD 产品;Ultrospec-5300紫外分光光度仪:Amersham生物科技公司产品。
2 实验方法
2.1 凝集素粗提
取适量的成熟优质阿魏菇,用打浆机打碎阿魏菇组织,0.02 mol/L PBS浸泡过夜;第二天对浸泡液8 000 r/min离心20 min,弃沉淀,保留上清液待用;用石油醚萃取法去除上清液中的脂肪,待石油醚挥发干净后用体积分数70%硫酸铵的沉淀上清液中的蛋白质, 搅拌6~8 h,8 000 r/min离心20 min,收集沉淀弃去上清液,将沉淀再次溶解于质量分数70%的饱和硫酸铵,再离心收集沉淀溶解于PBS溶液中,透析除盐36~48 h,真空冷冻干燥即得凝集素粗品。
2.2 凝集素分离纯化
2.2.1 超滤 超滤[7]是一种加压膜分离技术,即在一定的压力下,使小分子溶质和溶剂穿过一定孔径的特制的薄膜,使大分子溶质不能透过,从而使大分子物质得到了部分的纯化。将凝集素粗品溶解,经过超滤装置截留样液一定相对分子质量大小,超滤6~8 h,期间补加蒸馏水4次,收集截留下来的样品A备用。
2.2.2 DEAE-cellulose52层析 将样品A装柱于直径为1.1 cm,柱长30 cm层析柱,填料DEAE-cellulose 52进行分离纯化,分别用浓度为0.1,0.2,0.3,0.4,0.5 mol/L 的 NaCl溶液进行洗脱,用自动集样器收集洗脱液各15管,280 nm处测定紫外吸收,绘制紫外吸收曲线[8],收集有峰值的管测定其凝血活性将其合并得到样品B。
2.2.3 琼脂糖凝胶层析 将Sepharose-4B与B溶液混合: 将15~20 mL B溶液与20 mL的Sepharose-4B于烧杯中混合,4℃,每隔0.5 h轻轻搅拌一次,共3 h。然后装柱于直径为1.1 cm,柱长30 cm层析柱。以1 mL/min的流速,用0.02 mol/L PBS洗脱杂蛋白约1 h,至基线平稳后停止。再用0.25 mol/L D-半乳糖溶液解吸附,并控制流速为1 mL/min,收集洗脱液,至280 nm吸光度值小于0.02将样品透析除盐后冷冻干燥,得目的凝集素。
2.3 SDS-PAGE凝胶电泳法纯度检验
分离胶质量浓度12 g/dL,浓缩胶质量浓度5 g/dL,垂直板电泳,电压120 V。样品用Tris-HCl(pH 6.8)0.5 mL;SDS 0.2 g; 溴酚蓝 10 mg; 甘油 1 mL;25 μL β-巯基乙醇(使用前添加);加去离子水5 mL配制而成的缓冲液进行处理。非变性电泳则不加SDS和β-巯基乙醇。
2.4 蛋白质质量浓度的测定
精确吸取含有 20、40、60、80、100 μg 的牛血清蛋白标准液0.5 mL,分别放入10 mL刻度试管中,加入5.0 mL G-250蛋白试剂,将样品稀释成50 μg/mL,其余操作完全相同。其操作同上。以吸光度A为纵坐标,蛋白质质量浓度为横坐标,作标准曲线。
通过标准曲线对照即可查得每毫升溶液中蛋白质的质量浓度[9]。
2.5 凝集素凝血活性及理化检测
2.5.1 凝集素凝集效价的检测 在96孔微型板上进行,自左至右各加50 μL生理盐水,于左侧第一孔加入凝集素样品液体,混合均匀后,吸取50 μL至第二孔,混合均匀吸取50 μL至第三孔,依次倍比稀释,至 n 孔,吸弃 50 μL。 静置 30~60 min,观察结果[10]。 则蛋白液稀释度为 1∶2;1∶4;1∶8;…1∶n。 以100%凝集(血球呈颗粒性伞状凝结于孔底)的蛋白最大稀释孔为该蛋白血凝效价[11],即一个血凝单位,不凝者红细胞沉于孔底呈点状,重复4组对照试验。最后以对凝集素最大倍稀释倍数(2n)来表示效价[11-12]。
2.5.2 温度对凝血活性的影响 在V形血凝板上,均加入体积分数1%的兔血红细胞,于10~100℃温度下测定凝集素的凝集效价分别静置2 h,记录实验结果[13]。
2.5.3 pH对凝血活性的影响 采用不同pH值的缓 冲 体 系 :pH 2,0.02 mol/L KCl-HCl;pH 3,0.02 mol/L HCl-Glv;pH 4 ~7,0.02 mol/L 柠 檬 酸 -Na2HPO4;pH 8 ~9,0.02 mol/L Tris-HCl;pH 10 ~11,0.02 mol/L NaHCO3-NaOH;pH 12~13,0.02 mol/L KCl-NaOH。测定凝集效价[14-15]。
2.5.4 阳离子对凝血活性的影响 在96孔微型板中先加入25 μL生理盐水,然后加入样品进行倍比稀释 , 再 加入 25 μL 0.01 mol/L 的 CaCl2,CuSO4,MgCl2,ZnCl2,KCl,FeCl3,FeCl2,AlCl3溶液,4 ℃静置2 h,再加入体积分数1%的鼠血细胞悬液,2 h后观察,测定凝集效价[16-17]。
2.5.5 盐度对凝血活性的影响 在96孔微型板中先将样品进行倍比稀释,再分别加入25 μL的1,10,20,30,40,50,60 g/L 浓 度的 NaCl溶液 ,2 h后加25 μL的红细胞的悬液,振荡混匀,4℃静置2 h后观察结果[16]。用25 μL生理盐水代替盐溶液作为空白对照。测定凝集效价。
3 结 果
3.1 凝集素粗提物离子交换层析结果
由图1可知当样品通过离子交换层析时,有两个洗脱峰,收集两部分的洗脱液并通过凝血实验测得峰1凝血活性较强,所以主要收集峰1进行后续的实验。
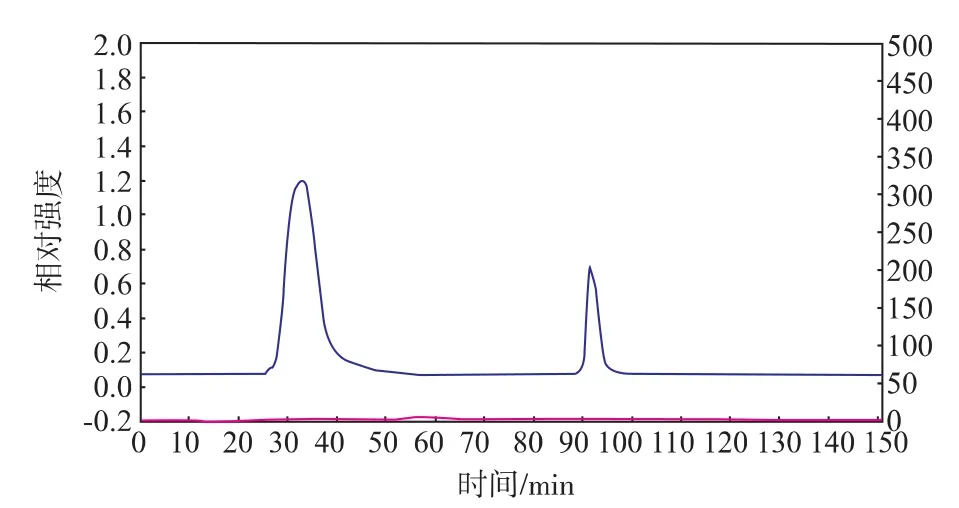
图1 凝集素粗提液在DEAE-52离子交换层析图Fig.1 DEAE-cellulose chromatogram of crude extract lectin
3.2 凝集素亲和层析结果图
通过将离子交换层析后的洗脱液经过Sepharose-4B层析在第210 min时出现的峰所对应的蛋白质具有明显的凝血活性,收集此处溶液透析冷冻干燥得到了较纯的凝集素,结果见图2。
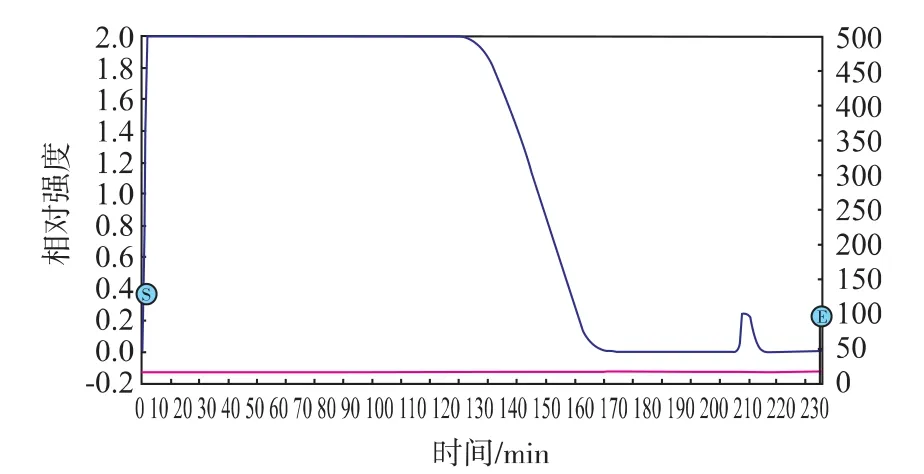
图2 凝集素粗提液在Sepharose-4B亲和层析图Fig.2 Sepharose-4B affinity chromatography of lectin
3.3 凝集素电泳实验结果
将回收得到的凝集素样品经SDS-PAGE电泳检测显示,根据迁移率计算得相对分子质量为17 500(图 3),经过 Native-PAGE 电泳检测显示(图 4),凝集素的相对分子质量也在17 500,说明阿魏菇凝集素不含有亚基结构,且纯度达到电泳纯级别。

图3 M:标准蛋白质样品;1道:经R-250染色的样品Fig.3 SDS-PAGE electrophoresis

图4 标准蛋白质样品;1.经R-250染色的样品Fig.4 Native-PAGE electrophoresis
3.4 蛋白质质量浓度
图5为标准曲线,对照即可查得阿魏菇凝集素蛋白质质量浓度为为84.33 μg/mL。从蛋白质质量浓度为可以看出凝集素的成分主要是蛋白质,含有部分糖基。
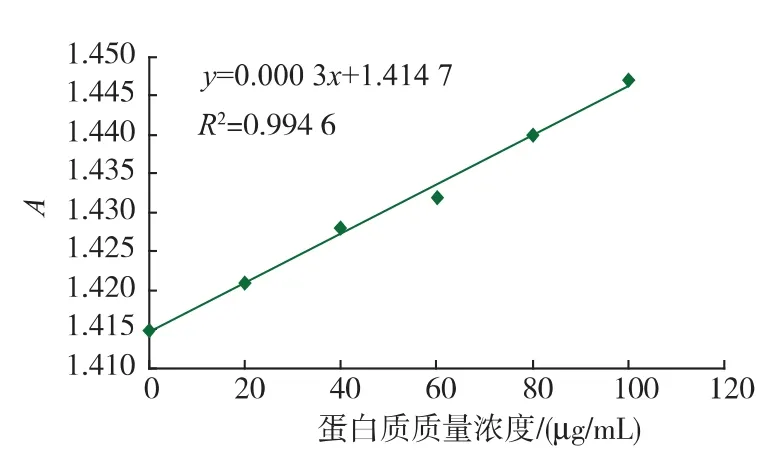
图5 蛋白质标准曲线Fig.5 Standard of Protein content
3.5 凝集素凝集效价测定及凝集效果图
小鼠血细胞悬液在显微镜下的形态如图6(a)所示,是游离的状态;而加入凝集素样品的血细胞悬液置于显微镜下观察拍照如图 6(b)、(c)所示,血细胞发生凝集。并且测得阿魏菇凝集素的凝集效价为28。

图6 显微镜下血细胞凝集图Fig.6 Blood cells hemagglutination of microscope
3.6 温度对凝血活性的影响
由表1可以看出凝集素在温度为0~40℃之间时性质稳定;在50~60℃之间时,凝血活性逐渐消失;在70℃以上则凝血活性全部消失。凝集素为一类特异性的糖蛋白,也具有蛋白不耐受高温、易变性失活的特性。
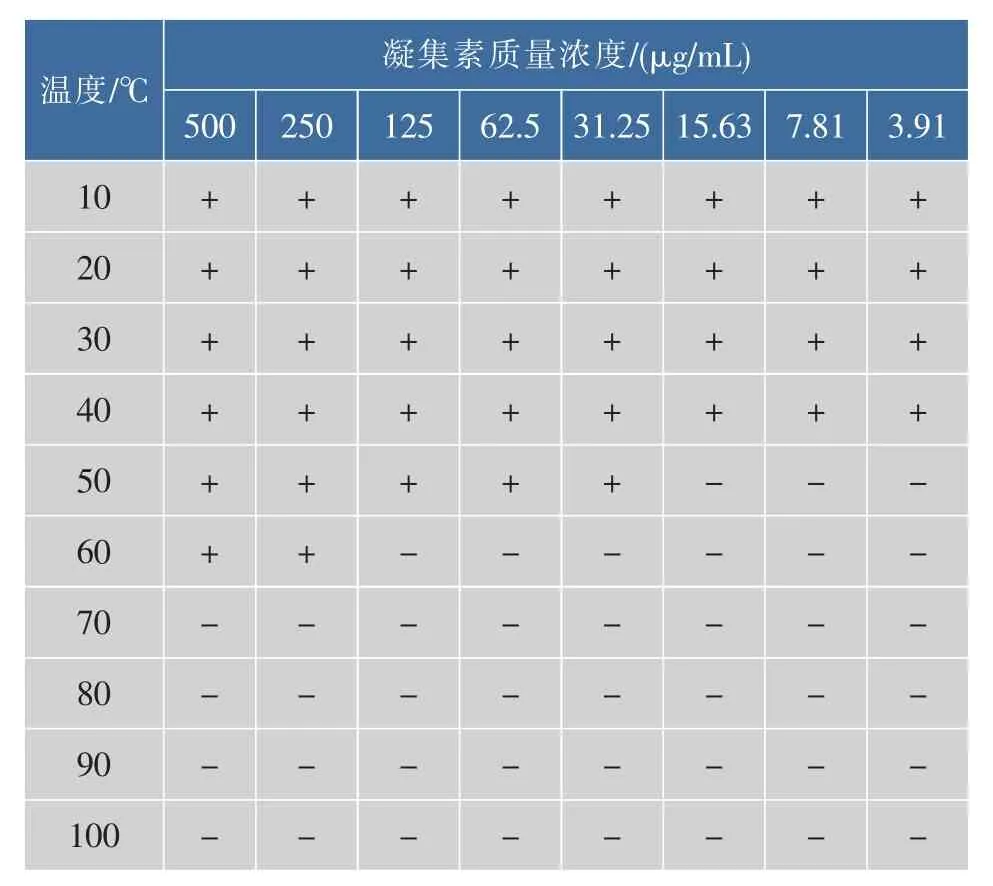
表1 温度对凝集效价的影响Table 1 Hemagglutination effect on the temperature Influence
3.7 pH值对凝血活性的影响
由表2可以看出pH条件对阿魏菇凝集素的作用较小。在pH 2~8时,凝集素凝集效价基本稳定,凝集素活性不受影响;当pH至9~10时,凝集效价逐渐降低,凝血活性减弱;当pH 11以上时,凝集效价为0,凝血活性消失。说明了凝集素在酸性及中性条件下性质稳定,却不耐受强碱。
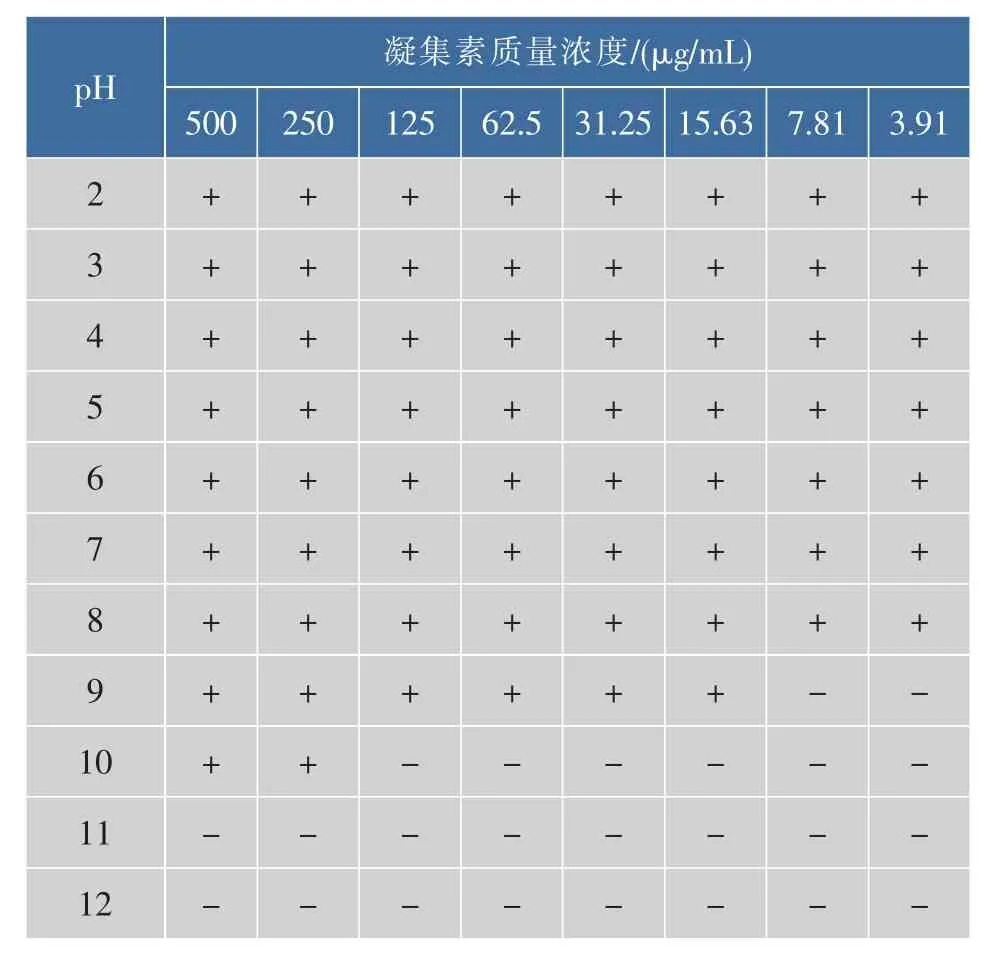
表2 pH对凝集素凝集效价的影响Table 2 Hemagglutination effect on the pH influence
3.8 阳离子对凝血活性的影响
由表 3 可以得出 Ca2+,Mg2+,Cu2+,Fe2+,Fe3+,K+,Al3+等金属离子对阿魏菇凝集素的凝集效价均有减弱的作用,而Zn2+具有增强凝集效果的作用,使得凝集素的效价升高至210。
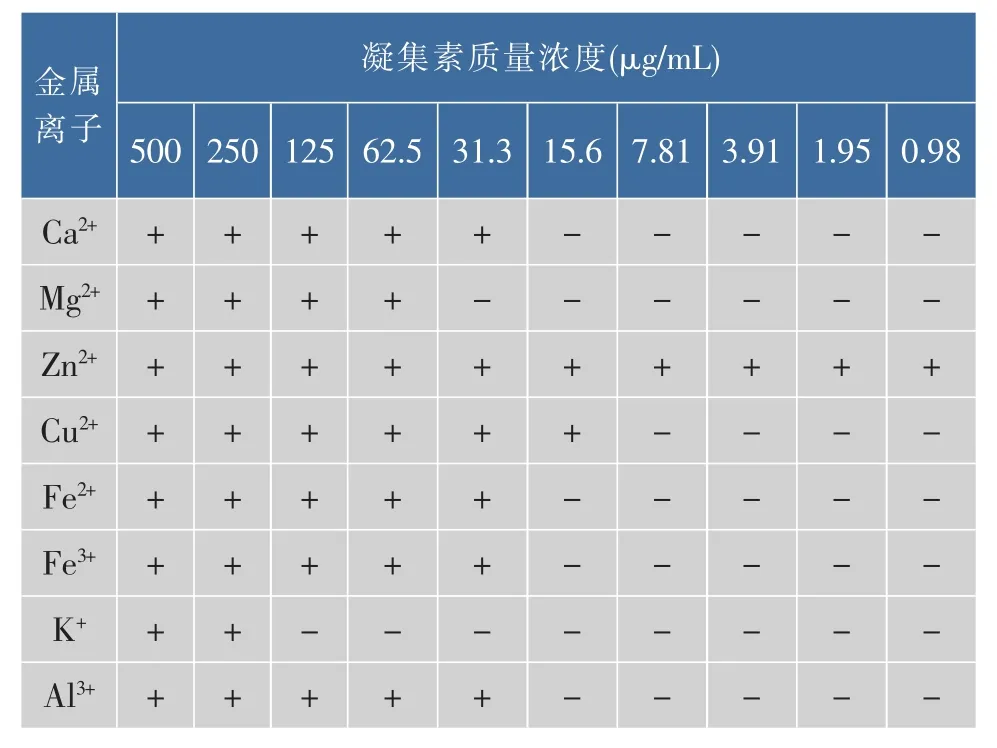
表3 金属离子对凝集素凝集效价的影响Table 3 Hemagglutination effect on the cations influence
3.9 盐度对凝血活性的影响
由表4可知,阿魏菇凝集素的凝集效价总体变化趋势是随着盐度的升高逐渐减弱,在盐质量浓度达到80 g/L时,凝集活性全部消失。说明凝集素活性受到盐浓度的抑制,质量浓度高于80 g/L以上,凝集素完全失活。其机理还有待进一步的研究。
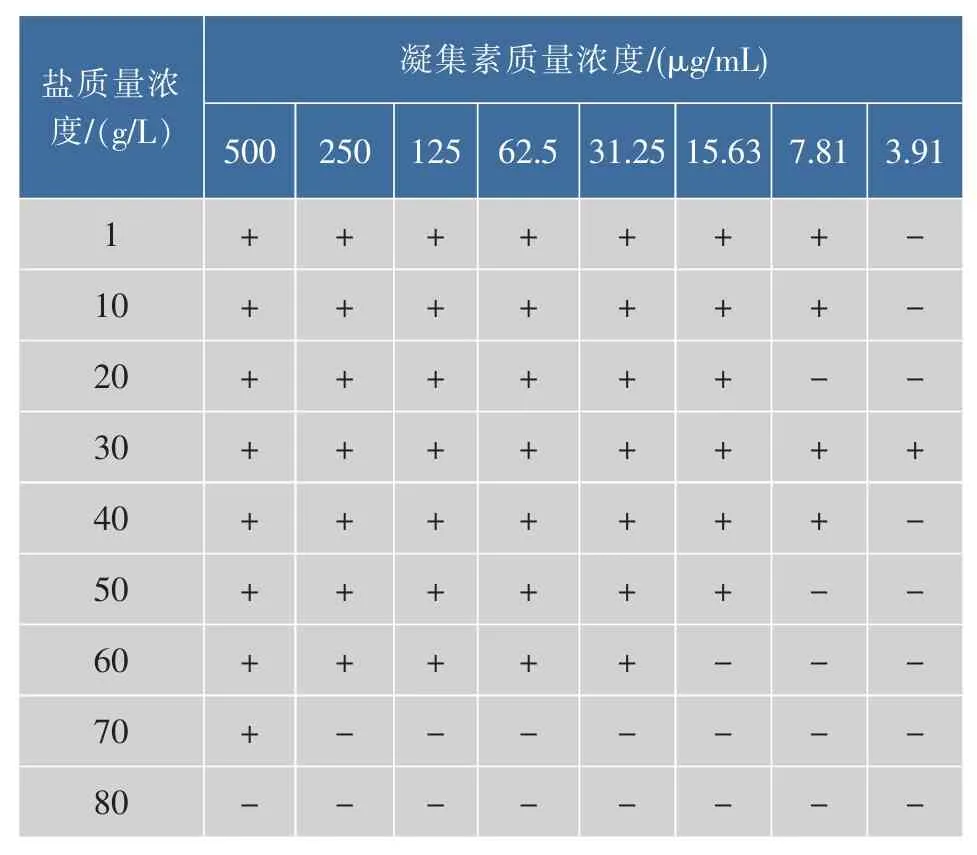
表4 盐度对凝集素凝集效价的影响Table 4 Hemagglutination effect on the salinity influence
3.10 糖抑制实验
由表可以看出除L-阿拉伯糖、棉子糖、D-纤维二糖、N-乙酰葡萄糖胺、N-乙酰半乳糖胺对凝集素凝血活性无影响仍是28,而其他的糖类对凝血活性都有一定的抑制的作用,尤其是D-半乳糖抑制作用最大,由原来的28变为22。
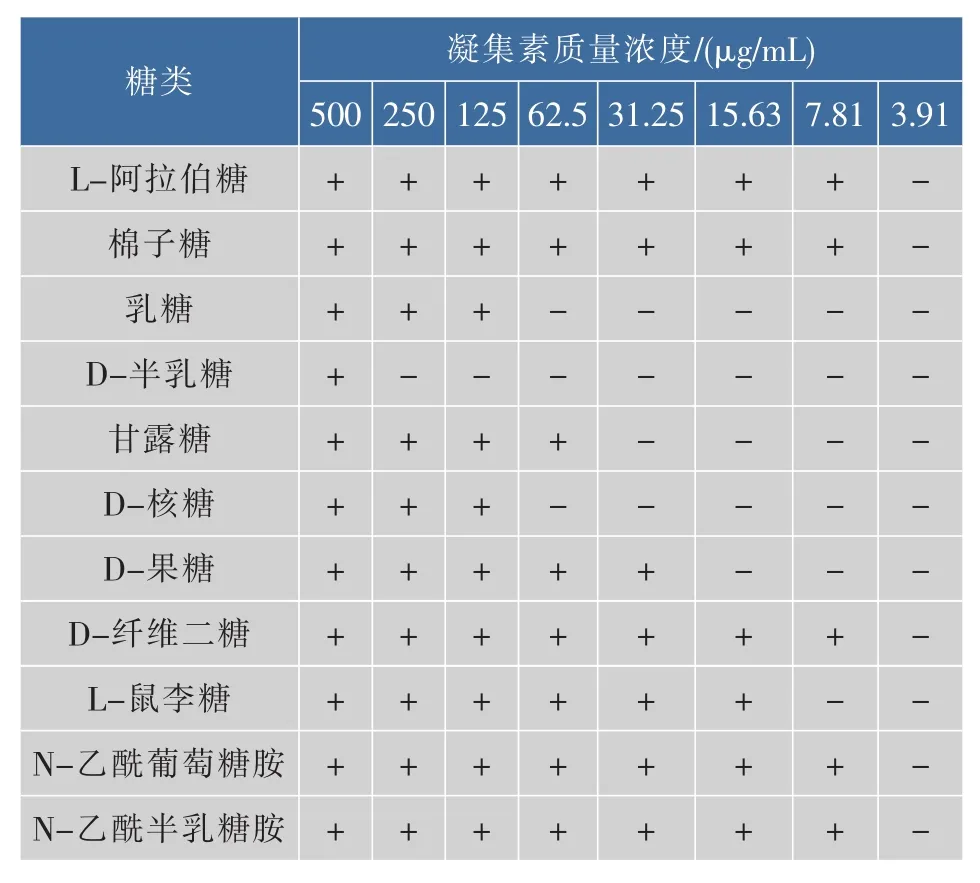
表5 糖对凝集素凝集活性的抑制结果Table 5 Result of inhibition on hemagglutination of lectins
4 结语
作者凭借优越的地理位置,采集了新疆特产阿魏菇,并对其提取方法进行了大量试验,找到了高效提取凝集素的方法。最终分离纯化,得到纯度较高的凝集素,通过对凝集素凝血活性的研究,了解了阿魏菇凝集素的一般理化性质,为此类凝集素在实际应用和免疫研究应用奠定一定的理论和实践基础。
1)凝集素的纯化 采用超滤浓缩、离子交换层析初步分离以及琼脂糖凝胶亲和层析法纯化的方高效法提取出了阿魏菇凝集素。选用的层析柱长为36 cm,直径为1.1 cm,离子交换层析选用DEAE-cellulose52,柱材料与填料质量比为3∶1;亲和层析的填料为NaOH活化过的Sepharose-4B,柱材料与填料比为1∶1,用PBS平衡液洗脱杂蛋白至A280nm<0.02,收集洗脱液透析跑电泳,证实无明显的蛋白条带;再用0.25 mol/L D-半乳糖溶液解吸附至A280nm<0.02,流速为1mL/min,收集洗脱液透析电泳,观察到单一的蛋白电泳条带,证实得到纯度较高的凝集素。
2)凝集素的电泳 SDS-PAGE和非变性PAGE结果均得到单一蛋白带,相对分子质量17 500左右,考马斯亮蓝R-250绘制标准曲线测得阿魏菇凝集素蛋白质质量浓度为84.33 μg/mL。Native-PAGE是在不破坏蛋白的天然结构和电荷的条件下,依据天然蛋白自身所带电荷和在电场与介质中泳动,一方面可以鉴定分离到的蛋白的纯度,一方面有利于蛋白的回收利用。
3)凝集素的凝血活性 阿魏菇凝集素的最高凝集效价为28;温度在0~40℃,凝血活性稳定,在40℃以上,凝血活性逐渐消失,证明该凝集素不耐高温;低pH环境下凝集素活性较为稳定,在pH>10以上的碱性环境下,凝血活性完全消失;阳离子中Zn2+显著增强凝集素的凝血活性;D-半乳糖是它的凝血活性的抑制剂。
综上所述利用本研究所积累的实践经验,进一步去筛选菌类凝集素,以找到最优质的凝集素,进行大量的纯化并应用于食品领域。此类凝集素不仅有着高度专一的识别作用;还有着抗真菌的作用;此外还发现其具有酶的活性和酶抑制剂的作用。在今后的研究中可通过利用其他的菌类凝集素或其他的植物活性提取物物质(如抗菌蛋白,肽,多糖等)做对比,从而更加全面地了解阿魏菇凝集素在生物体内活性及其作用机理进一步对其进行深入研究。
[1]陈海洲,罗建国.山区林场锯末栽培阿魏菇试验初报[J].北方园艺,2011(20):165-167.CHEN Haizhou,LUO Jianguo.Preliminary report on pleurotus ferulae cultivation with sawdust in mountainous forest farm[J].Northern Horticulture,2011(20):165-167.(in Chinese)
[2]Russell N J.Molecular adaptations in psychrophilic bacteria:potential for biotechnological applications[J].Adv Biochem Eng Biotechnol,1998,61:1-21.
[3]Tanaka S,Ko K,Kino K,et al.An immunomodulator from afungus Ganoderma lucidum bearing similarity to immunoglobin variable regions[J].J,Biol,Chem,1989,264:16372-16377.
[4]Jeurink P V,Noguera C L,Savelkoul H F,et al.Immunomodulatory capacity of fungal proteins on the cytokine production of human peripheral blood mononuclear cells[J].Int Immunopharmacol,2008(8):1124-1133.
[5]Zhang G,Sun J,Wang H,et al.First isolation and characterization of a novel lectin with potent antitumor activity from a Russula mushroom[J].Phytomedicine,2010(17):775-781.
[6]王戴玥,欧阳亮,王文颖.五种食用菌子实体凝集素的筛选及部分生物学活性的比较 [J].生命科学与农业科学,2013,09-0181-02.WANG Daiyue,OU Yangliang,WANG Wenyin.screening lectins of Five kinds of edible fungus fruiting body and the comparison of biological activities[J].Life science and Agricultural science,2013,09-0181-02.(in Chinese)
[7]卓燕,李晓斌,潘洁,等.超滤技术的应用和发展研究[J].硅谷,2010(7):127-128.ZHUO Yan,LI Xiaobing,PAN Jie,et al.Study on application and development of filtering technology[J].Silicon Valley,2010(7):127-128.(in Chinese)
[8]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版,1999:470-513.
[9]管玉兵.东北苍耳中生物活性物质的研究[D].吉林:吉林农业大学,2011.
[10]陈琳.香螺凝集素凝集素分离纯化、理化性质及季节变化规律的研究[D].福州:福建师范大学,2011.
[11]陈婧宜.刀豆凝集素提取分离纯化及性质研究[D].无锡:江南大学,2008.
[12]孙册,朱政,莫汉庆.凝集素[M].北京:科学出版社,1986.
[13]戴大章,刘建新,叶均安.饲料中的抗营养因子—植物凝集素的快速检测[J].饲料研究,2003,16(1):35-36.DAI Dazhang,LIU Jianxin,YE Junan.Anitinutritional factors in feed-fast detection of plant lectins[J].Feed Reaerch,2003,16(1):35-36.(in Chinese)
[14]Chumkhunthod P,Rodtong S,Lambert S T.Purification and characterization of an N-acetyl-D-galactosamine-specific lectin from the edible mushroom Schizophyllum commune[J].Biochimica et Biophysica Acta,2006(1760):326-332.
[15]田庚元,王晨,冯宇澄.构祀子糖蛋白的分离纯化、物化性质及糖肤键特征[J].生物化学与生物物理学报,1995,27(2):201-205.TIAN Genyuan,WANG Chen,FENG Yucheng.Isolation,purification and properties of LBGP and characterization of its glycanpeptide bond[J].Acta Biochimica et Biophysica Sinica,1995,27(2):201-205.(in Chinese)
[16]田兵.芦荟生物活性成分的分离提取、理化性质及药理作用研究[D].大连:大连理工大学,2002.
[17]唐海淑.骆驼蓬种子凝集素的分离纯化及其结构分析和生物活性研究[D].乌鲁木齐:新疆大学,2010,5.
[18]牟海洋,江晓路,刘树青.双壳贝类血清中凝集素凝集性能初步研究.对脊椎动物血细胞的凝集作用[J].青岛海洋大学学报,1999,29(2):249-254.MOU Haiyang,JIANG Xiaolu,LIU Shuqing.Properties of Hemagglutinins form the Serums of Shellfishes[J].Jouranl of Ocean University of Qindao,1999,29(2):249-254.(in Chinese)
[19]孙锋,谷文英,丁霄霖.山药粗多糖的提取工艺[J].食品与生物技术学报,2006,5.SUN Feng,GU Wenying,DING Xiaolin.Study on the extraction technology of polysaccharide form Dioscorea opposite thunb[J].Journal of Food Science and Biotechnology,2006,5.(in Chinese)
