螺旋藻抗氧化肽的制备及其体外活性研究
2014-12-25乔燕燕王维有任迪峰
欧 贇, 乔燕燕, 王维有, 候 凡, 王 宇, 任迪峰*, 鲁 军
(1.北京林业大学 生物科学与技术学院/北京市林业食品加工与安全重点实验室,北京 100083;2.中国食品发酵工业研究院/北京市蛋白功能肽工程技术研究中心,北京 100027;3.清华大学 玉泉医院,北京 100049)
众所周知,活性氧(Reactive Oxygen Species)如羟基自由基、氢过氧自由基等,是人体代谢的产物之一。ROS的增多会破坏DNA、蛋白质,酶等细胞分子,并导致癌症、心血管疾病和糖尿病等严重的疾病[1]。同样,油脂的氧化也会引起食品的腐败变质。抗氧化剂通过抑制氧化酶的活性、消耗环境中的氧以及提供氢原子来阻断活性氧和食品中油脂自动氧化的连锁反应。
虽然许多人工合成抗氧化剂在相关疾病的防治中得到广泛的使用,但是这些人工抑制剂如丁基羟基茴香醚(BHA)和特丁基对苯二酚(TBHQ)等,都无法避免地带有潜在的毒副作用。食源性的蛋白质水解物所含的多肽具有天然的抗氧化活性,易吸收,而且没有人工合成抗氧化剂的副作用[2]。鉴于天然抗氧化肽的优势,近年来一些研究已经验证了不同生物来源[3-5]的活性肽的抗氧化活性作用。
螺旋藻(Spirulina platensis)被誉为21世纪人类最理想的食品[6],其富含蛋白质、β-胡萝卜素、γ-亚麻酸、维生素E等营养成分[7]。同时,螺旋藻不仅包括8种人体必需氨基酸,还是目前已知植物中螺旋藻是蛋白质含量最高的一种[6],因此,螺旋藻是获得天然活性肽的潜在宝贵资源。
作者通过对螺旋藻粉冻融,超声等预处理,优化木瓜蛋白酶解条件,并结合超滤、凝胶过滤层析等方法,从钝顶螺旋藻的酶解液中分离、纯化得到活性肽,并对其进行体外生物活性研究,从而为螺旋藻抗氧化肽的开发和用于抗氧化功能食品和生物制药方面奠定基础。
1 材料与方法
1.1 主要材料与仪器
钝顶螺旋藻:北京林业大学螺旋藻研究所提供;牛血清白蛋白、木瓜蛋白酶(纯度99%)、L-半胱氨酸(分析纯)、1,1-二苯基-2-三硝基苯肼(DPPH)标准品(纯度99%)、总抗氧化能力检测试剂盒:南京建成生物工程研究所提供;抗坏血酸 (纯度99%)、无水乙醇、乙二胺四乙酸、氯化钠、无水硫酸铜、氢氧化钠、三氯乙酸、2-氨基-2-(羟甲基)-1,3-丙二醇(Tris)、盐酸、水杨酸、氨水均为分析纯。
WFZ752型紫外分光光度计:上海光谱仪器有限公司产品;Heto PowerDry LL1500冻干机:赛默飞世尔科技(中国)有限公司产品;FA1604N电子分析天平:上海精密仪器厂产品;Anke GL-20G-Ⅱ高速冷冻离心机:上海安亭科学仪器厂产品;DSY-2-8电热恒温水浴锅:北京国华医疗器械厂产品;层析柱:上海之信仪器有限公司产品。
1.2 方法
1.2.1 螺旋藻藻蓝蛋白的提取和质量分数测定螺旋藻粉20 g悬浮在160 mL蒸馏水中,在-18℃下缓慢冷冻,然后在25~30℃水浴解冻,反复5次,再用超声波破碎3 min,使藻蓝蛋白充分溶出。在6 000 g、4℃条件下离心30 min,离心后去除沉淀,收集蛋白上清液。
以牛血清白蛋白作为标准物,采用Bio-Rad Protein Assay Kit测定蛋白质质量分数[8]。上清液通过真空冷冻干燥,得到螺旋藻的蛋白粉,保存于4℃。
1.2.2 螺旋藻藻蓝蛋白酶解条件优化 为了得到较高的多肽浓度,确定木瓜蛋白酶水解螺旋藻藻蓝蛋白的最佳条件,根据预备实验结果设计正交试验方案,实验因素水平见表1。
1.2.3 三氯乙酸(TCA)法测定多肽质量分数 参考鲁伟等人[9]的方法进行测定。

表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal experiment
1.2.4 超滤 在30 mL底物质量浓度为2 g/dL的螺旋藻蛋白液中加入终浓度为2.0 mmol/L的乙二胺四乙酸、5.0 mmol/L L-半胱氨酸、300 mmol/L氯化钠,并在1.2.2得到的最佳酶解条件进行酶解。
将酶解液在6 000 g、4℃条件下经截留相对分子质量(MWCO)为30 000的超滤膜过滤去除酶等大分子物质,然后滤液经过不同截留相对分子质量(MWCO 10 000、3 000)的超滤膜在 4 ℃、6 000 g下超滤,获得具有不同相对分子质量的滤液,并按1.2.5中所介绍方法测定各部分滤液的体外抗氧化活性,滤液真空冷冻干燥后在4℃下保存。
1.2.5 抗氧化活性研究
1)清除DPPH自由基能力 参考Kim S Y等人[10]的方法进行测定。
2)清除羟基自由基能力 参考李超等人[11]的方法进行测定。
3)总抗氧化能力 参照总抗氧化能力检测试剂盒 (南京建成生物工程研究所)的操作说明,于520 nm处测定反应液的吸光度值,根据公式计算得到待测样品的总抗氧化能力。
1.2.6 螺旋藻活性肽的纯化 具有最高抗氧化活性的冻干粉溶解在10 mL 10 mmol/L Tris-HCl(pH 7.0)中,经脱气及 0.22 μm Supor膜过滤处理,然后通15/600 mm凝胶过滤柱分离。流动相为10 mmol/L Tris-HCl(pH 7.0,包含 150 mmol/L NaCl),流量为0.8 mL/min。洗脱峰在215 nm波长处进行检测并收集,然后按1.2.5中所介绍方法检测抗氧化活性。
2 结果与分析
2.1 螺旋藻蛋白质质量分数的测定结果
经Bio-Rad Protein Assay方法测定螺旋藻蛋白质含量的标准曲线如图1所示。在稀释不同倍数的样品中,其中稀释50倍的螺旋藻蛋白液在595 nm处的吸收值为0.369,基本落在标准曲线的有效线性范围。因此,根据该样品计算得到螺旋藻的蛋白质质量分数约为56%。

图1 Bio-Rad Protein Assay标准曲线Fig.1 Standard curve of Bio-Rad Protein Assay
2.2 正交实验结果
木瓜蛋白酶水解的正交试验结果及方差分析见表2及表3。

表2 正交试验分析Table 2 Analysis of the orthogonal experiment

表3 正交试验方差分析Table 3 Variance analysis for the orthogonal experiment
由正交试验方差分析可知,在α=0.01水平上,A因素(温度)的不同处理水平对指标影响显著;B因素(酶底比)、C因素(时间)和D因素(pH)的不同处理水平对指标影响不显著。确定各因素的主次关系为A>B>C>D,最优组合为A2B2C3D2,即温度为60℃,酶质量分数1.6%,时间为9 h,pH为7.0。
2.3 不同相对分子质量范围螺旋藻酶解液的抗氧化活性
螺旋藻的木瓜蛋白酶水解液经超滤得到不同分子量范围的酶解液。如表4所示,相对分子质量范围为0到3 000的酶解液具有最强的抗氧化活性,表明该片段活性肽捕获自由基更容易[12-13],因此选择该部分酶解液进行抗氧化肽的纯化。各酶解液的抗氧化肽得率按酶解前后215 nm处吸光度值的比值确定,从表2可知,相对分子质量范围为0到3 000的酶解液的得率为(13.23±1.24)%。
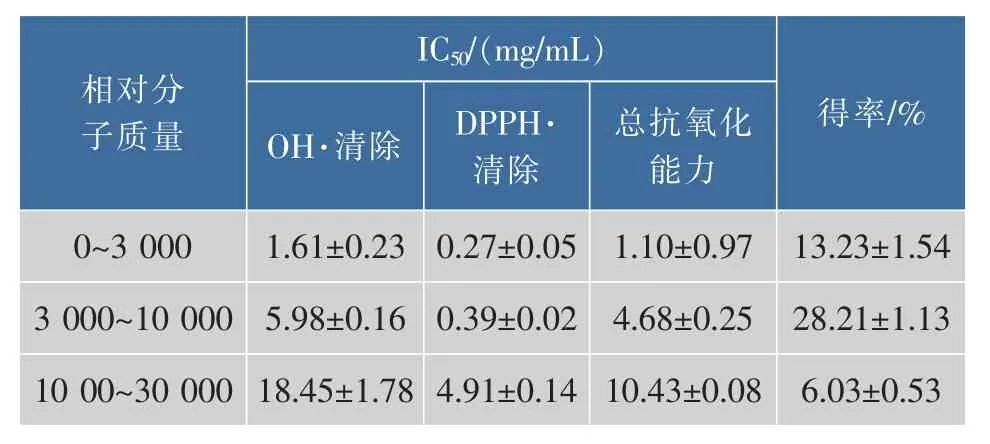
表4 螺旋藻木瓜蛋白水解液的抗氧化活性Table 4 Antioxidative activities of the papain hydrolysates of Spirulina platensis
2.4 抗氧化肽的纯化
相对分子质量范围为0到3 000的螺旋藻酶解液经凝胶过滤柱分离,从图2可以看出,在215 nm处有4个主要吸收峰(I~IV)。经1.2.5中所介绍方法检测抗氧化活性,测得吸收峰III具有最强的抗氧化活性。

图2 木瓜蛋白水解液的凝胶色谱图(Sephadex G-15层析柱(1.6 cm × 60 cm))Fig.2 Gelfiltration chromatogram ofthe papain hydrolysates on a Sephadex G-15 column(1.6 cm×60 cm)

图3 DPPH·清除标准曲线Fig.3 Clearance curve of DPPH·

图4 OH·清除标准曲线Fig.4 Clearance curve of OH·
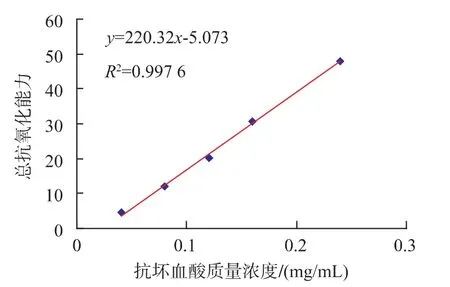
图5 总抗氧化能力标准曲线Fig.5 Total antioxidative capability curve
根据抗坏血酸标准曲线,计算出清除50%DPPH自由基所需的抗坏血酸溶液用量即为半数有效量 IC50,得到 IC50(抗坏血酸)=18.36 μg/mL,而经过凝胶层析得到螺旋藻活性肽(III峰)原液(质量浓度C=0.104 2 mg/mL)的DPPH自由基清除率为(28.49±1.05)%,相当于(10.01±0.68) μg/mL 的抗坏血酸溶液。
同理可知,质量浓度为0.104 2 mg/mL螺旋藻活性肽(III峰)的清除羟基自由基清除率与(0.477±0.028)mg/mL的抗坏血酸相同,螺旋藻活性肽(III峰)原液的总抗氧化能力相当于该试剂盒条件下浓度为(0.037 9±0.008 1)mg/mL的抗坏血酸溶液。
因此,螺旋藻活性肽比相同质量的浓度的米蛋白短肽[14]的抗氧化能力强,说明是一种具有较强抗氧化活性的天然活性肽。该天然活性肽具有营养丰富、易吸收、无毒副作用等特点,因而该活性肽具有很好的应用前景。
3 结 语
木瓜蛋白酶水解的最适工艺条件为:酶质量分数1.6%、温度60℃、水解时间9 h、pH 7.0。在最佳木瓜蛋白酶优化工艺下,水解钝顶螺旋藻,通过超滤得到不同相对分子质量范围的抗氧化肽混合液,其中相对分子质量范围为0到3 000的酶解液活性最高。
经过层析得到螺旋藻活性肽(III峰)原液(C=0.104 2 mg/mL)具有较强的抗氧化活性,其DPPH·清除率、OH·清除率和总抗氧化能力分别相当于质量浓度为(1.01±0.07)×10-2mg/mL、(4.77±0.28)×10-1mg/mL 和(3.79±0.81)×10-2mg/mL 的抗坏血酸溶液。小分子肽不但具有易吸收的特点,而且经肠胃消化有良好的稳定性[15],因此,该活性肽在保健食品和药品中具有很好的应用前景。
[1]Moskovitz J,Yim K A,Choke P B.Free radicals and disease[J].Archives of Biochemistry and Biophysics,2002,397(2):354-359.
[2]Korhonen H,Pihlanto A.Food-derived bioactive peptides-opportunities for designing future foods[J].Current Pharmaceutical Design,2003,9(16):1297-1308.
[3]Chen J R,Suetsuna K,Yamauchi F.Isolation and characterization of immunostimulative peptides from soybean[J].The Journal of Nutritional Biochemistry,1995,6(6):310-313.
[4]Ren J,Zhao M,Shi J,et al.Purification and identification of antioxidant peptides from grass carp muscle hydrolysates by consecutive chromatography and electrospray ionization-mass spectrometry[J].Food Chemistry,2008,108(2):727-736.
[5]Bougatef A,Hajji M,Balti R,et al.Antioxidant and free radical-scavenging activities of smooth hound (Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1198-1205.
[6]张学成,信式祥,李清华,等.螺旋藻——最完美的功能性食品[M].青岛:青岛海洋大学出版社,1999:55-89.ZHANG Xincheng,XIN Shiyang,LI Qinghua,et al.Spirulina-the most perfect function food[M].Qingdao:Press of Ocean University of China,1999:55-89.(in Chinese)
[7]Rodríguez-Hernández A,Blé-Castillo J L,Juárez-Oropeza M A,et al.Spirulina maxima prevents fatty liver formation in CD-1 male and female mice with experimental diabetes[J].Life Sciences,2001,69(9):1029-1037.
[8]Bradford M.A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein dye binding[J].Analytical Biochemistry,1976,72(1-2):248-254.
[9]鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2008,26(7):169-171.LU Wei,REN Guopu,SONG Junmei.Determination of content of peptides in protein hydrolysates[J].Food Science,2008,26(7):169-171.(in Chinese)
[10]Kim S Y,Kim J H,Kim S K,et al.Antioxidant activities of selected oriental herb extracts[J].Journal of the American Oil Chemists'Society,1994,71(6):633-640.
[11]李超,李姣姣.回心草总黄酮清除羟基自由基活性研究[J].粮油加工,2010(8):163-165.LI Chao,LI Jiaojiao.Study on hydroxyl radical scavenging activity of total flavonoids in Rhodobryum giganteum[J].Cereals and Oils Processing,2010(8):163-165.(in Chinese)
[12]Zhang Y F,Duan X,Zhuang Y L.Purification and characterization of novel antioxidant peptides from enzymatic hydrolysates of tilapia(Oreochromis niloticus) skin gelatin[J].Peptides,2012,38(1):13-21.
[13]苏春燕,朱科学,周惠明.超滤发分离富集谷朊粉抗氧化活性肽[J].食品与生物技术学报,2011,30(1):44-48.SU Chun-yan,ZHU Ke-xue,ZHOU Hui-ming.Preparation and enrichment antioxidant peptides from wheat gluten hydrolysate using ultrafiltration[J].Journal of Food Science and Biotechnology,2011,30(1):44-48.(in Chinese)
[14]陈升军,熊华,周侃,等.米蛋白短肽抗氧化活性研究[J].食品科技,2008,33(12):177-180.CHEN Shengjun,XIONG Hua,ZHOU Kan,et al.Study on antioxidant activity of the short rice protein peptide[J].Food Science and Technology,2008,33(12):177-180.(in Chinese)
[15]Gómez-Ruiz J A,Ramos M,Recio I,et al.Identification of novel angiotensin-converting enzyme-inhibitory peptides from ovine milk proteins by CE-MS and chromatographic techniques[J].Electrophoresis,2007,28(22):4202-4211.
