高渗胁迫对光滑球拟酵母转录组的影响
2014-12-25刘立明
徐 沙 , 刘立明
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 糖生物学与生物技术教育部重点实验室,江苏 无锡 214122;3.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122)
转录组(Transcriptome)指一个活细胞在特定状态下所能转录出来的所有mRNA的总和,包括编码RNA和非编码RNA[1]。研究转录组的一个重要方法是利用DNA芯片技术检测有机体基因组中基因的表达。从基因组DNA转录的mRNA的总和即转录组,也称为表达谱,是研究细胞表型和功能的一个重要手段。微生物在遭受某种刺激时,往往会伴随着某些基因表达水平的变化。在一个有生命的生物系统中,基因组是遗传信息的储存体,mRNA是基因表达的中间体,功能性蛋白质是基因功能的执行体。因此,基因组和转录组两者的关系不是一一对应的[2-3]。
作者前期研究发现,光滑球拟酵母(Torulopsis glabrata)在生产丙酮酸的过程中,随着NaOH的不断流加,发酵液渗透压逐渐提高,成为丙酮酸进一步积累的关键限制性因素[4]。作者所在研究室通过选育一株能在含有70 g/L NaCl的培养基中正常生长的突变株,使丙酮酸产量提高了41.1%[5]。目前,国内外针对酵母应对渗透压胁迫的机制已有一些研究。Rep等在研究高渗胁迫对酿酒酵母转录水平的影响时发现,多数上调基因的功能是编码渗透保护蛋白质或者是甘油、海藻糖和糖原代谢途径中的酶[6]。随后,Yale等研究NaCl胁迫不同时间后(10、30 min和90 min)酿酒酵母转录水平的变化。结果表明,随着胁迫时间的延长,上调基因的数量逐渐增加,且与能量相关的基因表达随着胁迫时间的延长而升高,在30 min时出现峰值[7]。国内Han Yanping等对鼠疫耶尔森氏杆菌(Yersinia pestis)在高渗和高盐胁迫下的差异表达基因进行分析,结果发现那些合成渗透保护剂转运蛋白质和一系列致病因子的基因以及一些全局性转录因子都发生了上调[8]。
虽然已有文献报道了高渗胁迫对酵母转录组的影响,但在T.glabrata中尚未见文献报道。T.glabrata发酵过程的主要产物丙酮酸,是糖酵解途径的最终产物,在后续的代谢中,将进入线粒体氧化生成乙酰CoA,进入三羧酸循环,最终被氧化成CO2和水。其代谢过程中产生的NADH会进入氧化磷酸化途径,为细胞提供大量ATP。因此中心代谢途径和能量代谢途径对丙酮酸生产来说非常重要。此外,已有研究表明,氨基酸是重要的微生物相容性溶质,可以保护细胞抵御渗透压胁迫的影响[9]。基于上述分析,本文着重讨论了糖酵解途径、三羧酸循环、氧化磷酸化和氨基酸代谢途径中关键酶转录水平的变化,以期能够从整体水平揭示特定生物学过程以及胁迫过程的分子机理,研究不同渗透压条件下基因转录水平的变化,为后续研究如何提高T.glabrata抵御高渗胁迫的能力提供理论依据。
1 材料与方法
1.1 菌种
T.glabrata CCTCC M202019,为烟酸(NA)、硫胺素(B1)、吡哆醇(B6)和生物素(Bio)的营养缺陷型,由作者所在研究室自行筛选并保藏[9]。
1.2 培养基
1.2.1 斜面和种子培养基 葡萄糖20 g/L,蛋白胨10 g/L, KH2PO41 g/L, MgSO4·7H2O 0.5 g/L, 琼脂20 g/L(斜面培养基用)。
1.2.2 发酵培养基 葡萄糖100 g/L,NH4Cl 7 g/L,KH2PO45 g/L, MgSO4·7H2O 0.8 g/L, 乙酸钠 6 g/L,烟酸4 mg/L,盐酸硫胺素30 μg/L,烟酸吡哆醇100 μg/L,生物素 10 μg/L,核黄素 50 μg/L, CaCO340 g/L(仅限摇瓶培养时调节pH用)。添加NaCl改变发酵培养基渗透压,0、30、50、80 g/L NaCl对应的溶液渗透压分别为860,1 765,2 603 mOs mol/kg和3 324 mOs mol/kg。培养基初始pH 5.5。维生素液过滤除菌后加入。
1.2.3 摇瓶培养 从新鲜斜面上接一环菌入种子培养基 (50 mL置于500 mL的锥形瓶),于30℃、200 r/min下摇瓶培养24 h后,以体积分数10%接种量接入发酵培养基。摇瓶发酵:500 mL的锥形瓶中发酵培养基为50 mL,温度30℃,转速200 r/min,发酵时间为48 h。
1.3 渗透压测定
发酵液渗透压采用OSMOMAT 030冰点渗透压仪测定。
1.4 RNA的提取与表达谱芯片分析
1.4.1 总RNA抽提(Trizol法)
1)取对数生长中期的细胞,每2×107个细胞加入1 mL Trizol,在震荡混匀后,液氮研磨充分破碎细胞。
2)按体积比1∶5加入氯仿,充分混匀后室温静置5 min。
3)4℃,12 000 r/min离心15 min,取出上清液并转入新1.5 mL的离心管中,加入等体积异丙醇混匀,室温静置5 min。
4)4℃、12 000 r/min离心10 min,去上清液后,按体积比2∶5向沉淀中加入体积分数70%的乙醇,4℃、12 000 r/min离心洗涤沉淀15 min。
5)沉淀室温晾干后,加入适量无RNA酶水充分溶解,测定OD260和OD280值。
6)按操作说明采用无RNA酶的DNA酶I(Takara)处理。
1.4.2 基因芯片合成 表达谱芯片由上海康成生物工程有限公司委托Agilent依据Torulopsis glabrata CBS 138基因组全序列设计合成。基于Sanger的测序结果表明,T.glabrata CCTCC M202019的18s rRNA与该菌株100%一致。
1.4.3 芯片杂交与洗涤 委托上海康成生物工程有限公司完成。
1.4.4 芯片扫描与数据分析
1)通过 Agilent Scanner获取图像并在 10 μm条件下扫描像素值;
2)图像使用Feature Extraction进行定量分析,得到图像定量和标准化处理数据。
2 结果与分析
2.1 转录组概况
T.glabrata细胞在不同的渗透压条件下(860、1 765、2 603 mOs mol/kg 和 3 324 mOs mol/kg)培养到对数生长中期,收集细胞,采用全基因组芯片检测进行全基因组基因表达水平分析。根据NCBI数据 库 (http://www.ncbi.nlm.nih.gov/)中 的 T.glabrata CBS138基因信息,在芯片上设计了5 280个寡核苷酸探针,其中有5 009个基因的表达被检测出来。利用GenBank、KEGG、UniProt等公共数据库对未知基因进行高精度注释,结果有3 500个以上的基因可以通过基因注释初步确定其功能。
一般认为基因表达水平发生2倍及以上变化的基因发生了差异表达。在渗透压为1 765、2 603 mOs mol/kg和3 324 mOs mol/kg的条件下,相对于对照条件(860 mOs mol/kg),分别有 1 335、1 155 和1 630个基因转录水平上调,818、789和770个基因转录水平下调。
2.2 GO功能富集
对上述差异基因进行GO功能富集分析,结果见图 1。高渗胁迫条件(1 765、3 324 mOs mol/kg)与正常条件(860 mOsmol/kg)相比,发生转录水平上调变化的基因主要集中于以下功能类群(图1(a)):结合 (binding)、DNA 结 合 (DNA binding)、 核 酸 结 合(nucleic acid binding)、蛋白激酶活性(protein kinase activity)、镁离子结合(magnesium ion binding)、激酶活性(kinase activity)、催化活性(catalytic activity)、核苷酸结合(nucleotide binding)、水解酶(hydrolase activity)、 蛋白质结合 (protein binding)、 肽活性(peptidase activity)、氧化还原酶活性(oxidoreductase activity)、ATP 结合 (ATP binding)、GTP 结合(GTP binding)、锌离子结合(zinc ion binding)、金属离子结 合 (metal ion binding)、 转运活性 (transporter activity)、转移酶活性(transferase activity)、蛋白激酶活性(protein kinase activity)。
这些功能类群主要参与蛋白质翻译及修饰、能量代谢、核酸复制和物质转运等过程。转录发生下调的基因主要功能类群(图1(b)),除与上调基因相同的部分之外,还包括序列特异的DNA结合转录因 子 的 活 性 (sequence-specific DNA binding transcription factor activity)、解旋酶的活性(helicase activity)、蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)和RNA结合(RNA binding)等。
进一步分析在较低高渗条件 (1 765 mOs mol/kg)和极端高渗条件下(3 324 mOs mol/kg)转录水平提高10倍以上的基因。其中已知功能的分别有90和96个(图2,只选取提高倍数前50的基因作图)。其中细胞壁甘露糖蛋白质(CAGL0I06204g)、脂肪酸延伸蛋白质(CAGL0L08184g)的转录水平在较低的高渗条件下提高了60倍以上;另外,产孢调节蛋白质(CAGL0E04840g)、磷脂酶(CAGL0J11748g)、信息素调节膜蛋白质 4(CAGL0M02167g)和 10(CAGL0G04433g)等的转录水平也都有不同程度的大幅提高。在极端高渗条件下(3324 mOs mol/kg),信息素调节膜蛋白质10甚至提高了88.6倍,而脂肪酸延伸蛋白质和细胞壁甘露糖蛋白质的上调水平相比较低的高渗条件略有下降,分别提高了54.9倍和34.8倍。除此之外,液泡碱性氨基酸转运蛋白质(CAGL0J01375g)的转录在极端高渗条件下(3 324 mOs mol/kg)增加了11.70倍,高于渗透压较低情况下(1 765 mOs mol/kg)的2.70倍。

图1 高渗培养条件下差异表达基因的GO功能富集分析Fig.1 GO functional enrichment analysis of differentially expressed genes
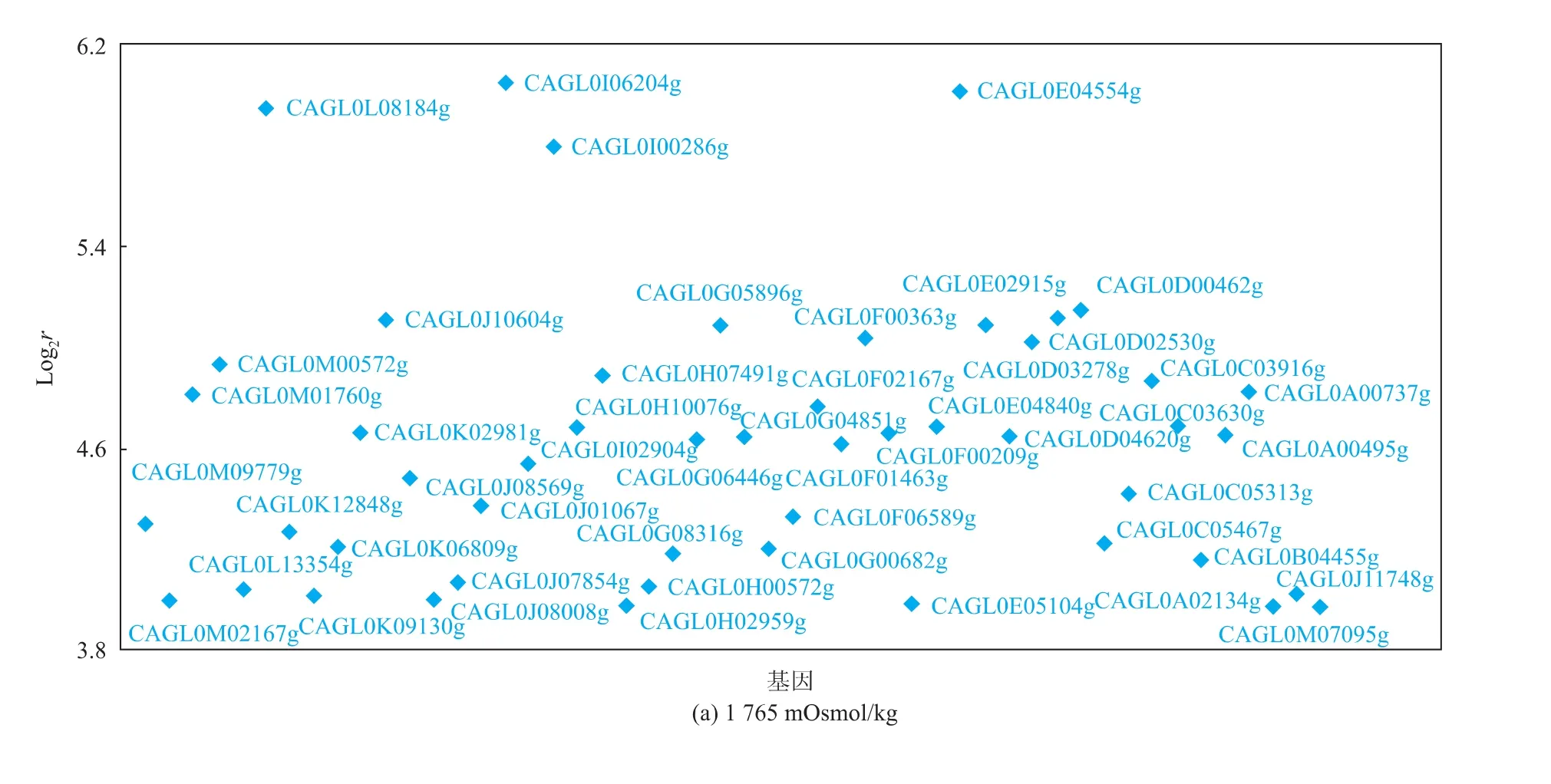

图2 在高渗条件下表达水平上调10倍以上的基因Fig.2 Genes upregulated more than 10 times by hyperosmotic stress
在两种高渗条件下 (各为1 765 mOs mol/kg和3 324 mOs mol/kg)转录水平都提高10倍以上的基因共58个。这表明在这两种情况下,T.glabrata细胞调控表达的机制可能有所不同。但是仍然可以发现,这些表达量大幅度提高的基因主要是细胞壁、细胞膜相关的和一些膜上的信息素蛋白质基因。因为细胞外环境的改变直接作用于微生物的细胞壁和细胞膜,胞外渗透压提高,胞内水分外流,随后胞内溶液浓度升高,从而导致细胞体积减小,肽聚糖层被破坏,并最终质壁分离。细胞壁和细胞膜最先感应到外界环境的改变,其受影响的程度可能是最为剧烈的。
2.3 糖酵解途径中的基因表达谱
糖酵解是将葡萄糖降解为丙酮酸并伴随着ATP生成的一系列反应。如表1所示,在高渗环境下,EMP途径中有7个基因的转录水平发生了上调,这7个基因分别涉及到6种酶,即己糖激酶(CAGL0H07579g)、 6- 磷 酸 葡 萄 糖 变 构 酶(CAGL0K03289g)、 6- 磷 酸 葡 萄 糖 异 构 酶(CAGL0H05445g)、 6- 磷 酸 果 糖 激 酶(CAGL0F08041g和 CAGL0L10758g)、 3-磷酸甘油酸脱氢酶 (CAGL0J00451g)和丙酮酸激酶(CAGL0E05610g)。另外,在高渗条件下,有1个基因转录水平略微下调,即1,6-二磷酸果糖酶(CAGL0H04939g)。 但是,1,6-二磷酸果糖酶催化1,6-二磷酸果糖为6-磷酸果糖,是EMP途径的逆反应,其转录水平的下调对EMP途径的代谢有促进作用。
EMP途径中有3个酶参与不可逆反应,分别是磷酸果糖激酶,己糖激酶和丙酮酸激酶,这3种酶调节着糖酵解的速度。研究结果发现,非极端高渗环境对己糖激酶、磷酸果糖激酶和丙酮酸激酶的基因转录有一定的诱导作用,但在极端高渗条件下诱导作用不明显。总体而言,相比正常条件高渗环境下的酵母细胞EMP途径略有上调,但幅度不大,而且多数基因的表达水平只在渗透压相对较低的条件下(1 765 mOs mol/kg)有所提高,极端高渗条件下没有基因发生明显上调,说明EMP途径的转录水平和渗透压的影响关系不大。
2.4 三羧酸途径中的基因表达谱
三羧酸循环(Tricarboxylic acid cycle,TCA)在动植物、微生物细胞中普遍存在,不仅是糖代谢的核心途径,也是脂肪、蛋白质分解代谢的最终途径。如表2所示,T.glabrata在高渗条件下,TCA循环途径相关基因转录水平整体上调。α-酮戊二酸脱氢酶E1组 分 (CAGL0G08712g)、 柠 檬 酸 合 酶(CAGL0B03663g和CAGL0L09086g)、 异柠檬酸脱氢酶(CAGL0I07227g 和 CAGL0B04917g)、苹果酸脱氢酶(CAGL0L05236g)、丙酮酸脱氢酶E1组分β亚基 (CAGL0K06831g)和丙酮酸脱氢酶 E2组分(CAGL0J10186g)等TCA循环中的关键酶基因,均在高渗条件下表达被诱导。只有延胡索酸酶(CAGL0A01045g)、丙酮酸羧化酶(CAGL0F06941g)和琥珀酸脱氢酶(CAGL0C03223g)在极端高渗条件下基因表达水平受到抑制。

表1 糖酵解途径中的差异表达基因Table 1 Differential expression genes in EMP pathway
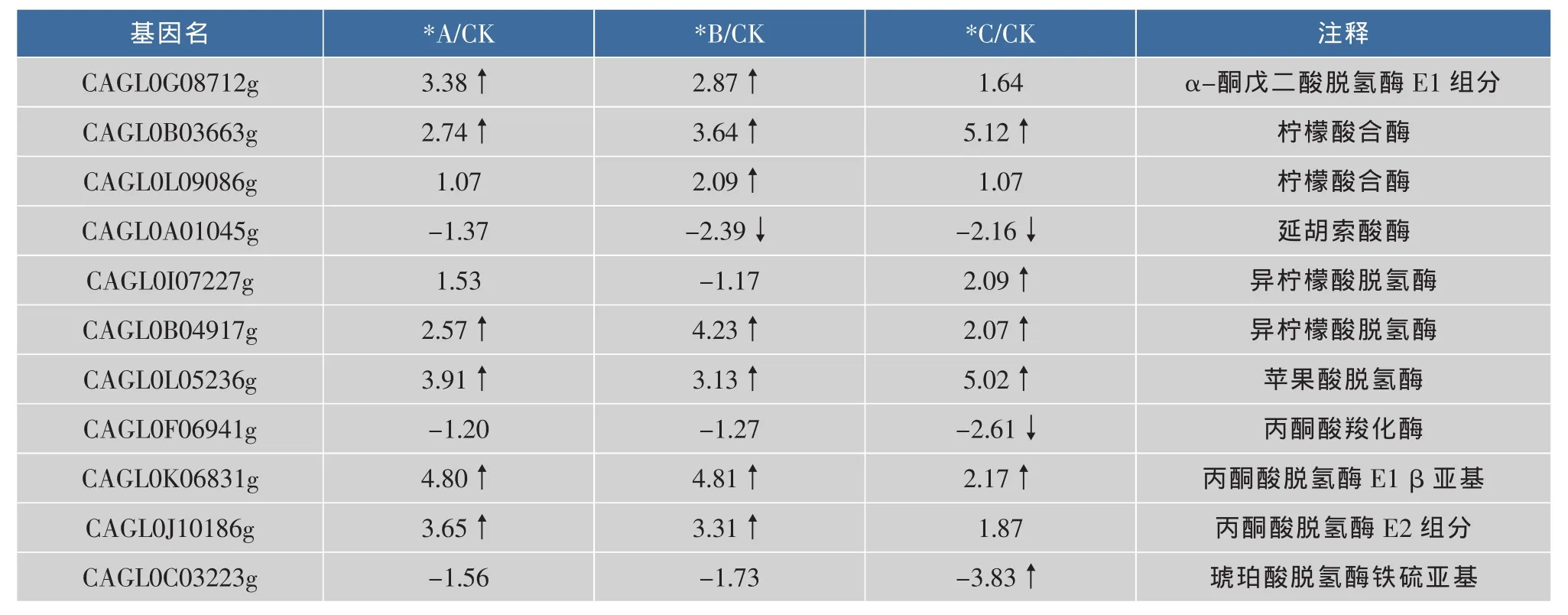
表2 三羧酸循环途径中的差异表达基因Table 2 Differential expression genes of TCA cycle
TCA循环的多个反应都是可逆的,但是柠檬酸的合成及α-酮戊二酸的氧化脱羧二步反应是不可逆的。因此三羧酸循环的调节部位有3个,即柠檬酸合酶、异柠檬酸脱氢酶和α-酮戊二酸脱氢酶催化的反应。这3个酶催化反应都伴随着ATP的形成或NADH的产生 (进入氧化磷酸化途径最终形成ATP)。在高渗条件下,这3个酶有部分基因的转录发生了上调。可能的原因是:环境渗透压过高,导致胞内Na+含量增加,并且对细胞具有毒害作用,触发Na+/H+反向输送,逐出Na+,引入质子,需要消耗一定的能量。另外,细胞需要合成一些特定的相容性溶质来抵御渗透压胁迫,这些物质的合成也需要消耗能量。因此,细胞需要加快产能途径的代谢来满足微生物抵御胁迫的需要。
2.5 磷酸戊糖途径的基因表达谱
磷酸戊糖途径的主要作用是:产生NADPH(NADPH不参与呼吸链,不产生ATP),为细胞的各种合成反应提供还原力;生成磷酸核糖,为核酸代谢做物质准备;分解戊糖,其中间产物为许多化合物的合成提供原料。
如表3所示,磷酸戊糖途径在高渗条件下有13个基因8种酶转录水平上调,分别是:
葡萄糖激酶(CAGL0K11297g),葡萄糖-6磷酸异构酶 (CAGL0H05445g),磷酸葡糖酸内酯酶(CAGL0I02200g),核酮糖磷酸-3-异 构 酶(CAGL0L05478g),6-磷酸果糖激酶(CAGL0F08041g和 CAGL0L10758g), 5-磷酸核糖异构酶 (CAGL0L03740g),核糖激酶(CAGL0L08228g),磷酸核糖焦磷酸激酶(CAGL0C05181g、CAGL0D00550g、CAGL0I05500g、CAGL0K02541g)和葡萄糖磷酸变位酶(CAGL0M02981g)。其中核糖激酶上调幅度较大。
另外,有5个基因4个酶发生下调,分别是:6-磷酸葡萄糖脱氢酶 (CAGL0J07612g),1,6-二磷酸果糖酶(CAGL0H04939g),转醛醇酶(CAGL0B03069g、CAGL0K04235g)和葡萄糖磷酸变位酶(CAGL0K07480g)。
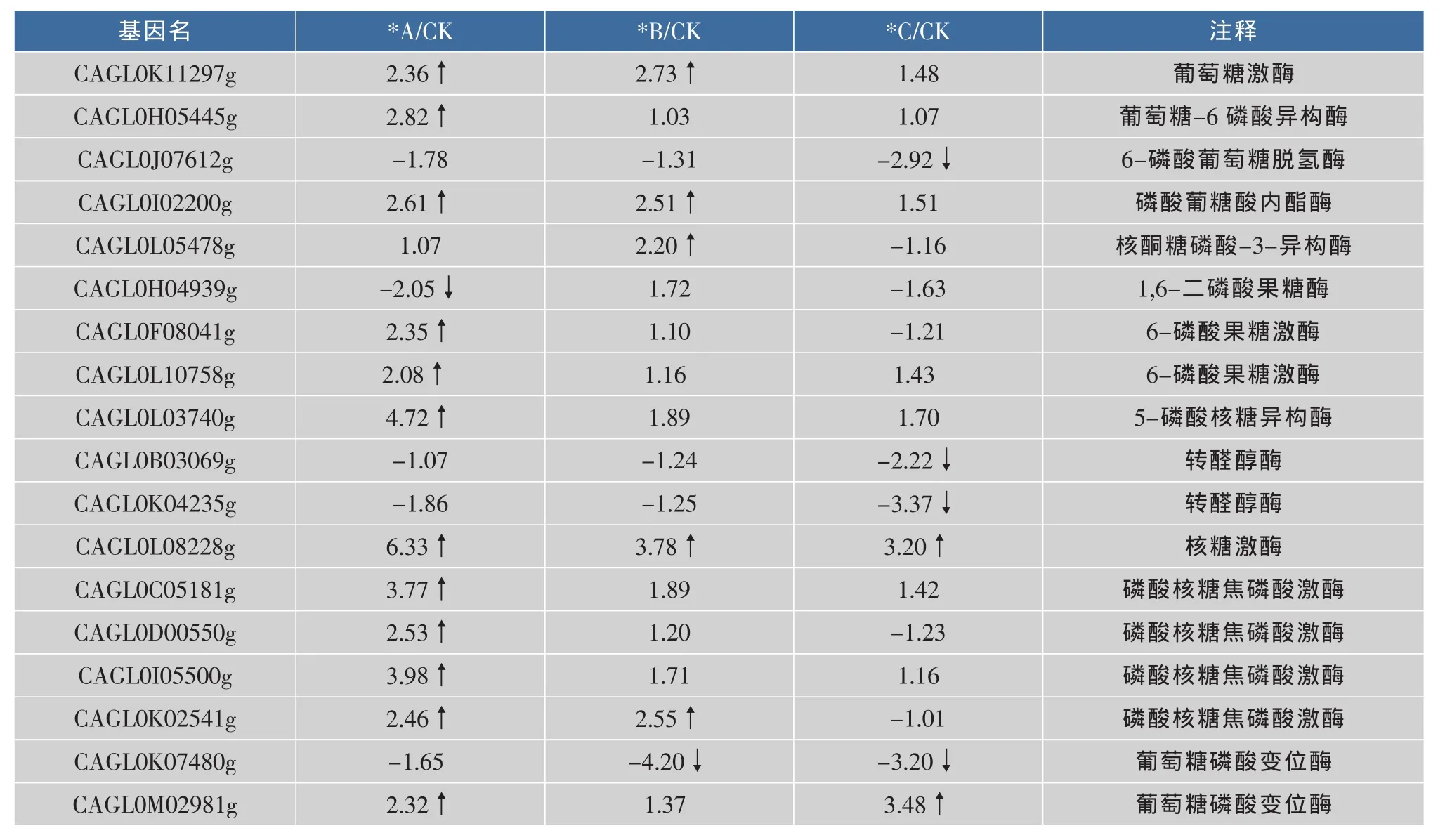
表3 磷酸戊糖途径差异表达基因Table 3 Differential expression genes in pentose phosphate pathway
在磷酸戊糖途径的氧化脱羧阶段,6-磷酸葡萄糖脱氢酶的活性最低,是整个途径的限速酶。该酶的基因表达在高渗条件下没有明显变化,在极端高渗条件下转录水平甚至受到了抑制。而其他一些基因转录水平的提高,可能与合成特定相容性溶质需要某些中间产物有关。
2.6 氧化磷酸化途径的基因表达谱
氧化磷酸化途径是将营养物质最终氧化分解,生成CO2和水并释放出能量的过程,称为生物氧化,是好氧条件下细胞能量的主要来源。如表4所示,氧化磷酸化途径转录水平整体呈现上调,有26个基因在高渗条件下转录水平提高。其中,H+转运ATP酶的转录水平增加10倍以上,变化极为显著。此外,值得注意的是,多数差异表达的蛋白质,较低渗透压条件(1 765 mOs mol/kg)相比极端高渗条件(3 324 mOs mol/kg)转录上调幅度更大;而转录水平下调的8个基因NADH脱氢酶(NADH dehydrogenase)、 琥珀酸脱氢酶铁硫蛋白质(succinate dehydrogenase iron-sulfur protein)、琥珀酸脱氢酶黄素蛋白质亚基 (succinate dehydrogenase flavoprotein subunit)、辅酶Q-细胞色素 C还原酶细 胞 色 素 C1 (ubiquinol-cytochrome c reductase cytochrome c1 subunit)、 V-型 H+-ATP 酶亚基 I(V-type H+-transporting ATPase subunit I)、 F-型 H+-ATP 酶亚基 Δ (F-type H+-ATPase subunit delta)、F-型H+-ATP酶寡霉素敏感相关蛋白质 (F-type H+-ATPase oligomycin sensitivity conferral protein)和F-型H+-ATP酶亚基h(F-type H+-ATPase subunit h),在极端高渗条件下,转录水平下降幅度更大。可能的原因是,极端高渗条件使某些RNA转录酶的活性受到抑制,从而影响了部分基因的转录。总之,上述结果表明,高渗胁迫总体上促进了氧化磷酸化途径基因转录水平的提高,但部分基因在极端高渗条件下,转录水平反而呈现下降。

表4 氧化磷酸化途径的差异表达基因Table 4 Differential expression genes of oxidative phosphorylation
2.7 信号转导途径基因表达谱
HOG-MAPK途径(图3)是绝大多数酵母抵御高渗胁迫的主要信号转导机制。
转录组分析结果表明,HOG-MAPK途径中的关键基因Sho1p、Ste20p、Ste11p和Hog1p转录水平略有上调,但幅度不是很大;Sln1p、Ssk1p、Pbs2p和Glo1p转录水平有所下调,其中Pbs2p在极端高渗条件下(3 324 mOs mol/kg)受到比较明显的抑制,转录水平下降至正常条件下(860 mOs mol/kg)的12.6%。
总体来说,相对于酿酒酵母和其他大部分酵母而言,高渗胁迫对T.glabrata的HOG-MAPK信号转导途径影响不大,即高渗没有明显诱导T.glabrata信号转导途径的基因转录。这与研究室前期在研究T.glabrata发酵过程较少检测到甘油生成的结果是一致的。这也表明,T.glabrata可能存在其他应对高渗胁迫的机制。

图3 HOG-MAPK信号通路Fig.3 HOG-MAPK signaling pathway.Dark gray:upregulated;Light gray:downregulated
2.8 氨基酸合成与代谢途径的基因表达谱
作者分析了谷氨酸、脯氨酸和精氨酸的合成与分解代谢途径中相关基因的表达。除精氨酸外,谷氨酸和脯氨酸都被证实可以在特定的微生物中积累,作为相容性溶质,抵御环境胁迫的影响。分析结果如表5所示。处于精氨酸分解途径中尿素羧化酶(CAGL0M05533g)转录水平明显下调,下降了99%以上,表明在高渗胁迫的条件下精氨酸分解能力下降。由于精氨酸的代谢与含氮有机化合物的代谢有关,在后续的研究中可以考虑表达精氨酸合成途径中的关键酶,而不是敲除精氨酸分解途径中的酶来提高精氨酸在胞内的积累。
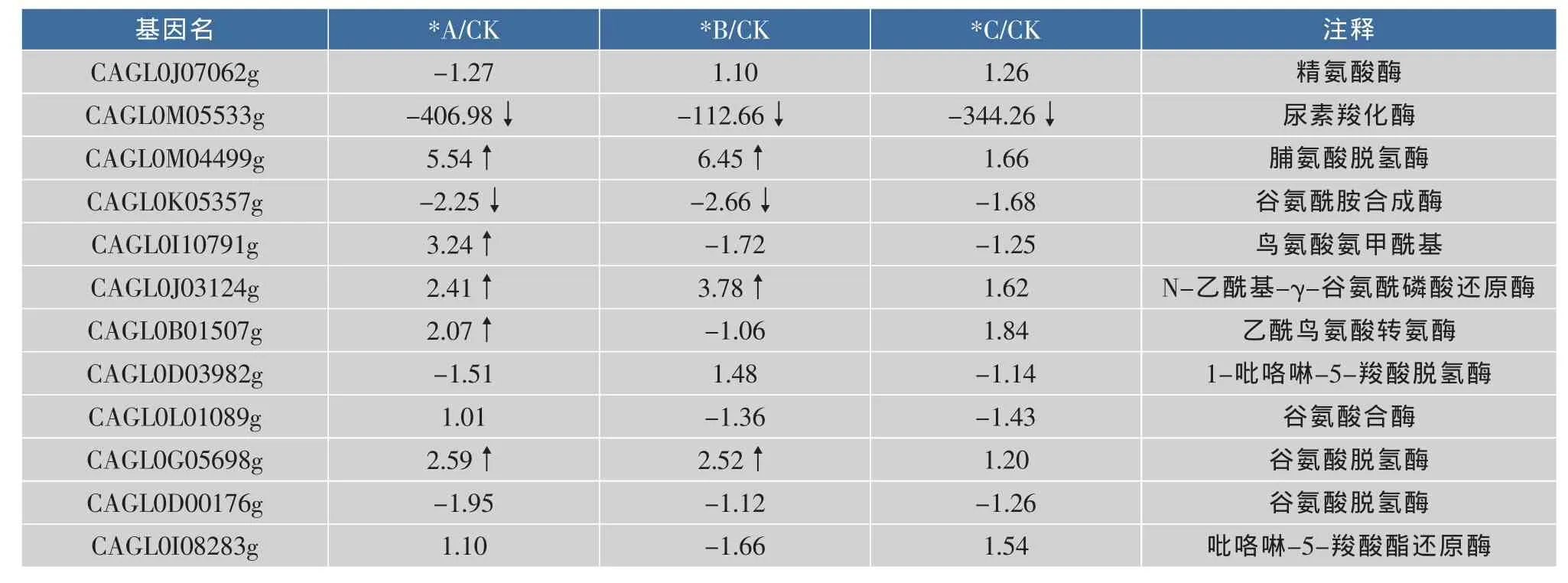
表5 氨基酸合成与代谢途径的基因表达Table 5 Changes in genes expression of amino acids metabolic pathway
另外,脯氨酸和谷氨酸合成途径中的酶转录水平都有一定程度的提高,但是幅度不大。因此在后续的实验中可以考虑过量表达这些合成酶,或者通过在胞外补加脯氨酸或谷氨酸来促进胞内这两种氨基酸的积累,达到提高细胞抗胁迫能力的目的。
3 讨论
中心代谢途径是最重要的葡萄糖代谢途径,也是重要的产能途径,有部分酶的基因在高渗条件下差异表达。在糖酵解途径中,6-磷酸葡萄糖变构酶(CAGL0K03289g)在渗透压为 2 603 mOs mol/kg 的条件下,转录水平发生上调。该酶催化α-6-磷酸葡萄糖到β-6-磷酸葡萄糖的反应,可能会在一定程度上影响糖酵解途径的碳通量。总体而言,发酵液渗透压的提高诱导糖酵解途径的转录发生上调,特别是丙酮酸激酶(CAGL0E05610g)在渗透压为1 765 mOs mol/kg和2 603 mOs mol/kg两个条件下,转录水平分别上调2.91倍和2.61倍。已有研究表明,与能量相关的基因表达会随着高渗胁迫时间的延长而提高,特别是呼吸和能量代谢相关的基因。在酿酒酵母中,盐胁迫30 min后,被诱导表达的ORFs(open reading frames,开放阅读框)中有 9.1%是电子传递链的组分,例如细胞色素和ATP合成酶复合体等[7]。本研究中发现,在高渗条件下与能量相关代谢途径(如三羧酸循环、氧化磷酸化途径等)的基因多数表达水平提高,尤其是那些参与产生ATP或形成NADH的基因。在有氧条件下,胞内NADH通过氧化磷酸化途径合成ATP。在氧化磷酸化过程中有5个酶复合体,其成分非常复杂。总体而言,复合体III、IV、V的转录水平都有明显上调,而复合体I和II可能略有下调。氨基酸是一类重要的相容性溶质,糖酵解途径和三羧酸循环为其合成提供重要的前体物质。谷氨酸合成酶(CAGL0L01089g)催化α-酮戊二酸合成谷氨酸,但研究发现该酶的转录水平并没有发生明显上调。而催化谷氨酸代谢形成脯氨酸或精氨酸的吡咯啉-5-羧酸脱氢酶(CAGL0D03982g)和N-乙酰谷氨酸转移酶(CAGL0F06501g)转录水平都发生了明显的上调。该结果说明T.glabrata可能与某些植物细胞类似,具有积累精氨酸或脯氨酸抵御渗透压胁迫的生理机制。
4 结语
综上所述,中心代谢途径、能量代谢途径和氨基酸代谢途径对T.glabrata抵御渗透压胁迫具有重要影响。作者在后面的研究中将对上述3个途径进行调控和改造,如通过增强T.glabrata产生ATP,在T.glabrata胞内过量积累精氨酸、脯氨酸等手段,达到提高T.glabrata抵御渗透压胁迫能力的目的。
[1]Yonekura-Sakakibara K,Fukushima A,Saito K.Transcriptome data modeling for targeted plant metabolic engineering[J].Curr Opin Biotechnol,2013,24(2):285-290.
[2]Rossouw D,van den Dool A H,Jacobson D,et al.Comparative transcriptomic and proteomic profiling of industrial wine yeast strains[J].Appl Environ Microbiol,2010,76(12):3911-3923.
[3]Sun N,Pan C,Mann M,et al.Quantitative proteome and transcriptome analysis of the archaeon Thermoplasma acidophilum cultured under aerobic and anaerobic conditions[J].J Proteome Res,2010,9(9):4839-4850.
[4]Xu S,Zhou J W,Liu L M,et al.Proline enhances Torulopsis glabrata growth during hyperosmotic stress[J].Biotechnol Bioproc E,2010,15(2):285-292.
[5]Liu L M,Xu Q L,Li Y,et al.Enhancement of pyruvate production by osmotic-tolerant mutant of Torulopsis glabrata[J].Biotechnol Bioeng,2007,97(4):825-832.
[6]Rep M,Krantz M,Thevelein J M,et al.The transcriptional response of Saccharomyces cerevisiae to osmotic shock-Hot1p and Msn2p/Msn4p are required for the induction of subsets of high osmolarity glycerol pathway-dependent genes[J].J Biol Chem,2000,275(12):8290-8300.
[7]Yale J,Bohnert H J.Transcript expression in Saccharomyces cerevisiae at high salinity[J].J Biol Chem,2001,276(19):15996-16007.
[8]Han Y P,Zhou D S,Pang X,et al.Comparative transcriptome analysis of Yersinia pestis in response to hyperosmotic and highsalinity stress[J].Res Microbiol,2005,156(3):403-415.
[9]Xu S,Zhou J W,Liu L M,et al.Arginine:A novel compatible solute to protect Candida glabrata against hyperosmotic stress[J].Process Biochem,2011,46(6):1230-1235.
