石墨烯固相萃取-液相色谱-质谱联用法测定食品接触材料中9种双酚-二环氧甘油醚的迁移量
2014-12-25肖家勇吴新华朱绍华焦艳娜付善良王利兵
龚 强, 丁 利, 肖家勇, 吴新华, 成 婧,朱绍华, 焦艳娜, 付善良, 王利兵*
(1.湖南出入境检验检疫局 检验检疫技术中心,食品安全科学技术湖南省重点实验室,湖南 长沙 410004;2.中南林业科技大学食品科学与工程学院,湖南 长沙410004)
双酚-二环氧甘油醚类物质作为合成环氧树脂原料且具有清除氯酸作用,常用作为婴儿奶瓶、食品罐头等多种食品接触材料的内涂层[1-2]。这类容器在使用过程中,双酚类物质残留会向食品中迁移,与食品接触后形成水合物、氯代物等衍生物而造成污染[3-5]。环境毒理学将这类物质称为环境激素,又称“外因性内分泌干扰物”。有研究报道,微量甚至痕量的双酚A及其环氧化合物,即可能对动物生理状况、生殖系统以及胎儿发育造成不良影响[6-8]。鉴于其对健康的危害,检测接触食品中其迁移含量,为预防其危害有着重要意义。目前,对于食品接触材料中有毒有害物质的迁移量测定一般采用食品模拟物,但对于实际样品来说,样品基质复杂,前处理更复杂,有毒有害物质的痕量迁移量的测定具有一定挑战性。
石墨烯作为一种新型的碳纳米材料,因为其独特而又严密的二维结构,近来被广泛关注。石墨烯具有比碳纳米管更大的比表面积,而且石墨烯的制备更为简单,且不受金属离子的污染。近年来,石墨烯作为比碳纳米管更优异的吸附剂而广泛用于SPE等分离领域,Liu等人以石墨烯负载硅胶固相萃取环境样品中氯酚,同时进一步利用石墨烯包覆磁性材料富集生物大分子以及环境样品中多溴联苯醚[9-12];Dong等人采用石墨烯基质分散萃取了生物样品中的小分子[13]。
作者在课题组前期工作的基础上,采用石墨烯填充固相萃取柱,高效液相色谱-串联质谱测定,以实际样品为基质,测定不同生产日期的同类基质以及不同基质中的双酚-二环氧甘油醚的迁移量,方法简单、灵敏、快速。
1 材料与方法
1.1 仪器、试剂与材料
API 4000 Q TRAP质谱仪,美国应用生物系统公司制造;多功能微量化样品处理仪,长沙中讯电子工程研究所制造;固相萃取仪,美国Supelco公司制造;高速离心机,德国Sigma公司制造;KQ-250E超声波振荡器,美国进口。
甲醇、叔丁基甲醚、乙酸乙酯、乙腈,均为色谱纯,德国Merck公司产品;乙酸、乙酸铵,为分析纯,北京化工厂产品;水为超纯水,以美国Millipore超纯水仪制备。
石墨烯(直径 0.5~2 μm,厚度~0.8 nm),南京先锋纳米公司产品;双酚-二环氧甘油醚标准品:双酚A 二缩水甘油醚(BADGE),双酚 A(2,3-二羟基丙基)缩水甘油醚(BADGE·H2O),双酚 A(3-氯-2-羟丙基)缩水甘油醚(BADGE·HCl),双酚 A-双(2,3-二羟丙基)醚(BADGE·2H2O),双酚 A 二(3-氯-2-羟丙基)醚(BADGE·2HCl),双酚 A(3-氯-2-羟丙基)(2,3-二羟基丙基)醚(BADGE·H2O·HCl),双酚F 二缩水甘油醚(BFDGE),双酚 F-双(2,3-二羟丙基)醚(BFDGE·2H2O),双酚 F 双(3-氯-2-羟丙基)醚(BFDGE·2HCl),纯度均≥95%,Sigma-Aldrich 公司产品;八宝粥、鱼肉、橘片罐头和牛肉等罐头食品,购于长沙超市。
1.2 标准溶液的配制
准确称取9种双酚-环氧甘油醚标准品各10.0 mg,用甲醇溶解,配成1.0 mg/mL的标准储备溶液。分别取标准储备液,用甲醇定容配成100 μg/mL的中间标准溶液。上述溶液均4℃冷藏避光储存。取适量储备液,用甲醇稀释配成溶度为1.0 μg/mL的标准工作液。
1.3 石墨烯固相萃取小柱的制备
采用商品化空的3 mL的固相萃取小柱,用垫圈封住小柱底部,称取20 mg石墨烯置于固相萃取柱中,用垫圈封住小柱顶部并压紧,使其高度约为0.3 cm。使用前依次用6 mL甲醇、6 mL水活化。
1.4 样品前处理
1.4.1 提取 称取5.0 g样品于50 mL的离心管中,加入15 mL叔丁基甲醚,振荡混匀2 min,超声提取15 min后,以7 000 r/min离心5 min,分离上清液。下层残渣再用15 mL叔丁基甲醚采用上述步骤重复提取一次,合并两次提取液。将提取液氮气吹至近干,用 6 mL 甲醇-水(体积比 50∶50)溶解,肉制品样品采用正己烷去脂:加3 mL正己烷,振荡混匀后弃正己烷层,净化。
1.4.2 净化 将提取液加到已活化石墨烯固相萃取小柱上,控制体积流量为1 mL/min,让溶液流尽,5 mL水淋洗,弃淋洗液。用9 mL乙酸乙酯洗脱,收集全部洗脱液,氮气吹至近干,用体积比1∶1甲醇-水定容至1 mL,过0.45 μm滤膜,上机分析。
1.5 色谱条件和质谱条件
1.5.1 色谱条件 流动相为甲醇 (A)和5 mmol/L醋酸铵溶液(内含质量分数0.1%乙酸)(B),体积流量为0.25 mL/min;梯度(体积分数)洗脱程序为:初始时 40%B;0~10 min,45%~5%B;10~10.01 min,5%~40%B;10.01~15 min,40%B。 色谱柱为 COSMOSIL柱(150mm×2.0mm;2.5μm),柱温30℃,进样量10μL。
1.5.2 质谱条件 离子源:质谱离子源为电喷雾离子源(ESI);扫描方式:正离子扫描;雾化气(Gas1):60.00 psi;辅助气(Gas2):65.00 psi;离子喷雾电压(IS):5 500.00 V;气帘气(Cur):20.00 psi;离子化温度(TEM):500℃;检测方式:多反应监测扫描模式(MRM)。多反应监测条件下9种双酚-二环氧甘油醚定性离子对、定量离子对、碰撞气能量和去簇电压见表1。
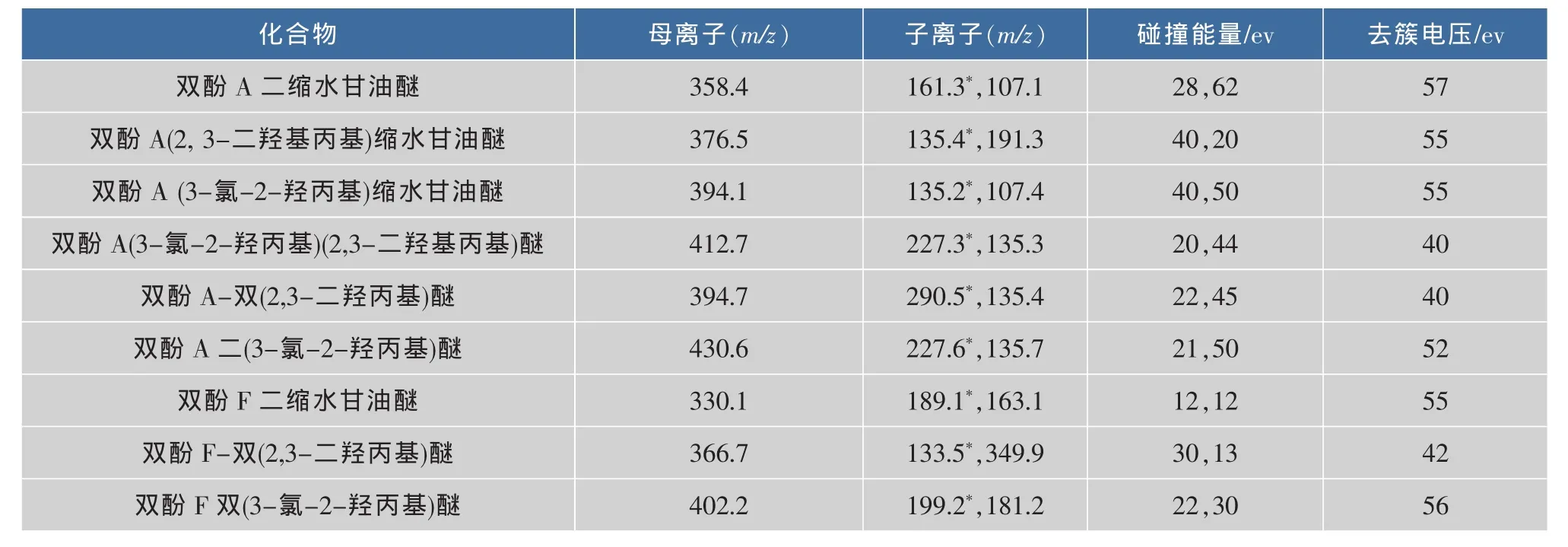
表1 多反应检测扫描模式检测9种双酚-二环氧甘油醚的部分质谱参数Table 1 Some parameters of multiple reaction monitoring detection for 9 bisphenol diglycidyl ethers
2 结果与讨论
2.1 质谱条件的优化
采用注射泵连续进样,将9种双酚-二环氧甘油醚标准溶液(质量浓度100 ng/mL)分别注入离子源中,正离子模式下进行母离子全扫描,选择适当的分子离子峰。结果表明,电喷雾正离子电离模式下,9种物质全扫描的分子离子[M+NH4]+最理想。分别对9种甘油醚的母离子进行二次碎裂,得到碎片离子峰的信息,确定每个目标化合物的特征离子对后,在多反应监测 (MRM)模式下优化去簇电压(DP)、碰撞能量(CE)。 联机液相色谱仪,参照本课题组吴新华[13]液相条件,流动注射分析优化碰撞气(CAD)、雾化气(Gas1)、辅助气(Gas2)、喷雾电压(IS)、气帘气(CUR)、离子化温度(TEM)等质谱参数。优化好9种双酚-二环氧甘油醚的MRM色谱图,见图1。
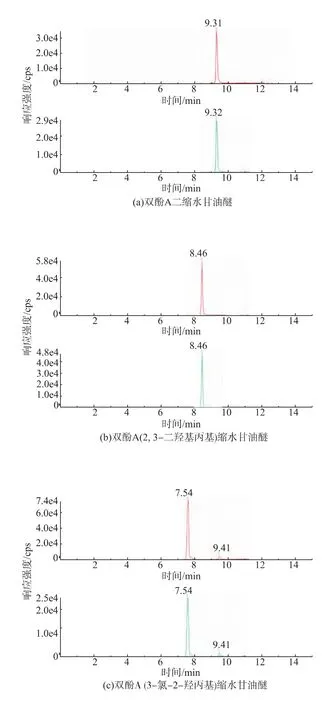


图1 9种双酚-二环氧甘油醚的多反应监测(MRM)色谱图(100 ng/mL)Fig.1 Chromatograms of 9 bisphenol diglycidyl ethers in MRM mode(100 ng/mL)
2.2 石墨烯用量的选择
石墨烯表面积非常大 (理论值为2630 m2/g)[9],有着很强的吸附能力,因此适当选择固相萃取中石墨烯的用量对实验极为关键。Liu等采用20 mg石墨烯作为固相萃取填料,对氯酚类物质进行分析,获得了较好的回收率[12]。本文作者选择了5、10、20、40、60、80 mg石墨烯,对空白样品进行加标回收分析,9种甘油醚的加标量均为10.0 μg/kg。石墨烯用量低于20 mg时,9种环氧甘油醚的回收率随着石墨烯的增加而增大;用量在20~40 mg之间时,回收率变化不大;当用量大于40 mg时,回收率随着石墨烯增加反而有所降低(见图2)。因此,本实验选择20 mg石墨烯作为固相萃取填料用量。
2.3 提取溶剂的优化
参照本课题组吴新华文献[14],本实验分别比较了乙腈、甲醇、乙酸乙酯和叔丁基甲醚作为提取溶剂对9种环氧甘油醚提取效率的影响 (见图3)。9种甘油醚的加标量均为10 μg/kg,实验结果表明:不同的提取溶剂对9种甘油醚的回收率差异较大。其中甲醇、乙腈提取回收率较低,9种甘油醚的回收率在34.6%~70.7%之间。叔丁基甲醚对9种甘油醚的回收率在63.7%~101.9%,综合分析较其他3种试剂提取回收率好。因此,本实验选择叔丁基甲醚作为提取溶剂。
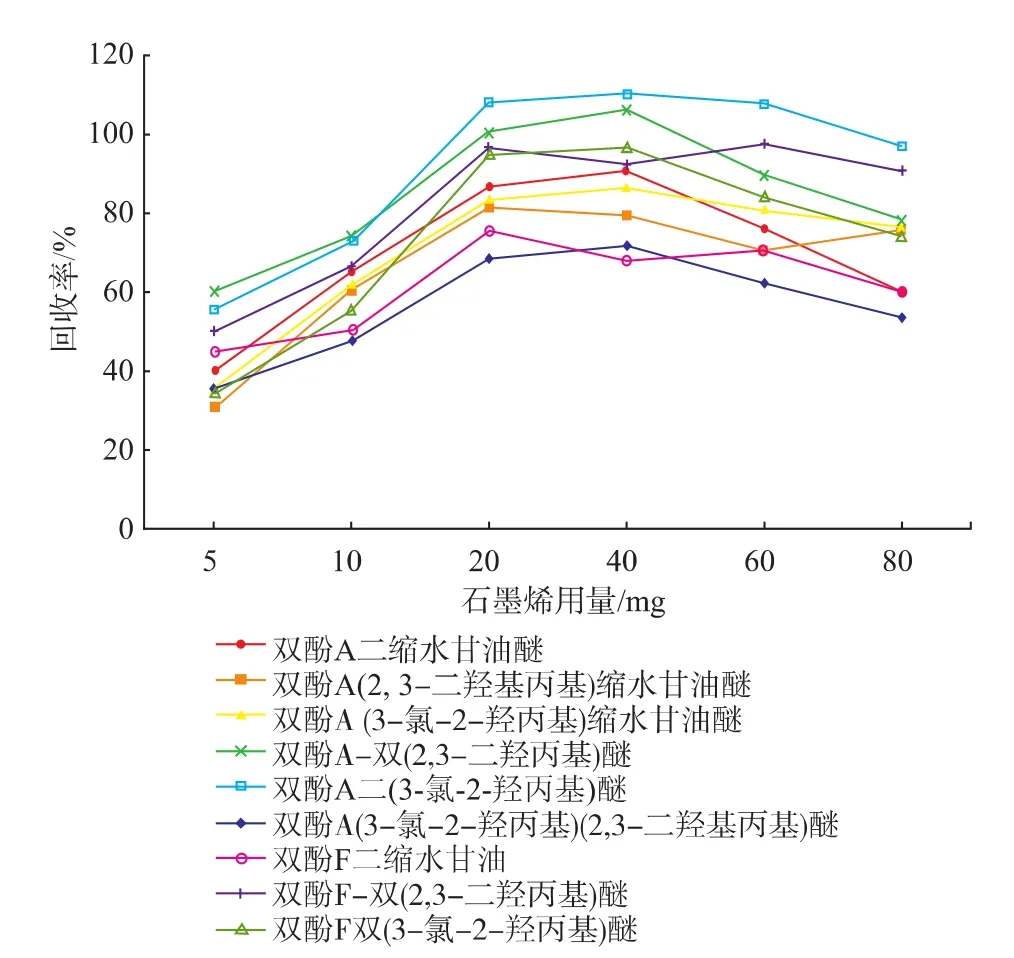
图2 石墨烯用量对9种环氧甘油醚回收率的影响Fig.2 Effect of graphene on the recoveries of 9 bisphenol diglycidyl ethers
2.4 洗脱溶剂的选择
经石墨烯吸附后,洗脱效率是回收率的保证。实验过程中分别比较了乙腈、碱性甲醇(含体积分数5%氨水)、叔丁基甲醚和乙酸乙酯作为洗脱溶剂对9种环氧甘油醚洗脱效率的影响(见图4)。9种双酚-二环氧甘油醚的加标量均为10.0 μg/kg,实验结果表明:不同的洗脱溶剂对9种甘油醚的回收率差异较大。其中乙腈的洗脱回收率较低,9种甘油醚的回收率在40.1%~71.9%之间。碱性甲醇对BADGE的回收率为58.2%;对BFDGE的回收率为50.4%;对其他几种甘油醚的回收率在77.3%~86.5%之间。叔丁基甲醚对BADGE、BFDGE及BFDGE·2HCl的回收率较低,分别为52.6%、52.7%和65.4%。乙酸乙酯对9种甘油醚的回收率在65.7%~107.9%之间,洗脱回收率高于其他3种溶剂。因此,本实验选择乙酸乙酯作为洗脱溶剂。
2.5 方法的线性范围与检测限

图3 不同溶剂提取罐头食品中双酚-二环氧甘油醚的回收率Fig.3 Recoveries of bisphenol diglycidyl ethers in the canned foodstuffs by different extraction solvent

图4 不同溶剂洗脱罐头食品中双酚-二环氧甘油醚的回收率Fig.4 Recoveries of bisphenol diglycidyl ethers in the canned foodstuffs by different elution solvent
在上述优化的实验条件下,用空白基质溶液配制一系列双酚-二环氧甘油醚质量浓度分别为0.5、1.0、2.0、5.0、10.0、20.0、50.0、100.0 ng/mL 的混合标准工作溶液,进行添加实验分析。结果表明9种环氧甘油醚的质量浓度x(ng/mL)和峰面积y之间均有良好的线性关系,相关系数在0.992 2~0.999 6之间(见表 2);其中 BADGE·2H2O、BFDGE·2HCl的线性范围为 0.5~50.0 ng/mL;BADGE·2HCl和BFDGE·2H2O的线性范围为5.0~100.0 ng/mL;其他5种的线性范围为2.0~100.0 ng/mL。 分析物最低检测限(LOQ)根据其响应值大于或等于基线响应值的3倍(S/N≥3)且准确度和精密度RSD<20%来确定。采用实际样品添加法进行分析,确定方法的最低定量检测限,见表2。
2.6 方法的回收率与精密度
采用5 g不同罐头基质,分别按低(线性低限)、中、高3个浓度进行9种环氧甘油醚标准混合溶液的添加回收分析。每个加标浓度水平平行测定6份样品,计算平均回收率及相对标准偏差,见表3。9种环氧甘油醚在橘片罐头样品中的平均添加回收率为65.4%~111.3%,肉类罐头中的平均添加回收率为60.0%~97.6%。相对标准偏差均小于20%,方法重复性较好。
2.7 实际样品的测定
用本法对不同种类及不同生产日期的同类罐头作实样测定,对阳性样品多重测定,结果表明灵敏度高、重复性好。图5为实样MRM色谱图。

表2 9种双酚-二环氧甘油醚的回归方程、线性范围、相关系数和检测限Table 2 Regression equations,linear ranges,correlation coefficients and LODs of 9 bisphenol diglycidyl ethers

表3 不同罐头样品中9种环氧甘油醚添加平均回收率和相对标准偏差(n=6)Table 3 Recoveries and relative standard detiation(RSDs) of 9 bisphenol diglycidyl ethers in can food(n=6)
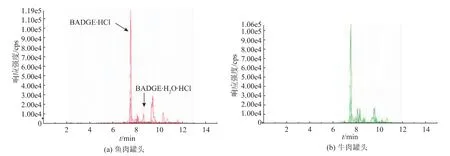
图5 实际样品MRM色谱图Fig.5 MRM chromatograms of real samples
鱼罐头样品检出 220.0 μg/kg的 BADGE·HCl和 139.0 μg/kg 的 BADGE·H2O·HCl; 牛肉罐头样品检 出 222.0 μg/kg 的 BADGE·HCl,47.2 μg/kg 的BADGE·H2O和49.2μg/kg 的 BADGE·H2O·HCl。
3 结语
通过优化改进样品前处理条件,以实际样品为检测对象,建立了罐头食品接触材料中9种双酚-二环氧甘油醚迁移量的石墨烯固相萃取净化HPLC-MS/MS检测方法。该方法操作简单,灵敏度高,使用石墨烯作为固相萃取柱回收率高、重复性好,为食品接触材料中内分泌干扰物的迁移动力学研究提供了检测技术基础,对食品安全有着重要的意义。
[1]Satoh K,Ohyama K,Aoki N,et al.Study on anti-androgenic effects of bisphenol a diglycidyl ether (BADGE),bisphenol F diglycidyl ether (BFDGE) and their derivatives using cells stably transfected with human androgen receptor,AR-EcoScreen[J].Food Chem Toxicol,2004,42(6):983-993.
[2]Leepipatpiboon N,Sae-Khow O,Jayanta S.Simultaneous determination of bisphenol-A-diglycidyl ether,bisphenol-F-diglycidyl ether,and their derivatives in oil-in-water and aqueous-based canned foods by high-performance liquid chromatography with fluorescence detection[J].J Chromatogr A,2005,1073(1-2):331-339.
[3]Soeborg T,Hansen S H,Halling-Sorensen B.Determination of bisphenol diglycidyl ethers in topical dosage forms[J].J Pharm Biomed Anal,2006,40(2):322-330.
[4]Cabado A G,Aldea S,Porro C,et al.Migration of BADGE(bisphenol A diglycidyl-ether) and BFDGE (bisphenol F diglycidylether) in canned seafood[J].Food Chem Toxicol,2008,46(5):1674-1680.
[5]Gallart-Ayala H,Moyano E,Galceran M T.Fast liquid chromatography-tandem mass spectrometry for the analysis of bisphenol A-diglycidyl ether,bisphenol F-diglycidyl ether and their derivatives in canned food and beverages[J].J Chromatogr A,2011,1218(12):1603-1610.
[6]Pérez-Palacios D,Fernández-Recio M A,Moreta C,et al.Determination of bisphenol-type endocrine disrupting compounds in food-contactrecycled-papermaterialsby focused ultrasonic solid-liquid extraction and ultra performance liquid chromatography-high resolution mass spectrometry[J].Talanta,2012,99:167-174.
[7]Yang Y J,Lee S Y,Kim K Y,et al.Acute testis toxicity of bisphenol A diglycidyl ether in Sprague-Dawley rats[J].J Prev Med Public Health,2010,43(2):131-137.
[8]Hyoung U J,Yang Y J,Kwon S K,et al.Developmental toxicity by exposure to bisphenol A diglycidyl ether during gestation and lactation period in Sprague-Dawley male rats[J].J Prev Med Public Health,2007,40(2):155-161.
[9]Liu Q,Shi J,Sun J,et al.Graphene and graphene oxide sheets supported on silica as versatile and high-performance adsorbents for solid-phase extraction[J].Angew Chem Int Ed Engl,2011,50(26):5913-5917.
[10]Liu Q,Shi J,Sun J,et al.Graphene-assisted matrix solid-phase dispersion for extraction of polybrominated diphenyl ethers and their methoxylated and hydroxylated analogs from environmental samples[J].Anal Chim Acta,2011,708(1-2):61-68.
[11]Liu Q,Shi J,Zeng L,et al.Evaluation of graphene as an advantageous adsorbent for solid-phase extraction with chlorophenols as model analytes[J].J Chromatogr A,2011,1218(2):197-204.
[12]LIU Qian,SHI Jianbo,CHENG Mengting,et al.Preparation of graphene-encapsulated magnetic microspheres for protein/peptide enrichment and MALDI-TOF MS analysis[J].Chem Commun,2012,48,1874-1876.
[13]Dong X,Cheng J,Li J,et al.Graphene as a novel matrix for the analysis of small molecules by MALDI-TOF MS[J].Anal Chem,2010,82(14):6208-6214.
[14]Wu X,Ding L,Li Z,et al.Determination of the migration of bisphenol diglycidyl ethers from food contact materials by high performance chromatography-tandem mass spectrometry coupled with multi-walled carbon nanotubes solid phase extraction[J].Chromatogram,2010,28(11):1094-1098.
