新型锕系元素硼酸盐结构研究综述
2014-12-25赵岩岩第五娟王殳凹
高 阳,赵岩岩,2,第五娟,王殳凹,*
1.苏州大学 放射医学及交叉学科研究院,江苏 苏州 215123;2.陕西师范大学 化学化工学院,陕西 西安 710062
硼在地球上的丰度大致为10×10-6(质量分数,ppm)[1],并主要以硼酸盐的形式存在,大面积的含硼矿层主要由古老海洋挥发而形成。铀是最重的天然存在元素,其在地壳中丰度为2.7×10-6(质量分数,ppm)[2]。地表的很多过程和运动都可以造成铀的富集,铀与各种常见的含氧酸盐所形成的天然矿物也都被逐一发现[3-5]。由于地表不存在同时富集硼和铀的天然矿层,铀的硼酸盐矿物从未被报道。尽管如此,随着20世纪50年代以来核工业的快速发展特别是核废料的处置,锕系元素从铀到锔和硼酸盐被人为大量富集到一起。
首先,除了俄罗斯(主要采用铝硅酸玻璃),硼硅酸玻璃固化体是当今世界采用的最为广泛的核废料储放形式[6-7]。美国的核废料硼硅酸玻璃固化工艺起始于1996年,主要在南卡罗来纳州的萨瓦那河国家实验室(Savannah River Site)开展。据估计,这种处理方式至少还要被沿用20余年,主要用于含钚核武器退役所造成的废物处置[8]。20世纪末的研究发现,当硼硅酸玻璃固溶体中锕系元素含量较高时会造成玻璃表面的析晶现象,从而极大地降低玻璃体的完整性及耐腐蚀性,这些晶体极有可能是锕系元素的硼酸盐及硅酸盐化合物[7-8]。
其次,在美国新墨西哥州Carlsbad沙漠地带地下水中的含硼量非常高,在166×10-6(质量分数,ppm)左右[9],主要以H3BO3、B以及的形式存在。20世纪90年代初在当地建起了全美目前唯一的核废料地质处置库(waste isolation pilot plant,WIPP)。近期的配位化学及种态化学研究表明,WIPP地下水域中的硼酸根是锕系元素在水溶液中最主要的配位离子[10],因此在泄漏事故状态下,WIPP是一个能够生成锕系元素硼酸盐化合物的独特场址。核废料中核素的衰变会造成环境温度的升高,因此关于锕系元素与硼酸盐在中低温环境下的反应研究对于预测锕系元素在WIPP场址的迁移行为显得尤其重要。
最后,2011年福岛核电厂受到地震和飓风的摧残造成大量的放射性核素的泄漏和散布。大量的海水及硼酸(10B是良好的中子毒物)曾被注入到当地的反应堆中,最终还是未能阻止乏燃料棒的熔出。在这个特殊的过程中,锕系放射性核素被大量暴露在高浓度的硼酸溶液中,从而也营造出一个生成锕系元素硼酸盐化合物的天然环境。
尽管锕系元素硼酸盐在以上环境中作为锕系元素的主要的化学形态存在,并对其迁移行为影响重大,之前被完整表征过的锕系元素硼酸盐化合物非常少,甚至在不久之前还没有任何一个超铀元素的硼酸盐化合物被合成及表征过。首个被报道的锕系元素硼酸盐化合物可以追溯到20世纪80年代,Behm等[11]利用水溶液常温挥发的方法合成出K6[UO2B16O24(OH)8]·12H2O。该化合物拥有一复杂的由16元硼酸根环绕铀酰所形成的簇状分子结构。Gasperin等[12-18]在1986到1991年六年间利用高温B2O3熔融法共合成出7个锕系元素硼酸盐化合物,包括UO2(B2O4)、Li(UO2)BO3、Na(UO2)BO3、Ca(UO2)2(BO3)2、Mg(UO2)B2O5、Ni7(UO2)(B4O14)以及ThB2O5。之后的20年间都未有任何新的锕系硼酸盐化合物被报道,一个可能的原因是锕系元素的水解过程会影响硼酸盐化合物的结晶[19]。
近几年来,一系列新的锕系元素硼酸盐化合物由硼酸熔融反应制备得到,其中硼酸在反应中同时作为反应物及反应溶剂。这些化合物包括具有显著阴离子交换能力的首个纯无机阳离子框架化合物[ThB5O6(OH)6](H2BO3)·2.5H2O(NDTB-1)[20-21]、一系列六价铀酰硼酸盐化合物[22-26]、多个混合价态硼酸镎化合物[26-31]、多个六价钚及三价钚化合物[26,29-30,32-33]、一个硼酸镅[32-33]以及一个硼酸锔化合物[33-34]。限于篇幅,在此将有选择性地重点阐述部分化合物的复杂结构、特殊性质以及它们在改善核废料处置和核燃料循环工艺中的潜在应用价值。
1 硼酸钍
除了一些钍含量很高的天然矿物[35-39],之前已知的硼酸钍化合物只有通过高温熔融B2O3法制备出的ThB2O5[18]。1826年Berzelius认为其合成出了Th3(BO3)4,但是一直没有确凿的证据证明[40]。我们用硼酸熔融法合成出了硼酸钍化合物Th[B5O6(OH)6](H2BO3)·2.5H2O,并命名其为NDTB-1。
这个化合物最重要的一个特点是它具有带正电的阳离子多孔三维框架结构,并由存在于孔道及空腔中的H2BO-3阴离子来维持电荷平衡。这是首个阳离子框架材料,以往具有扩展结构的材料往往是基于阴离子框架结构,同时利用存在于空隙中的阳离子来平衡电荷。被研究最多的一个例外就是双金属层状氢氧化物(layered double hydroxides,LDH)[41-43]。其结构的独特之处在于,双金属氢氧化物的层状结构整体带正电,而夹在层间的游离阴离子可以被轻易替换。LDH是一类在环境应用中具有重要意义的物质,它可以从水体环境中除去大部分关键的阴离子污染物。唯一不足的是其在阴离子交换过程中难以保持结构的完整性,造成材料重复回收利用的困难。这一问题已经被最近合成出的NDTB-1、YbO(OH)6Cl·2H2O和一些其他的含有Ag(Ⅰ)或Cu(Ⅰ)阳离子的金属有机物框架化合物这类三维阳离子框架结构解决了[44-45]。
1.1 NDTB-1的结构特点
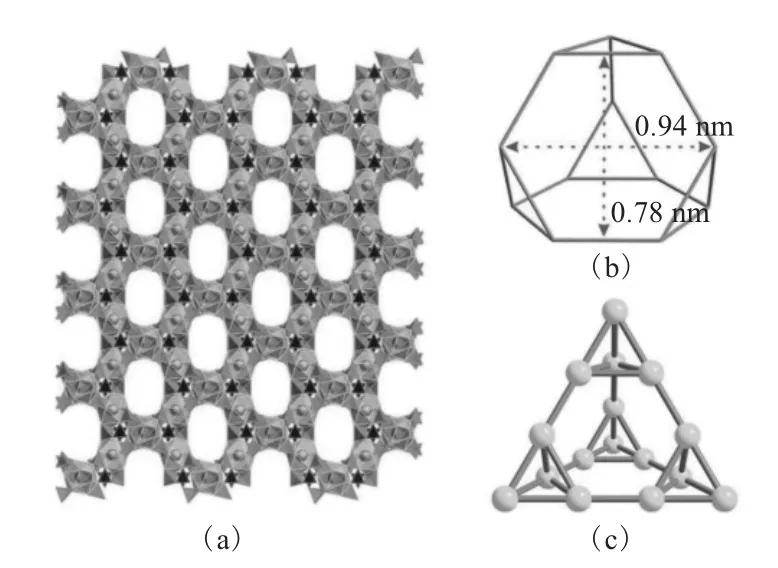
图1 沿110方向的NDTB-1的三维结构(a)、空腔拓扑结构(b)及基于钍原子的超四面体三维框架拓扑结构(黄色)(c)[20]Fig.1 A view along[110]of the 3Dstructure(a),cage topology in the structure of NDTB-1(b),and topology of supertetrahedral 3Dframework based on Th atoms(yellow)(c)[20]
钍离子和B10O24簇合离子并没有将超四面体结构中的空间完全填充,NDTB-1中有大量的空隙位置,其中包括一系列孔道和空腔。NDTB-1的孔道沿着立方晶系的110方向延伸(图1(a)),这些孔道在超四面体的中心交叉形成空腔。这些空腔的窗口是4个大小为0.94nm×0.78nm的六边形(图1(b))。在NDTB-1中空隙率高达43%,因此它是目前为止空隙率第二大的锕系元素多孔化合物[46-48]。
X射线单晶衍射及电荷平衡计算显示,这个超四面体框架整体带正电,而高度无序的质子化硼酸根阴离子群占据空隙位置来平衡电价,这一结论同时也被11B固体核磁共振图谱证实。在阳离子框架中,孔道贯穿整个结构,使得阴离子交换非常容易进行,而空腔又能困住那些电荷和尺寸合适的阴离子。
1.2 NDTB-1的阴离子交换研究
基于电感耦合等离子体质谱法(ICP-MS)、能量色散X线光谱学(EDS)和单晶及粉末衍射实验的结果,发现NDTB-1能够与各种常见的阴离子如Cl-、Br-、、、、、、发生单晶到单晶的阴离子交换作用。交换实验使用一系列高着色的阴离子如Mn、Cr、Cr2,在几分钟内即显示出了过渡金属的颜色(图2)。这些晶体被切割后,在内部显示了和表面相同的颜色[20]。值得一提的是,NDTB-1在整个阴离子交换的过程中,结构依旧保持完整,这为材料的循环利用奠定了基础。

图2 交换Mn、Cr、Cr2前后的NDTB-1晶 体 照 片[20]Fig.2 Photos of crystals of NDTB-1,exchanged NDTB-1,Crexchanged NDTB-1,Cr2exchanged NDTB-1[20]
1.3 经与交换后的NDTB-1材料的99Tc固体核磁共振谱研究
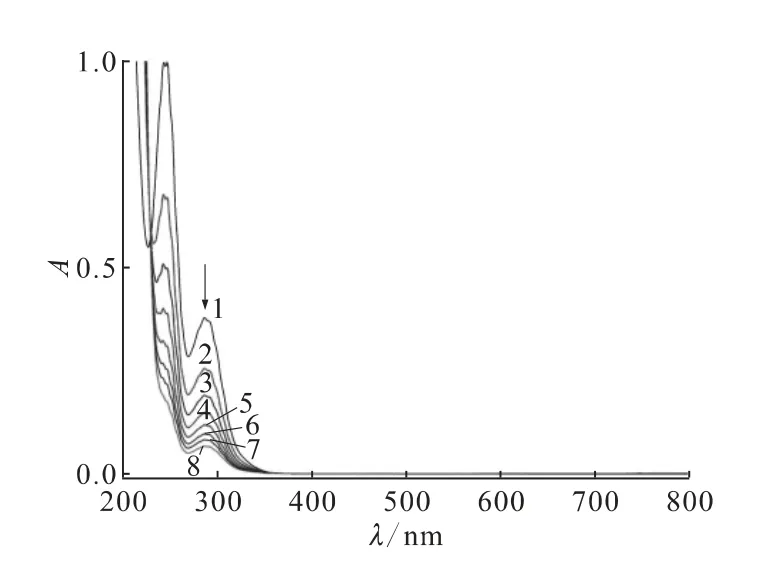
图3 与NDTB-1发生阴离子交换作用的溶液的紫外可见光谱图[20]Fig.3 UV-vis spectra ofsolution exchanged with NDTB-1shown in day width[20]
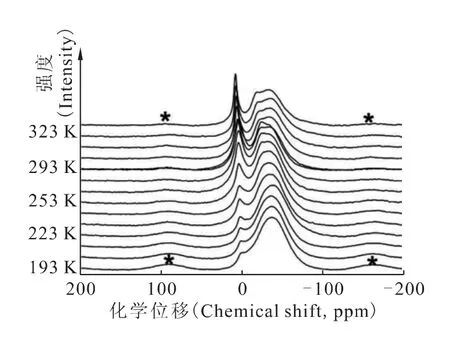
图4 经与交换后的NDTB-1材料的99 Tc固体变温核磁共振谱图[21]Fig.4 Variable-temperature(VT),solid-state MAS 99 Tc NMR spectra of NDTB-1 that had been ion-exchanged with solution to replace the extraframework[BO(OH)2]-anions[21]
2 硼酸铀
硼酸铀家族的晶体结构非常复杂多样[11-17,22-26]。这些化合物可以用多种方法合成,按不同合成方法可被细分为三组。第一组是一系列由高温熔融B2O3法制备得到的硼酸铀,主要由UO6四角双锥和(或)UO7五角双锥和BO3三角构成[12-18]。此类化合物全部结晶于中心对称的空间群。第二组仅由常温挥发制得的K6[UO2B16O24(OH)8]·12H2O为代表,此化合物具有由16元硼酸根环绕铀酰离子所构成的簇状分子结构。第三组是利用硼酸熔融法在相对低温(约180~280℃)的条件下制备获得[21-26]。在此仅讨论第三组中硼酸铀酰(Ⅵ)化合物的合成方法、拓扑结构和物理特性。
2.1 新的硼酸铀酰化合物
事实证明硼酸熔融法是一种制备锕系硼酸盐化合物非常安全高效的合成手段。特别是由硝酸铀酰与碱金属或者类碱金属(Ag+和Tl+)离子起始的硼酸熔融反应,通过改变反应温度、反应时间、起始物比例,已经生成了超过37个新型硼酸铀酰化合物[22-26]。在起始物中添加氟离子可以生成一系列新型的硼氟酸铀酰化合物。此外,利用具有更低熔点的甲基硼酸作为新的熔融体生成了首个锕系元素的有机硼酸盐UO2(CH3BO2)(H2O)[28]。
2.2 硼酸盐系列结构的拓扑学分类
迄今为止获得的所有的硼酸铀酰化合物均基于聚合硼酸铀酰片层。这些片层由BO4四面体和BO3三角缩合而形成。此典型硼酸铀酰结构选其中之一示于图5。图5(a)和(b)分别显示的是存在于Rb2[(UO2)2B13O20(OH)5]中的聚合硼酸根片层的框架模型和多面体模型。铀酰离子存在于聚合硼酸盐片层的内部。可利用在虚线圆圈内的BO3三角构成的超三角结构来区别片层的类型。在Rb2[(UO2)2B13O20(OH)5]和一些少量其他化合物中,超三角结构基于BO4四面体。在其他硼酸铀酰相的超三角中,其中的硼酸根基元可以被BO3三角代替,连接超三角形的BO3三角也可以被BO4四面体代替。所以,聚合硼酸根片层中BO3和BO4基元的比例是区分具有相似拓扑结构的锕系硼酸盐的重要指标之一。
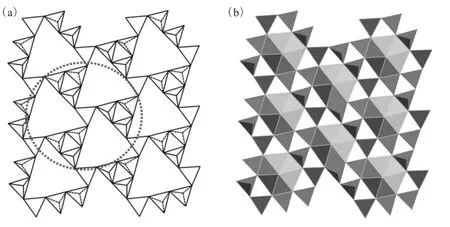
图5 Rb2[(UO2)2B13O20(OH)5]中聚合硼酸根片层的框架(a)和多面体(b)模型[24]Fig.5 Skeletal(a)and polyhedral(b)representations of the polyborate sheet found in the structure of Rb2[(UO2)2B13O20(OH)5][24]
片层内部的铀酰离子的配位环境也可以用来区分片层结构。在典型的结构中,每个铀酰离子被9个相邻的硼酸基元包围(图5(b))。不同的片层可以通过铀酰离子周围BO3三角和BO4四面体的数目差异及其不同的排列组合来获得。例如,在Rb2[(UO2)2B13O20(OH)5]中的聚合硼酸片层中,每个铀酰离子被6个BO4四面体和3个BO3三角构型环绕。基于这一点,到目前已得到11种锕系硼酸盐化合物(图6A—M种)的片层结构拓扑,通过旋光异构体的存在可以得到更多更复杂的化合物。
对于典型的硼酸铀酰来说,额外的硼酸根基元可存在于聚合硼酸铀酰片层之外并沿着垂直方向扩展,这些硼酸根基元可连接相邻的聚合硼酸根片层形成三维框架结构。在锕系硼酸盐中还存在不同硼酸基元的桥连方式,进而形成单层、双层和三维框架等各种特征结构。这一特点在所有已知的锕系配合物系统里独一无二。

图6 锕系硼酸盐体系中的11种聚合硼酸根片层结构拓扑[25]Fig.6 Polyhedral representations of all polyborate sheet types found to date in the actinide borate system[25]
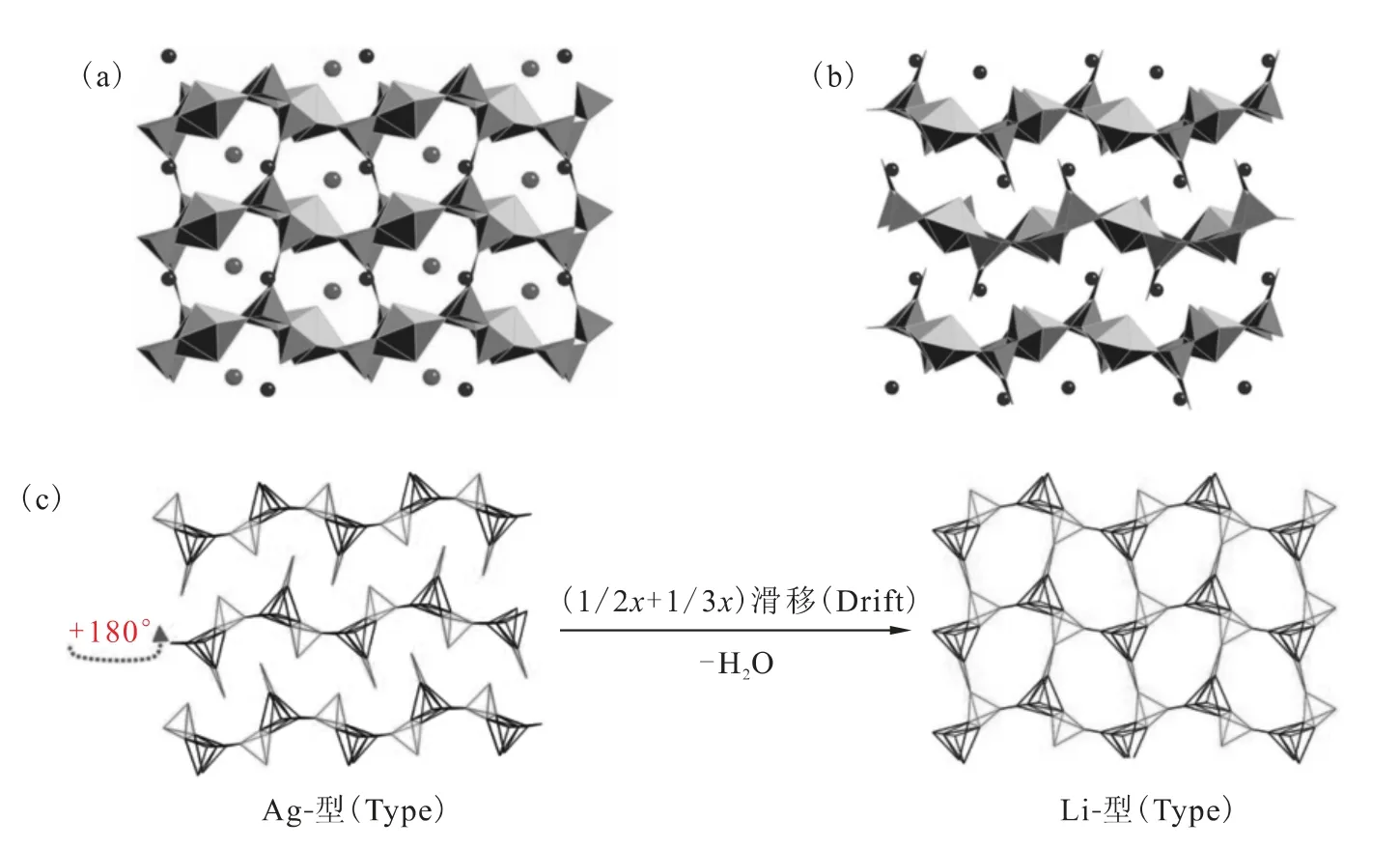
图7 Li[UO2B5O9]·H2O(a)、Ag[(UO2)B5O8(OH)2](b)的晶体结构及其结构的关系示意图(c)[25]Fig.7 Crystal structures of Li[UO2B5O9]·H2O(a)and Ag[(UO2)B5O8(OH)2](b),and schematic representation of their structure type relationships(c)[25]
这一系列化合物结构的复杂多样性可以由硼酸铀酰锂和硼酸铀酰银代表。硼酸铀酰锂和硼酸铀酰银化学式分别为Li[UO2B5O9]·H2O和Ag[(UO2)B5O8(OH)2][25]。尽管Li+和Ag+的离子半径差异很大,它们的硼酸铀酰盐的化学成分和结构方面的特性却相似相关。图7(a)和(b)分别表示硼酸铀酰锂和硼酸铀酰银的晶体结构示意图。两相均基于相同的G型硼酸铀酰片层拓扑结构(图6)。由于Li离子很小,所以在Li[UO2B5O9]·H2O的结构中对水分子来说有足够的空间存在,而在银盐中没有水分子存在。为了将银盐结构转换成锂盐结构,只需将第二层在片层平面旋转180°(红色虚线箭头所示),再将片层沿x轴滑移1/2、z轴滑移1/3即可。这一系列的操作之后,BO2OH三角(红色)将会占据与BO3OH四面体(红色)几乎等同的位置。
3 硼酸镎
作为首个超铀元素,237Np因其长半衰期(2.14×106a)而成为乏燃料处置库中的关键核素。镎可以具有从Ⅲ到Ⅶ的价态,在自然界可以存在的价态主要有Ⅳ、Ⅴ和Ⅵ[49]。在通常情况下,镎最稳定的氧化态是Np(Ⅴ)。在很多条件下,Np(Ⅴ)会歧化成为Np(Ⅵ)和Np(Ⅳ)[50]。镎的浓度、温度、辐解及水解因素都可以显著影响不同氧化态之间的相对稳定性[51-54]。之前已知的一系列镎的混合价态化合物包括Np(Ⅳ)/Np(Ⅴ)或Np(Ⅴ)/Np(Ⅵ)[55-59]。
硼酸根具有与各种价态锕系元素离子的配位能力。究其原因有以下两点:第一,硼酸根基元BO3三角和BO4四面体能够在各种条件下聚合形成各式各样更大的聚合硼酸根阴离子,他们可以提供各种配位模型来满足不同的金属中心配位环境的几何要求[60-64];第二,硼酸根在非极端条件下是没有氧化还原活性的配体,因此在锕系元素硼酸盐的合成过程中能够通过控制锕系元素的氧化态和起始物的还原电位来控制或至少预测产物中锕系元素的价态。在此将简单介绍一系列混合/中间价态以及单一价态的硼酸镎化合物。
3.1 混合/中间价态硼酸镎
由硝酸镎酰(Ⅵ)与K+或Ba2+起始的硼酸熔融反应产生了两种混合/中间价态的硼酸镎化合物K4[(NpO2)6.73B20O36(OH)2]和Ba2[(NpO2)6.59-B20O36(OH)2]·H2O。有趣的是这两种化合物同时包含Np(Ⅳ)、Np(Ⅴ)、Np(Ⅵ),是首次合成出的同时具有锕系元素三重价态的化合物[65-66]。同时,用Np(Ⅴ)的氯化物作为起始物也可以生成(NpO2)4[(NpO2)6.73B20O36(OH)2],其中也同时含有Np(Ⅳ)、Np(Ⅴ)、Np(Ⅵ)。在合成中利用含Np(Ⅵ)和Np(Ⅴ)的物质作为起始物所作的对比研究可以证明这些化合物是Np(Ⅴ)部分歧化反应的产物。从某种意义上讲,聚合硼酸根网格能够提供能量势阱稳定住这一热力学上的亚稳态。
K4[(NpO2)6.73B20O36(OH)2]和Ba2[(NpO2)6.59-B20O36(OH)2]·H2O的结构高度复杂(图8(a))。整体结构主要由被K+和Ba2+分割开的硼酸镎酰的二维片层构成,这些硼酸镎酰片层厚度达到1.6nm。在硼酸镎酰片层里有4个不同的镎酰位点,其都是以线形的离子形式存在。其中的两个位点,在赤道平面被6个氧原子配位而形成NpO8六角双锥配位环境。第三个离子在赤道面与5个氧原子成键,成为一个NpO7五角双锥配位构型。键价总和计算表明NpO8位点的镎是+6价,而NpO7位点的镎是+5价。最后一个位点只与4个氧原子在赤道平面成键,形成一个四角双锥结构,其镎酰Np O键长为0.193 8(14)nm,比一般Np(Ⅴ)化合物的平均键长0.183(2)nm长很多。该处镎的键长和键价总和计算表明NpO6位点是+4价。值得注意的是,NpO6位点的配位环境全部由阳离子-阳离子相互作用键构成。具有线形双氧镎酰的Np(Ⅳ)基元以及仅由阳离子-阳离子相互作用参与配位的锕系元素化合物是首次被发现的[67-68]。同时,NpO6、NpO7、NpO8基元通过多种阳离子-阳离子相互作用桥接到一起形成整体相对致密的二维片层结构。
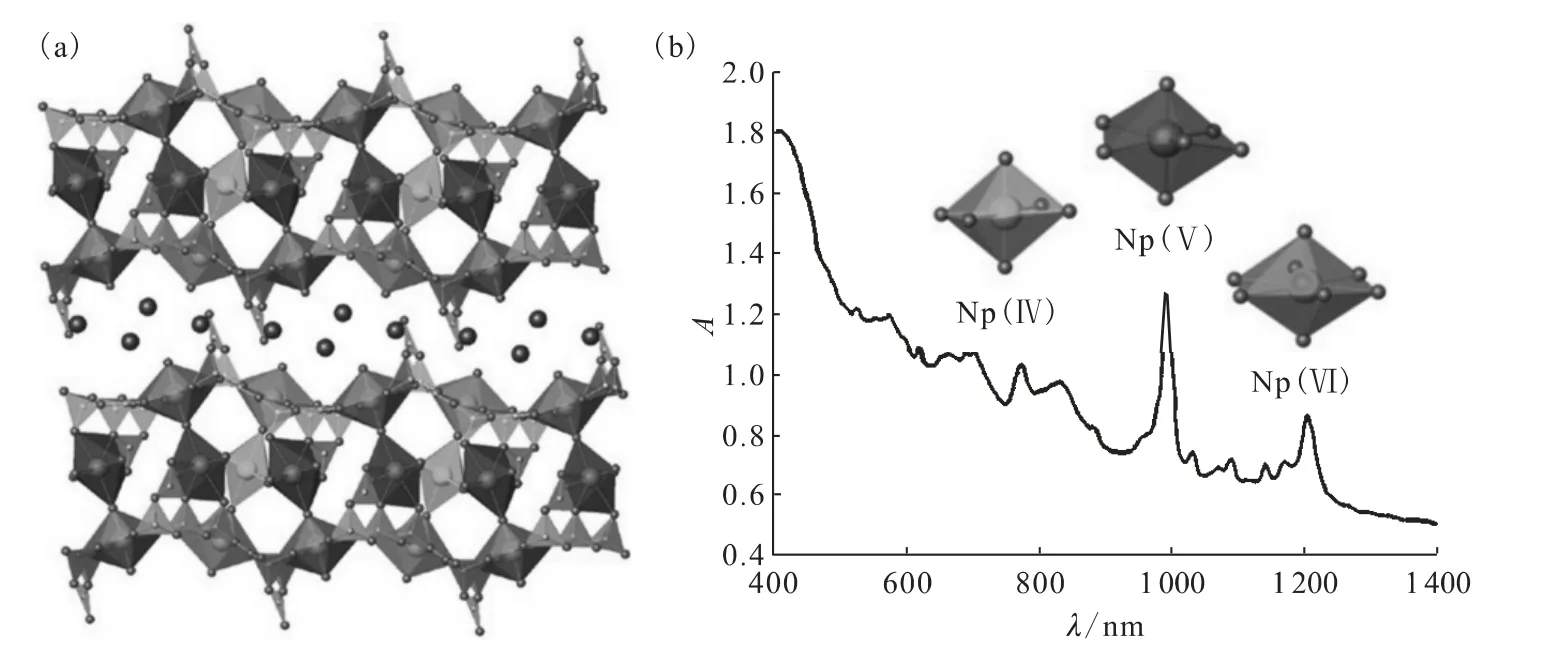
图8 K4[(NpO2)6.73B20O36(OH)2]和Ba2[(NpO2)6.59B20O36(OH)2]·H2O的结构描述(a)以及K4[(NpO2)6.73B20O36(OH)2]的紫外可见近红外吸收光谱图显示Np(Ⅳ)、Np(Ⅴ)和Np(Ⅵ)的f-f特征跃迁吸收(b)[26]Fig.8 Depiction of the structure of K4[(NpO2)6.73B20O36(OH)2]or Ba2[(NpO2)6.59B20O36(OH)2]·H2O(a)and UV-vis-NIR spectrum of K4(NpO2)6.73B20O36(OH)2showing regions of f-f transitions that indicate the presence of Np(Ⅳ),Np(Ⅴ),and Np(Ⅵ)(b)[26]
K4[(NpO2)6.73B20O36(OH)2]和Ba2[(NpO2)6.59-B20O36(OH)2]·H2O的紫外可见近红外吸收光谱也提供了晶体中三种镎的氧化态同时存在的更有力证据。图8(b)的一系列吸收峰清楚地显示出Np(Ⅳ)、Np(Ⅴ)、Np(Ⅵ)的存在。对Np(Ⅳ)最重要的f-f跃迁吸收峰在700nm到800nm之间,而对Np(Ⅴ)、Np(Ⅵ)分别在980nm和1 200nm附近[69]。结合吸收光谱和晶体结构的数据,可以确定这两个化合物的最终分子式为K4[(NpⅣO2)0.73-(NpⅤO2)2(NpⅥO2)4B20O36(OH)2]和Ba2[(NpⅣO2)0.59-(NpⅤO2)2(NpⅥO2)4B20O36(OH)2]·H2O。
变温磁化率曲线证明K4[(NpO2)6.73B20O36(OH)2]是一简单的顺磁体。基于无晶体场分裂项的Curie-Weiss拟合可以得到该化合物中每个镎离子的平均有效磁矩为(3.08±0.15)μB。根据Russell-Saunders耦合理论,Np(Ⅳ)自由离子的有效磁矩是3.62μB,Np(Ⅴ)的为3.58μB,Np(Ⅵ)的为2.54μB[70]。因此由理论值计算得到的该化合物理论平均有效磁矩为3.01μB,很好地吻合了实验测量值。这也同样成为镎的三重价态同时存在的有力证据。K4[(NpO2)6.73B20O36(OH)2]的磁性行为与包含混合价态Np(Ⅳ)/Np(Ⅴ)的硒酸盐化合物Np(NpO2)2(SeO3)3相似,并且与大多数只含Np(Ⅴ)的化合物在小于10K时形成铁磁有序或者在接近20K时形成反铁磁有序形成鲜明对 比[71-72]。
3.2 硼酸镎(Ⅴ)
硼酸的熔点为170.9℃,进行熔融反应时,必须高于此温度。为了在温度更低的条件下制备锕系硼酸盐化合物,最简单的有机硼酸,甲基硼酸被用来作为硼酸熔融反应的替代物,甲基硼酸的熔点在89~94℃之间,相对硼酸低很多。此外,C—B键热稳定性不高,甲基硼酸容易降解为硼酸。根据这个合成思想,首个单一价态Np(Ⅴ)的硼酸盐,NpO2[B3O4(OH)2]被成功制备,这一结果表明温度是Np(Ⅴ)在硼酸盐体系中发生歧化的关键决定因素[28]。
NpO2[B3O4(OH)2]的晶体结构主要由包含五角双锥的二维片层组成。在片层结构内部,每个阳离子和其他4个镎酰阳离子通过阳离子-阳离子相互作用相连。这些片层进一步通过BO3和BO4基元沿着b轴方向堆叠从而形成三维框架结构(图9(a))。两个Np=O键长分别为0.185(1)nm和0.181(2)nm,键价总和计算与晶体中包含Np(Ⅴ)单一价态的结果相符[73]。在NpO2[B3O4(OH)2]中仅存在Np(Ⅴ)也可以被紫外可见近红外吸收光谱证明(图9(b))。由于阳离子-阳离子相互作用的存在,Np(Ⅴ)的特征f-f跃迁从980nm红移到1 013nm。同时,谱图中没有Np(Ⅳ)和Np(Ⅵ)的特征吸收峰[69]。
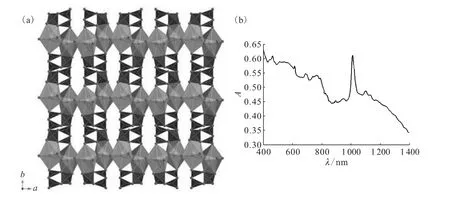
图9 NpO2[B3O4(OH)2]的晶体结构示意(a)及其紫外可见近红外吸收光谱(b)[28]Fig.9 Depiction of the structure(a)and UV-vis-NIR spectrum(b)of NpO2[B3O4(OH)2]obtained from a single crystal[28]
3.3 硼酸镎(Ⅵ)
起始物中镎的价态及氧化还原电位是决定产物中镎的价态的最关键因素。当在硼酸熔融体系中起始物是硝酸盐和氯化盐时,制备出的往往是混合/中间价态镎的硼酸盐化合物[26-27]。用具有温和氧化性的高氯酸根作为起始物时,可以成功制备出含单一价态Np(Ⅵ)的硼酸盐,NpO2[B8O11(OH)4]。
NpO2[B8O11(OH)4]结晶于非中心对称空间群Cc。其总体结构示于图10(a),镎酰离子占据聚合硼酸根片层中的六边形孔洞,形成了AnO8六角双锥结构。每个AnO8基元在[ac]平面被9个硼酸根基元包围。镎酰硼酸盐片层之间由额外的BO3三角和BO4四面体连接从而形成三维框架结构。
U(Ⅵ)和Pu(Ⅵ)的NpO2[B8O11(OH)4]类似物也可以被制备。因此,锕系收缩现象可以在AnO2[B8O11(OH)4](An=U、Np、Pu)系列等结构化合物中被晶格参数证明。UO2[B8O11(OH)4]的晶胞是1.183 4(5)nm3,NpO2[B8O11(OH)4]的是1.182 1(2)nm3,PuO2[B8O11(OH)4]的 是1.180 0(3)nm3,这完美地符合锕系收缩规律。从铀到钚,六价锕酰离子中的An≡O键键长平均缩减0.002nm。由于离子半径收缩很细微,一般锕系收缩现象很难从具有不同结构的铀、镎、钚化合物检测到(由键长测试误差造成)。锕系收缩只有在晶体数据好、残余因子小、化合物是等同结构的情况下才能被检测出[74]。
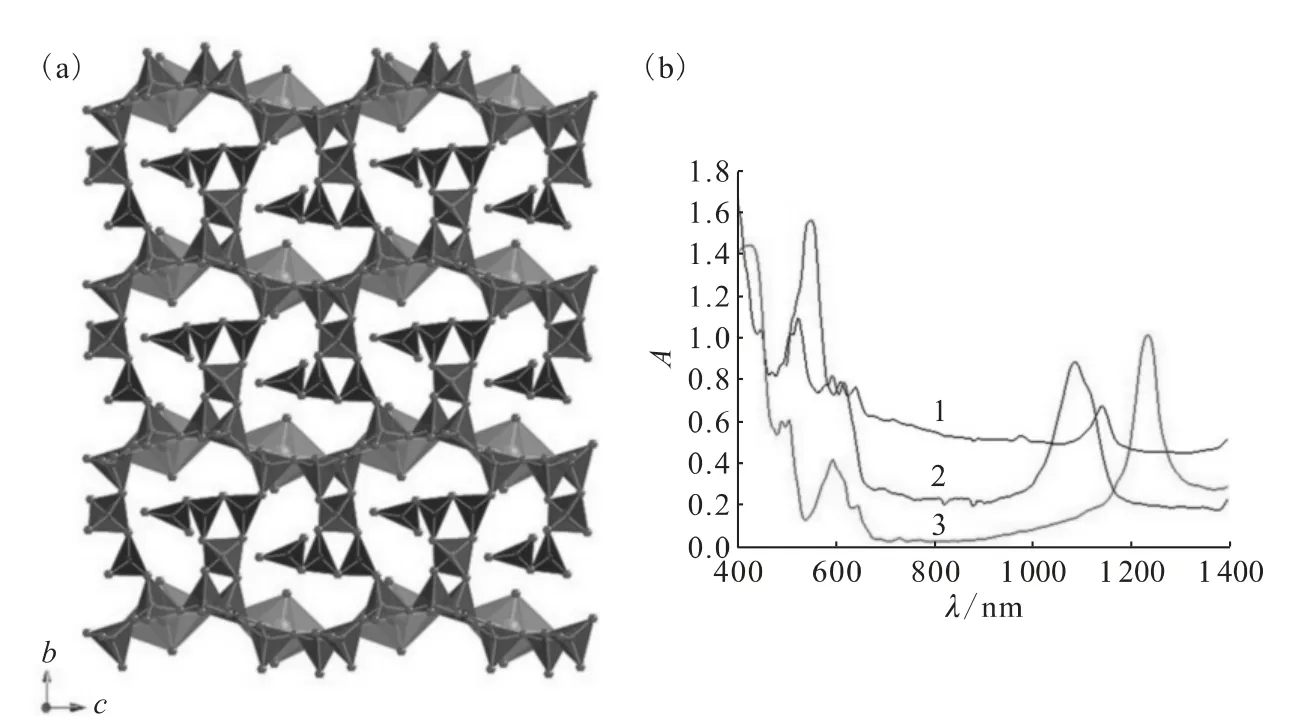
图10 NpO2[B8O11(OH)4]的极性三维框架结构(a)及Np(Ⅵ)化合物的紫外可见近红外吸收光谱(b)[29]Fig.10 Depiction of the polar,three-dimensional network found for NpO2[B8O11(OH)4](a)and UV-vis-NIR absorption spectra of the Np(Ⅵ)compounds(b)[29]
5f1的电子结构往往产生一个较宽的Laporte禁阻f-f跃迁,从而在可见或近红外波段出现一个强吸收峰。U(Ⅴ)的f-f跃迁在可见光的范围内[75]。对于Np(Ⅵ)来说,跃迁的位置在1 200nm附近。从NpO2[B8O11(OH)4]单晶中获得的紫外可见近红外吸收光谱示于图10(b)。和液态样品相比,六价镎的固态样品的特征吸收峰位置更容易受到配位环境的影响。例如,在NpO2(NO3)2·6H2O中,镎的配位环境为六角双锥构型,它的吸收峰在1 100nm处。NpO2[B8O11(OH)4]在1 140nm处显示了一个跃迁。与此形成对比的是,NpO2(IO3)2-(H2O)的跃迁在1 230nm处[76],与在高氯酸盐和硝酸盐溶液中找到的峰相似[69],这些镎都是五角双锥的配位构型。此外,KNpO2PO4·3H2O的跃迁峰在1 427nm处,其配位环境是四角双锥[77]。由此看来在赤道平面的供体原子的数目越多,镎中心的电荷密度越大,f-f跃迁需要的能量就越大。这与在Np(Ⅴ)化合物中于980nm处的跃迁变化规律相反,由于阳离子-阳离子相互作用的存在,f-f跃迁所需能量变小[68]。
4 三价镧系/锕系(钚、镅、锔)的硼酸盐化合物
次锕系元素(镅、锔)与镧系元素的化学性质极为相近,它们最常见及最稳定的价态都为正三价。它们的三价阳离子(包括三价钚)在表观电荷以及离子半径上的差异都非常小,同时它们的前线轨道4f与5f轨道都基本不参与成键,由此造成当今乏燃料后处理中最具有挑战的难题之一:三价镧锕分离及镅锔分离[78]。这在它们的配位化学中也得以体现,以往研究十分完整的镧系锕系晶格系统无法鉴别出三价镧系锕系元素,也就是说,它们的化合物全部采取等同晶体结构的形式存在,例如[Ln(H2O)9]3+和[An(H2O)9]3+系统[74]。而我们发现硼酸盐能够有效地鉴别出三价的镧系元素及钚、镅、锔这三种锕系元素[32-34]。
4.1 硼酸镧(Ⅲ)
早期的镧系元素(Ln=La—Nd)由LnCl3起始能够生成Ln[B4O6(OH)2Cl]。这类化合物的结构总体可以描述为一致密的三维骨架结构(图11(a));镧系金属中心具有一崭新的配位环境(图11(b)),可称之为是10配位的倒三角杯构型[79],其中包括6个共平面的氧原子加上顶部的1个氯原子及底部的3个配位原子(2个氧原子和1个氯原子)。

图11 Ln[B4O6(OH)2Cl](Ln=La—Nd)的三维骨架结构(a)及镧系金属中心的配位环境示意图(b)[32]Fig.11 3Dstructure of Ln[B4O6(OH)2Cl](Ln=La-Nd)(a)and coordination environments of Ln sites(b)[32]
中期的镧系元素(Ln=Sm—Eu)在等同条件的反应下能够生成Ln4[B18O25(OH)13Cl3]。这类化合物的晶体结构虽然同为三维骨架结构,其结构相对疏松(图12(a)),并且镧系金属中心的配位数由10降为9,其又一崭新的配位环境可被称为呼啦圈构型(图12(b))[80],由类似的6个共平面的氧原子加上头部的氯原子以及脚部的2个氧原子构成。
晚期的镧系元素(Ln=Y,Eu—Lu)能够生成Ln[B6O9(OH)3]。这类化合物的晶体结构也为三维骨架结构(图13(a)),其镧系金属中心的配位情况发生更大的变化,为典型的镧系金属tricapped trigonal prism配位环境(图13(b))。值得注意的是,这类镧系元素硼酸盐产物完全丢失了氯的成分,其镧系金属中心配位层仅由氧原子构成[33]。
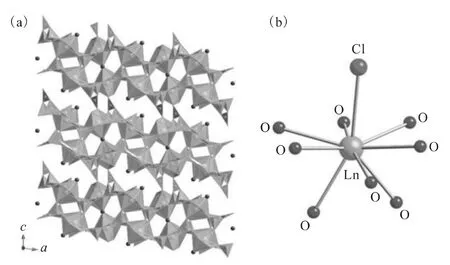
图12 Ln4[B18O25(OH)13Cl3](Ln=Sm—Eu)的三维骨架结构(a)及镧系金属中心的配位环境示意图(b)[33]Fig.12 Depiction of the three-dimensional framework structure of Ln4[B18O25(OH)13Cl3](Ln=Sm-Eu)(a)and coordination environments of Ln sites(b)[33]
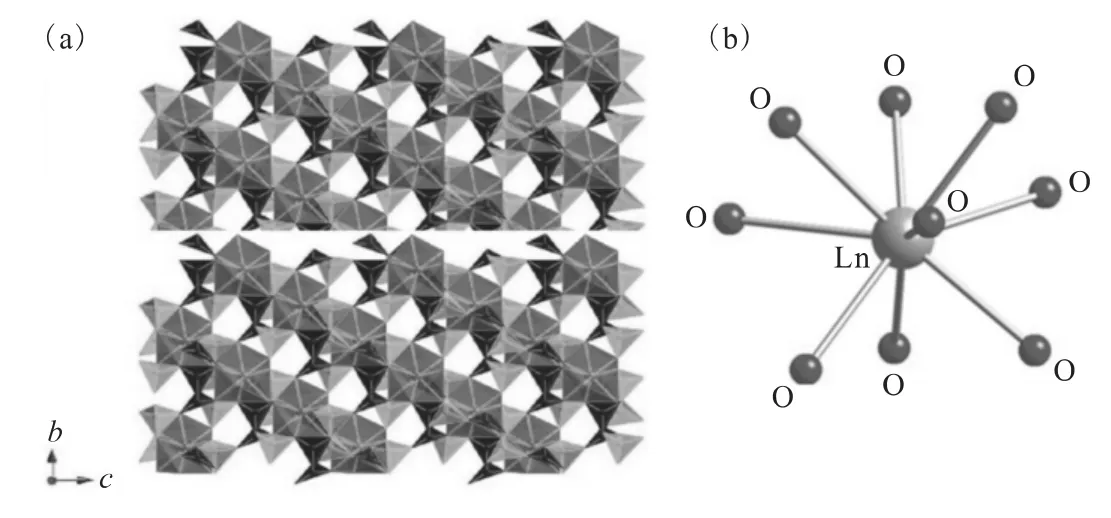
图13 Ln[B6O9(OH)3](Ln=Y,Eu—Lu)的三维骨架结构(a)及镧系金属中心的配位环境示意图(b)[33]Fig.13 Depiction of the three-dimensional framework structure of Ln[B6O9(OH)3](Ln=Y,Eu-Lu)(a)and coordination environments of Ln sites(b)[33]
4.2 硼酸钚(Ⅲ)、镅(Ⅲ)、锔(Ⅲ)
以三氯化钚(PuCl3)为起始物在同样的反应条件下得到了两种不同的产物:与早期镧系元素硼酸盐等同的Pu[B4O6(OH)2Cl]和另外一个崭新的产物Pu2[B13O19(OH)5Cl2(H2O)3],后者采取了一个相对疏松的三维骨架结构(图14(a)),其钚原子中心的配位环境为类似于早期镧系元素硼酸盐的10配位倒三角杯构型,但氯原子存在且仅存在于其顶点的位置(图14(b))。
与此同时,以三氯化镅(AmCl3)为起始物在同样的反应条件下生成另外一个崭新的没有任何镧系元素等同物的化合物Am[B9O13(OH)4]·H2O,其整体结构虽也是三维骨架结构(图15(a)),但从分子式就可以看出,其与硼酸钚化合物存在明显区别,类似于晚期的镧系元素硼酸盐,未包含任何氯的成分。具体到镅的配位环境,也从钚的10配位倒三角杯构型转变成9配位呼啦圈构型,但特殊的是,其顶点的氯原子丢失从而被替换成氧原子(图15(b))。
更加有趣的是,以三氯化锔(CmCl3)为起始物也在同样的反应条件下生成又一个极其特殊并且同时也没有任何其他元素等同物的化合物Cm2[B14O20(OH)7(H2O)2Cl],其整体结构虽与其他化合物类似,但具体到锔的配位环境出现了一个意外的结果,同时包含10配位倒三角杯构型以及9配位呼啦圈构型。在10配位倒三角杯构型中,其类似于镅的硼酸盐化合物的情况在顶点处丢失了氯原子,而氧原子占据了所有的配位点;在9配位呼啦圈构型中,其又类似于钚的硼酸盐化合物的情况在顶点处保留了氯原子。因此,锔的硼酸盐采取了一个界于钚和镅之间的晶体结构构型,并且不等同于任何镧系元素硼酸盐。
4.3 小结

图14 Pu2[B13O19(OH)5Cl2(H2O)3]的三维骨架结构(a)及钚原子中心的配位环境示意图(b)[32]Fig.14 Depiction of the three-dimensional framework structure of Pu2[B13O19(OH)5Cl2(H2O)3](a)and coordination environments of plutonium sites(b)[32]
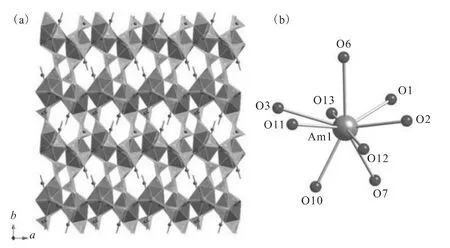
图15 Am[B9O13(OH)4]·H2O的三维骨架结构(a)及镅原子中心的配位环境示意图(b)[32]Fig.15 Depiction of the three-dimensional framework structure of Am[B9O13(OH)4]·H2O(a)and coordination environments of americium sites(b)[32]
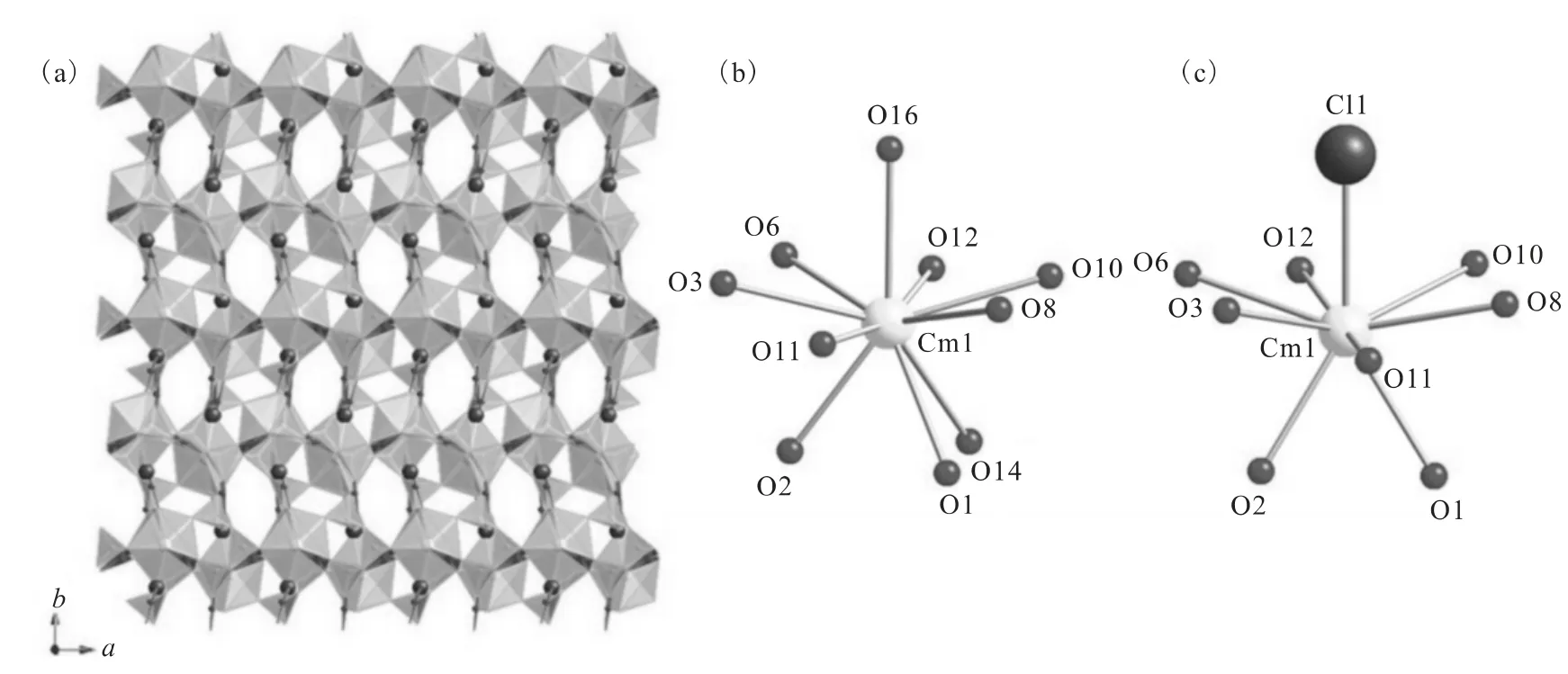
图16 Cm2[B14O20(OH)7(H2O)2Cl]的三维骨架结构(a)及锔原子中心的两种配位环境示意图(b,c)[34]Fig.16 Depiction of the three-dimensional framework structure of Cm2[B14O20(OH)7(H2O)2Cl](a)and coordination environments of curium sites(b,c)[34]
阐述至此,已不难发现,我们首次发现了这样一个独特的系统,在完全等同的反应条件下:(1)镧系元素可以生成任何锕系元素所不能生成的化合物Ln4[B18O25(OH)13Cl3](Ln=Sm—Eu);(2)锕系元素也可以生成任何镧系元素所不能生成的化合物Pu2[B13O19(OH)5Cl2(H2O)3]、Am[B9O13(OH)4]·H2O以及Cm2[B14O20(OH)7-(H2O)2Cl];(3)所有锕系元素分别生成差异巨大的化合物。综上所述,可以认为,硼酸盐晶格可以完全地鉴别三价的镧系与锕系元素,从而在混合体系下反应生成各自的晶体产物(不互相掺杂在同一晶体中);而在以往的配体系统中,三价的镧系与锕系元素倾向于形成完全等同的化合物,因此在混合体系下非常容易相互掺杂到等同化合物的同一晶体中(无法分离)。对于硼酸盐体系对于镧系锕系元素特殊的鉴别能力,我们认为源自于两个方面因素的协同作用:(1)硼酸根参与配位时,其中B—O键的高极化率能够将镧系锕系金属中心的电子结构差异放大化;(2)硼酸根极易聚合成结构极其复杂且种类多样化的聚合离子,在三价镧系锕系硼酸盐体系中,聚合硼酸根的骨架容易随着金属中心离子半径的细微变化做出相应显著的改变。
5 结论与展望
综上所述,锕系元素在熔融硼酸中的化学行为与其在水溶液中存在本质上的差别。在水溶液合成体系下未有锕系元素的三重价态化合物,未有锕系元素的阳离子框架化合物,也未有能够具有鉴别三价镧系锕系元素能力的晶格被发现。很显然从基础科研的角度来说,锕系元素在特殊反应媒介下的配位化学有待进一步考查和深挖。与此同时,该研究为当今核能产业中核废料处置和核燃料循环工艺提供了三方面新思路:
首先,硼酸钍化合物NDTB-1是首个能够选择性地将高放废液中高锝酸根有效去除的纯无机阳离子框架材料。它在阴离子交换的过程中保持高度的稳定性,且阴离子交换过程可以实现可逆(NDTB-1中的高锝酸根可以被带更多电荷的阴离子进一步交换出来),因此NDTB-1可以重复循环地将高放废液中的99Tc有效分离出来。我们相信,基于这种材料所添加后处理流程能够有效地解决锝在高放废物中的易泄漏问题。
其次,硼酸熔融法提供了一个新的高放废物固化方法,不仅其固化条件非常温和(约200℃),且其固化产物具有较高的环境稳定性及辐照稳定性。我们发现,这些硼酸盐化合物在沸水中具有非常有限的溶解度,同时化合物的晶体具有极强的抗辐射性,含高浓度243Am的Am[B9O13(OH)4]·H2O晶体在合成出来3a后仍未有可观测到的辐射损伤。尽管如此,这些化合物的环境稳定性还有待进一步考察,诸如化学稳定性(氧化还原气氛、酸碱度)、热稳定性、天然有机质及细菌对晶格的破坏、外辐照及其各因素之间的协同作用对于晶体稳定性的影响。
最后,硼酸盐晶格可以完全地鉴别出三价的镧系与锕系元素,从而在混合体系下反应生成各自的晶体产物(不互相掺杂在同一晶体中),我们也注意到,正是由于不同元素所形成的不同结构化合物,其物理性质也会存在相应的差异,例如,硼酸镅与硼酸锔由于在金属配位环境方面存在含氯与否的区别,从而造成晶体的密度差异达到0.15g/cm3。因此可以利用这种不同密度晶体在特定密度液体中的分层分布实现分离,其操作和原理都十分简单。这将有可能引申出崭新的镧锕分离及锕系内部分离尤其是镅锔分离方略。
[1]Nakano T,Nakamura E.Boron isotope geochemistry of metasedimentary rocks and tourmalines in a subduction zone metamorphic suite[J].Phys Earth Planet Inter,2001,127(1):233-252.
[2]Taylor S R.Abundance of chemical elements in the continental crust:a new table[J].Geochim Cosmochim Acta,1964,28(8):1273-1285.
[3]Burns P C,Ewing R C,Hawthorne F C.The crystal chemistry of hexavalent uranium:polyhedron geometries,bond-valence parameters,and polymerization of polyhedra[J].Can Mineral,1997,35:1551-1570.
[4]Burns P C.U6+minerals and inorganic compounds:insights into an expanded structural hierarchy of crystal structures[J].Can Mineral,2005,43(6):1839-1894.
[5]Burns P C,Miller M L,Ewing R C.U6+minerals and inorganic phases:a comparison and hierarchy of crystal structures[J].Can Mineral,1996,34:845-880.
[6]Donald I W,Metcalfe B L,Taylor R N J.The immobilization of high level radioactive wastes using ceramics and glasses[J].J Mater Sci,1997,32(22):5851-5887.
[7]Grambow B.Nuclear waste glasses-how durable?[J].Elements,2006,2:357-364.
[8]Lutze W.Glass[M]∥Uncertainty Underground.Macfarlane A M,Ewing R C.London:The MIT Press,2006:353-364.
[9]Snider A C.Verification of the definition of generic weep brine and the development of a recipe for this brine[R].US:United States Department of Energy,2003.
[10]Borkowski M,Richmann M,Reed D T,et al.Complexation of Nd(Ⅲ)with tetraborate ion and its effect on actinide(Ⅲ)solubility in WIPP brine[J].Radiochim Acta,2010,98(9-11):577-582.
[11]Behm H.Hexapotassium(cyclo-octahydroxotetracosaoxohexadecaborato)dioxouranate(Ⅵ)dodecahydrate,K6[UO2{B16O24(OH)8}]·12H2O[J].Acta Cryst,1985,C41:642-645.
[12]Gasperin M.Synthesis and structure of calcium borouranate:CaB2U2O10[J].Acta Cryst,1987,C43:1247-1250.
[13]Gasperin M.Structure of uranium borate(UB2O6)[J].Acta Cryst,1987,C43:2031-2033.
[14]Gasperin M.Synthesis and structure of magnesium diborouranate,MgB2UO7[J].Acta Cryst,1987,C43:2264-2266.
[15]Gasperin M.Synthesis and structure of sodium borouranate,NaBUO5[J].Acta Cryst,1988,C44:415-416.
[16]Gasperin M.Synthesis and structure of nickel tetraborouranate Ni7B4UO16[J].Acta Cryst,1989,C45:981-983.
[17]Gasperin M.Synthesis and structure of lithium borouranate(LiBUO5)[J].Acta Cryst,1990,C46:372-374.
[18]Cousson A,Gasperin M.Synthesis and structure of thorium borate:ThB2O5[J].Acta Cryst,1991,C47:10-12.
[19]Clark D L,Hobart D E,Neu M P.Actinide carbonte complexes and their importance in actinide environmental chemistry[J].Neu Chem Rev,1995,95(1):25-48.
[20]Wang S,Alekseev E V,Diwu J,et al.NDTB-1:a supertetrahedral cationic framework that removes TcO-4from solution[J].Angew Chem Int Ed,2010,122(6):1075-1078.
[21]Yu P,Wang S,Alekseev E V,et al.Technetium-99 MAS NMR spectroscopy of a cationic framework material that traps TcO-4ions[J].Angew Chem Int Ed,2010,122(34):6111-6113.
[22]Wang S,Alekseev E V,Ling J,et al.Polarity and chirality in uranyl borates:insights into understanding the vitrification of nuclear waste and the development of nonlinear optical materials[J].Chem Mater,2010,22(6):2155-2163.
[23]Wang S,Alekseev E V,Stritzinger J T,et al.How are centrosymmetric and noncentrosymmetric structures achieved in uranyl borates?[J].Inorg Chem,2010,49(6):2948-2953.
[24]Wang S,Alekseev E V,Stritzinger J T,et al.Crystal chemistry of the potassium and rubidium uranyl borate families derived from boric acid fluxes[J].Inorg Chem,2010,49(14):6690-6696.
[25]Wang S,Alekseev E V,Stritzinger J T,et al.Structure:property relationships in lithium,silver,and cesium uranyl borates[J].Chem Mater,2010,22(21):5983-5991.
[26]Wang S,Alekseev E V,Ling J,et al.Neptunium diverges sharply from uranium and plutonium in crystalline borate matrixes:insights into the complex behavior of the early actinides relevant to nuclear waste storage[J].Angew Chem Int Ed,2010,49(7):1263-1266.
[27]Wang S,Alekseev E V,Depmeier W,et al.Further insights into intermediate-and mixed-valency in neptunium oxoanion compounds:structure and absorption spectroscopy of K2[(NpO2)3B10O16(OH)2-(NO3)2][J].Chem Com,2010,46(22):3955-3957.
[28]Wang S,Alekseev E V,Miller H M,et al.Boronic acid flux synthesis and crystal growth of uranium and neptunium boronates and borates:a low-temperature route to the first neptunium(Ⅴ)borate[J].Inorg Chem,2010,49(21):9755-9757.
[29]Wang S,Villa E M,Diwu J,et al.Role of anions and reaction conditions in the preparation of uranium(Ⅵ),neptunium(Ⅵ),and plutonium(Ⅵ)borates[J].Inorg Chem,2011,50(6):2527-2533.
[30]Wang S,Alekseev E V,Depmeier W,et al.Surprising coordination for plutonium in the first plutonium(Ⅲ)borate[J].Inorg Chem,2011,50(6):2079-2081.
[31]Wang S,Alekseev E V,Diwu J,et al.Functionalization of borate networks by the incorporation of fluoride:syntheses,crystal structures,and nonlinear optical properties of novel actinide fluoroborates[J].Chem Mater,2011,23(11):2931-2939.
[32]Polinski M J,Wang S,Alekseev E V,et al.Bonding changes in plutonium(Ⅲ)and americium(Ⅲ)borates[J].Angew Chem Int Ed,2011,50(38):8891-8894.
[33]Polinski M J,Grant D J,Wang S,et al.Differentiating between trivalent lanthanides and actinides[J].J Am Chem Soc,2012,134(25):10682-10692.
[34]Polinski M J,Wang S,Alekseev E V,et al.Curium(Ⅲ)borate shows coordination environments of both plutonium(Ⅲ)and americium(Ⅲ)borates[J].Angew Chem Int Ed,2012,51(8):1869-1872.
[35]Callegari A,Caucia F,Mazzi F,et al.The crystal structure of peprossiite-(Ce),an anhydrous REE and Al mica-like borate with square-pyramidal coordination for Al[J].Am Mineral,2000,85(3-4):586-592.
[36]Boiocchi M,Callegari A,Ottolini L,et al.The chemistry and crystal structure of okanoganite-(Y)and comparison with vicanite-(Ce)[J].Am Mineral,2004,89(10):1540-1545.
[37]Callegari B A,Ottolini L.The crystal structure of piergorite-(Ce),Ca8Ce2(Al0.5)Σ1(Li,Be)2-Si6B8O36(OH,F)2:a new borosilicate from vetralla,Italy,with a modified hellandite-type chain[J].Am Mineral,2006,91:1170-1177.
[38]Oberti R,Ottolini L,Camara F,et al.Crystal structure of non-metamict Th-rich hellandite(Ce)from latium(Italy)and crystal chemistry of the hellandite-group minerals[J].Am Mineral,1999,84:913-921.
[39]Della V G,Bonazzi P,Oberti R,et al.Ciprianiite and mottanaite-(Ce),two new minerals of the hellandite group from latium(Italy)[J].Am Mineral,2002,87(5-6):739-744.
[40]Mushran S P.Thorium borate sol and gel[J].Nature,1946,158:95-95.
[41]Rives V.LDHs:layered double hydroxides:present and future[M].Hauppauge,New York,USA:Nova Science Publishers Inc.,2001.
[42]Evans D G,Slade R C T,Layered double hydroxides[M].New York,USA:Springer-Verlag,2006.
[43]Oliver S R J.Cationic inorganic materials for anionic pollutant trapping and catalysis[J].Chem Soc Rev,2009,38(7):1868-1881.
[44]Goulding H V,Hulse S E,Clegg W,et al.Yb3O-(OH)6Cl·2H2O:an anion-exchangeable hydroxide with a cationic inorganic framework structure[J].J Am Chem Soc,2010,132(39):13618-13620.
[45]Fei H,Rogow D L,Oliver S R J.Reversible anion exchange and catalytic properties of two cationic metal-organic[J].J Am Chem Soc,2010,132:7202-7209.
[46]Alekseev E V,Krivovichev S V,Depmeier W.A crown ether as template for microporous and nanostructured uranium compounds[J].Angew Chem Int Ed,2008,47(3):549-551.
[47]Ok K M,Sung J,Hu G,et al.TOF-2:a large 1D channel thorium organic framework[J].J Am Chem Soc,2008,130(12):3762-3763.
[48]Wilson R E,Skanthakumar S,Knope K E,et al.An open-framework thorium sulfate hydrate with 11.5Åvoids[J].Inorg Chem,2008,47(20):9321-9326.
[49]Kaszuba J P,Runde W H.The aqueous geochemistry of neptunium:dynamic control of soluble concentrations with applications to nuclear waste disposal[J].Environ Sci Technol,1999,33(24):4427-4433.
[50]Yoshida Z,Johnson S G,Kimura T,et al.Neptunium[M]∥The Chemistry of the Actinide and Transactinide Elements.Morss L R,Edelstein N M,Fuger J.The Netherlands:Springer,2006,vol.2,ch.6,pp.753-770.
[51]Bray T H,Ling J,Choi E S,et al.Critical role of water content in the formation and reactivity of uranium,neptunium,and plutonium iodates under hydrothermal conditions:implications for the oxidative dissolution of spent nuclear fuel[J].Inorg Chem,2007,46(9):3663-3668.
[52]Rao L.Thermodynamics of actinide complexation in solution at elevated temperatures:application of variable-temperature titration calorimetry[J].Chem Soc Rev,2007,36(6):881-892.
[53]Bühl M,Schreckenbach G,Sieffert N,et al.Effect of counterions on the structure and stability of aqueous uranyl(Ⅵ)complexes:a first-principles molecular dynamics study[J].Inorg Chem,2009,48(21):9977-9979.
[54]Pikaev A K,Gogolev A V,Shilov V P.Redox reactions of neptunium and plutonium in alkaline aqueous solutions upon gamma radiolysis[J].Radiat Phys Chem,1999,56(4):483-491.
[55]Almond P M,Sykora R E,Skanthakumar S,et al.Hydrothermal synthesis,structure,and magnetic properties of the mixed-valent Np(Ⅳ)/Np(Ⅴ)selenite Np(NpO2)2(SeO3)3[J].Inorg Chem,2004,43(3):958-963.
[56]Charushnikova I,BosséE,Guillaumont D,et al.Crystal and electronic structure of a mixed-valent Np(Ⅳ)-Np(Ⅴ)compound:[BuMeIm]5[Np(NpO2)3(H2O)6Cl12][J].Inorg Chem,2010,49(5):2077-2082.
[57]Cornet S M,Häller L J L,Sarsfield M J,et al.Neptunium(Ⅵ)chain and neptunium(Ⅵ/Ⅴ)mixed valence cluster complexes[J].Chem Commun,2009(8):917-919.
[58]Grigor′ev M S,Fedoseev A M,Budantseva N A.Crystal structure of the mixed-valence neptunium compound Na6[(NpVO2)2(NpVIO2)(MoO4)5]·13H2O[J].Russ J Coord Chem,2003,29(12):877-879.
[59]Burns P C,Kubatko K A,Sigmon G,et al.Actinyl peroxide nanospheres[J].Angew Chem Int Ed,2005,44(14):2135-2139.
[60]Burns P C,Grice J D,Hawthorne F C.Borate minerals I:polyhedml clusters and fundamental building blocks[J].Can Mineral,1995,33:1131-1151.
[61]Grice J D,Burns P C,Hawthorne F C.Borate minerals II:a hierarchy of structures based upon the borate fundamental building block[J].Can Mineral,1999,37:731-762.
[62]Yuan G,Xue D.Crystal chemistry of borates:the classification and algebraic description by topological type of fundamental building blocks[J].Acta Cryst,2007,63(3):353-362.
[63]Belokoneva E L.Systematic,properties,and structure predictions of new borate materials[J].Cryst Res Technol,2008,43(11):1173-1182.
[64]Touboul M,Penin N,Nowogrocki G.Borates:a survey of main trends concerning crystal-chemistry,polymorphism and dehydration process of alkaline and pseudo-alkaline borates[J].Solid State Sci,2003,5(10):1327-1342.
[65]Dendrinou-Samara C,Zaleski C M,Evagorou A,et al.A cationic 24-MC-8manganese cluster with ring metals possessing three oxidation states(μ4-O)2(μ3-O)4(μ3-OH)4(μ3-OCH3)2(pko)12](OH)(ClO4)3[J].Chem Commun,2003(21):2668-2669.
[66]Okubo T,Kuwamoto H,Kim K H,et al.Intervalence charge-transfer system by 1Dassembly of new mixed-valence octanuclear CuⅠ/CuⅡ/CuⅢcluster units[J].Inorg Chem,2011,50(7):2708-2710.
[67]Sullivan J C,Hindman J C,Zielen A J.Specific interaction between Np(Ⅴ)and U(Ⅵ)in aqueous perchloric acid media[J].J Am Chem Soc,1961,83(16):3373-3378.
[68]Krot N N,Grigoriev M S.Cation-cation interaction in crystalline actinide compounds[J].Russ Chem Rev,2004,73(1):89.
[69]Friedman H A,Toth L M.Absorption epectra of Np(Ⅲ),(Ⅳ),(Ⅴ)and(Ⅵ)in nitric acid eolution[J].J Inorg Nucl Chem,1980,42(9):1347-1349.
[70]Edelstein N M.Magnetic properties[M]∥The Chemistry of the Actinide and Transactinide Elements.Morss L R,Edelstein N M,Fuger J.The Netherlands:Springer,2006,vol.4,ch.20,pp.2225-2306.
[71]Nakamoto T,Nakada M,Nakamura A.Magnetic study of pentavalent neptunium phthalate hexahydrate(NpO2)2(O2C)2C6H4·6H2O[J].Solid State Commun,2001,119(8):523-526.
[72]Forbes T Z,Burns P C,Skanthakumar S,et al.Synthesis,structure,and magnetism of Np2O5[J].J Am Chem Soc,2007,129(10):2760-2761.
[73]Forbes T Z,Wallace C,Burns P C.Neptunyl compounds:polyhedron geometries,bond-valence parameters,and structural hierarchy[J].Can Mineral,2008,46(6):1623-1645.
[74]Apostolidis C,Schimmelpfennig B,Magnani N,et al.[An(H2O)9](CF3SO3)3(An=U-Cm,Cf):exploring their stability,structural chemistry,and magnetic behavior by experiment and theory[J].Angew Chem Int Ed,2010,122(36):6487-6491.
[75]Liu G,Beitz J V.Spectra and electronic structures of free actinide atoms[M]∥The Chemistry of the Actinide and Transactinide Elements.Morss L R,Edelstein N M,Fuger J.The Netherlands:Springer,2006,vol.4,ch.16,pp.2013-2111.
[76]Bean A C,Scott B L,Albrecht-Schmitt T E,et al.Structural and spectroscopic trends in actinyl iodates of uranium,neptunium,and plutonium[J].Inorg Chem,2003,42(18):5632-5636.
[77]Forbes T Z,Burns P C.The crystal structures of X(NpO2)(PO4)(H2O)3(X=K+,Na+,Rb+,)and their relationship to the autunite group[J].Can Mineral,2007,45(3):471-477.
[78]Runde W H,Schulz W W.Americium[M]∥The Chemistry of the Actinide and Transactinide Elements.Morss L R,Edelstein N M,Fuger J.The Netherlands:Springer,2006,vol.2,ch.8,pp.1265-1395.
[79]Ruiz-Martínez A,Alvarez S.Stereochemistry of compounds with coordination number ten[J].Chem-Eur,2009,15(30):7470-7480.
[80]Ruiz-Martínez A,Casanova D,Alvarez S.Polyhedral structures with an odd number of vertices:ninecoordinate metal compounds[J].Chem-Eur,2008,14(4):1291-1303.
