活性污泥胞外聚合物对铀酰离子的吸附性能
2014-06-07刘峙嵘吴振宇
陈 帅,刘峙嵘,吴振宇
1.东华理工大学化学生物与材料科学学院,江西南昌 330013;2.东华理工大学核工程技术学院,江西南昌 330013
活性污泥胞外聚合物对铀酰离子的吸附性能
陈 帅1,刘峙嵘1,吴振宇2
1.东华理工大学化学生物与材料科学学院,江西南昌 330013;2.东华理工大学核工程技术学院,江西南昌 330013
用乙酸钠培养驯化了取自污水处理厂的活性污泥,采用NaOH提取法从活性污泥中提取了胞外聚合物(EPS)。用静态法研究了EPS对铀酰离子的吸附行为,探讨了温度、pH、反应时间、EPS投加量和离子强度等因素对铀酰离子吸附效果的影响,进行了吸附热力学、吸附动力学研究,对比了EPS吸附铀酰离子前后的红外谱图。结果表明:最佳吸附温度为25℃,最佳吸附时间为120min,EPS最佳投加量为300mg/L,离子强度对吸附影响较大;吸附热力学和动力学研究表明,吸附过程更符合Freundlich吸附模型和假二级反应动力学模型。
活性污泥;胞外聚合物;铀酰离子;吸附
核能的开发和利用给人类带来巨大的经济效益和社会效益,但是也不可避免产生了大量的放射性废物,给人类的生存环境带来了较大的威胁。放射性废水是放射性废物的重要组成部分,放射性废水的处理问题也是放射性废物处理研究的重要问题之一。
目前处理放射性废水的方法有很多,其中生物吸附法具有去除率高、成本低、易于降解、无毒等优点[1]。大量的研究表明,活性污泥胞外聚合物(EPS)作为一种新型生物吸附剂对重金属离子具有很好的吸附性能[2-4]。并且,EPS从活性污泥中获得,解决了一部分污泥的出路,减少了污泥废物,降低了对环境带来的污染。因此,对其开展一系列的研究工作非常有意义。国外对EPS的研究起步较早,而且关于EPS对重金属吸附作用的研究侧重于重金属离子的吸附过程和机理。Guibaud[5]研究发现,氢离子与金属离子之间交换不是EPS吸附金属离子的唯一吸附机理,它的吸附机理还有阳离子交换、配位基或菌胶团周围的电场作用等。国内用EPS进行重金属吸附试验的文献报道较多,但是用来进行含铀废水吸附的相关报导却很少。苑士超[6]对厌氧活性污泥胞外聚合物除铀试验的研究表明,用NaOH法提取获得的厌氧污泥EPS,对铀表现出良好的吸附性能,铀去除率可高达98.3%。本工作拟采用静态吸附法研究好氧活性污泥胞外聚合物对铀酰离子的吸附情况,并进行吸附热力学、动力学研究及吸附前后红外谱图比对,探索吸附机理,以此为相关学者提供参考。
1 材料与方法
1.1 试剂与仪器
所用试剂除了溴化钾为光谱纯外,其他试剂均为市售分析纯。试验用水均为去离子水。
721E型可见光分光光度计,上海光谱仪器有限公司;UV-754型紫外可见光分光光度计,上海光谱仪器有限公司;Flash EA1112型元素分析仪,Thermo Electron SPA公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;Nicolet-5700型红外吸收光谱仪,Thermo Nicolet公司;SHA-B型水浴恒温震荡器,常州国华电器有限公司;AR124CN型电子分析天平,感量为0.000 1g,奥豪斯仪器(上海)有限公司;FD-1A-50型真空冷冻干燥箱,北京博医康实验仪器有限公司。
1.2 活性污泥的培养及其胞外聚合物的提取
1.2.1 活性污泥的培养与驯化 活性污泥取自江西抚州市污水处理厂A/O池的好氧段,采用SBR反应器培养。向装培养液的SBR反应器加入乙酸钠,最后加入接种污泥,曝气搅拌,对活性污泥进行驯化培养。驯化的周期为12h,其中进水阶段30min、曝气反应阶段9h、沉淀阶段1.5h、排水排泥阶段30min以及闲置阶段30min。活性污泥在实验室室温条件下培养,溶液中溶解氧量控制在3~5mg/L,调节pH=6.5~7.5。每一个周期开始之前,排出5L经沉淀阶段沉淀下来的上清液,再补齐5L配置的培养溶液,使得混合后培养液的化学需氧量(用K2Cr2O7法测定,简写为CODcr)大约为600mg/L。曝气阶段结束前的20min内,反应器排出1L的混合溶液。培养过程中采用不间断监测的方法来监测反应器中活性污泥的4项参数污泥沉降比(SV)、污泥浓度(MLSS)、污泥体积指数(SVI)、混合液挥发性悬浮固体浓度(MLVSS)及培养溶液的CODcr,只有当上述5个参数稳定时间达10d以上,取样实验才可开始进行。
1.2.2 胞外聚合物的提取 采用NaOH提取法对EPS进行提取:(1)取适量SBR反应器中的活性污泥于烧杯中,用去离子水清洗,静置30min倒掉上清液,再用去离子水补齐继续静置30min,如此反复操作3次,得到试验所需活性污泥;(2)用NaOH溶液将污泥的pH调为11,缓慢搅拌15min,用冷冻离心机在转速为10 000r/min、温度为4℃的条件下离心20min,上清液用滤膜过滤,得到了较粗的EPS溶液;(3)将粗EPS溶液的pH调至中性,转移到透析袋(分子截留量为8 000~14 000)中,并将透析袋放在体积为2L的大烧杯中,烧杯加去离子水1 500mL,用磁力搅拌器搅拌6h,每隔1h换水一次。经6h的透析之后得到了纯度较高的EPS溶液。
1.3 活性污泥胞外聚合物组分的测定、元素分析以及红外光谱表征
试验分别用苯酚-硫酸法、双缩脲法以及紫外分析法测定EPS中多糖、蛋白质以及核酸的含量。并且用元素分析仪对EPS中的C、N、H三种元素进行含量分析。将冷冻干燥好的EPS固体样品与溴化钾按照1∶200的质量比均匀混合,倒入研钵研磨10min,过筛(2μm)之后压片,将制成片状的样品放入到红外光谱仪中进行红外光谱表征。1.4 活性污泥胞外聚合物吸附铀酰离子研究
在250mL的锥形瓶中加入EPS、铀酰离子标准溶液、硝酸钾溶液和去离子水,体积之和为100mL,用稀硝酸溶液和稀氢氧化钠溶液将混合溶液的初始pH值调节成一定值后,将锥形瓶放在恒温水浴振荡器内振荡,振荡的频率设定为200r/min,设定一定温度和时间;振荡吸附后,从锥形瓶中吸取50mL样品溶液,装入透析袋(截留分子量为8 000~14 000)中,然后将透析袋放入装有500mL去离子水体积为1L的大烧杯内透析6h[7],取少量透析袋外面的水样,用偶氮胂(Ⅲ)分光光度法测定水样中的铀离子浓度,进而计算出锥形瓶溶液中残余的铀酰离子浓度。
2 结果与讨论
2.1 EPS组分以及元素分析
试验测得EPS总量为16.851mg/g(以MLSS计),EPS中多糖、蛋白质、核酸的含量分别为8.512、0.822、3.532mg/g(以MLSS计,下同),三种物质分别占EPS总量的50.513%、4.878%、20.960%。其中多糖含量最大,超过50%,这跟当前的一些研究结果相吻合。元素分析仪测得EPS中C、N、H含量分别为520.100、95.123、90.002mg/g。
2.2 不同吸附温度对EPS吸附铀酰离子的影响
在铀酰离子初始质量浓度20mg/L、c(KNO3)=0mol/L、ρ(EPS)=200mg/L、pH=3.0、反应时间120min的试验条件下,进行温度(θ)对铀酰离子吸附影响的试验,结果示于图1。由图1可知,EPS对铀酰离子的吸附率随着温度的升高而呈现逐渐增大的趋势,但吸附率增长的数值并不明显。这与苑士超[6]、陶琴琴[8]等的研究结果相一致。选取体系温度为25℃作为后续实验吸附反应温度。
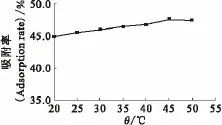
图1 不同吸附温度下EPS对铀酰离子的吸附Fig.1 Adsorption of uranyl ion on EPS at different temperatures
2.3 不同pH对EPS吸附铀酰离子的影响
在铀酰离子初始质量浓度20mg/L、c(KNO3)=0mol/L、ρ(EPS)=200mg/L、反应时间120min、反应温度25℃的试验条件下,进行pH对铀酰离子吸附影响试验,结果示于图2。由图2可知:EPS对溶液体系中铀酰离子的吸附受pH的影响很强烈,随着pH的升高,吸附率逐渐增大;在pH=2.0~4.0,EPS对铀酰离子的吸附率随着pH的升高而迅速增大;当pH>6.0以后,吸附率曲线趋于平坦,吸附率稳定在90%以上。这可能是因为,在低pH环境中,溶液中大量的H+与铀酰离子争夺EPS上的结合位点,并使EPS表面质子化,增加其表面张力,导致吸附效率不高。溶液的pH并不是越高越好,为了防止铀酰离子水解以及沉淀因素[9]对实验的影响,选取pH=3.0作为后续实验吸附反应的pH。
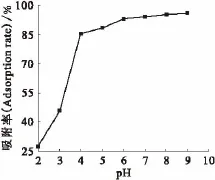
图2 pH对EPS吸附铀酰离子的影响Fig.2 Influence of pH on the adsorption of uranyl to EPS
2.4 不同吸附时间对EPS吸附铀酰离子的影响
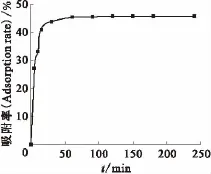
图3 不同吸附时间下EPS对铀酰离子的吸附Fig.3 Adsorption of uranyl ion on EPS in different time
在铀酰离子初始质量浓度20mg/L、c(KNO3)=0mol/L、ρ(EPS)=200mg/L、反应温度25℃、pH=3.0的试验条件下,进行反应时间(t)对铀酰离子吸附影响试验,结果示于图3。由图3可知:EPS对铀酰离子的吸附率随振荡吸附时间的增加而增大,反应刚开始的5~30min,EPS对铀酰离子的吸附较快,吸附效率增加的趋势非常显著;在30~60min这个阶段吸附率增长变缓;当吸附反应时间达到120min时,吸附率基本接近平衡值;继续增大吸附时间,吸附率基本不变,趋于稳定。这可能是因为在反应刚开始时,EPS上存在较多的吸附位点,这些位点都可以提供给EPS来吸附溶液中的铀酰离子;而吸附反应发生一段时间后,EPS上的吸附位点减少,并且吸附位点上附着的铀酰离子与溶液体系中的铀酰离子之间存在同电荷斥力,导致了吸附效率增长的速率变缓;继续吸附使得EPS上的吸附位点趋于饱和,溶液体系中铀酰离子很难被EPS上的吸附位点吸附。从实验结果来看,EPS对铀酰离子的吸附比较合适的吸附反应时间为120min,因此在之后的实验中,选取120min作为后续实验的吸附反应时间。
2.5 不同EPS投加量对EPS吸附铀酰离子的影响
在铀酰离子初始质量浓度20mg/L、c(KNO3)=0mol/L、反应温度25℃、pH=3.0、反应时间为120min的试验条件下,进行EPS浓度对铀酰离子吸附影响试验,结果示于图4。由图4可知:在开始阶段,EPS对铀酰离子的吸附率随着EPS投加量的增加而显著升高,继续增大EPS投加量,吸附率增速减缓,当投加量到达一定数值之后,EPS对铀酰离子的吸附率基本保持不变。然而,随着EPS投加量的增加,EPS对铀酰离子的吸附量却逐渐减小。造成此类现象的原因可能是:EPS量的增加提供了更多的吸附位点,但进一步增加时,高分子链状的EPS分子在水中展开程度降低,其吸附位点可能被包埋在内。从实验结果可以得出,EPS的最佳投放量为300mg/L,相对应铀酰离子的吸附率为68.328%。
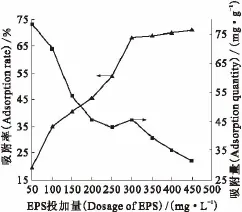
图4 不同EPS投加量下EPS对铀酰离子的吸附Fig.4 Adsorption of uranyl ion on EPS in different dosages of EPS
2.6 不同离子强度对EPS吸附铀酰离子的影响在铀酰离子初始质量浓度20mg/L、反应温度25℃、pH=3.0、反应时间为120min、ρ(EPS)=200mg/L的试验条件下,进行离子强度对铀酰离子吸附影响试验,结果示于图5。由图5可知:随着溶液体系中KNO3初始浓度的增加,EPS对铀酰离子的吸附率呈现下降的趋势,造成这种现象的原因是,KNO3初始浓度的增加使得溶液体系中电解质浓度增加,削弱了EPS与铀酰离子之间的静电作用[10];另外,在溶液体系中的电解质还会同溶液中的铀酰离子一起竞争EPS上的吸附位点进而参与到表面吸附反应中来,降低了EPS对溶液中铀酰离子的吸附率,尤其是当溶液体系中离子强度在不同量级的时候,上述现象表现得尤为明显。
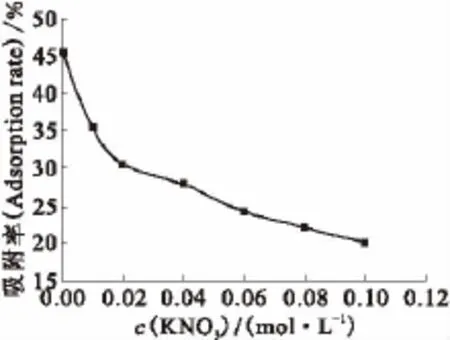
图5 不同离子强度下EPS对铀酰离子的吸附Fig.5 Adsorption of uranyl ion on EPS in different ionic strength
2.7 吸附热力学研究
在研究吸附反应机理的过程中,比较常用的方程有两个[11-12]:一个是Freundlich方程,ln qe=
ln Qf+nlnρe;另外一个是Langmiur方程其中:qe,吸附反应达到平衡时EPS对铀酰离子的吸附量,mg/g;Qf,Freundlich方程等温式中吸附容量,mg/L;n,Freundlich方程等温式中模型常数;ρe,铀酰离子平衡质量浓度,mg/L;qmax,EPS对铀酰离子的最大吸附量,mg/g;Kl,Langmuir方程等温式中吸附反应平衡常数,L/mg。为了探索EPS对溶液中铀酰离子的吸附机理,将用以上两个方程来对实验数据进行拟合。
在25℃、pH=3.0、c(KNO3)=0mol/L、ρ(EPS)=200mg/L、反应时间为120min的试验条件下进行吸附试验,对试验结果进行拟合,得到吸附等温线,结果示于图6。由图6可知:EPS对铀酰离子的吸附既符合Freundlich吸附模型,也符合Langmuir吸附模型,但从相关系数评价的标准角度来看,Freundlich吸附模型更适合用来描述EPS对溶液体系中铀酰离子的吸附过程。
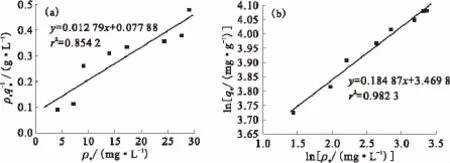
图6 Langmuir(a)和Freundlich(b)吸附等温曲线Fig.6 Langmuir(a)and Freundlich(b)isothermal adsorption curves
Freundlich吸附模型可以用来描述以下两类表面吸附行为:一类是表面不均一的表面吸附行为;另一类是粒子在表面位点吸附后,存在相互作用的表面吸附行为。Langmuir吸附模型导出的条件有两个[12]:一个是表面的吸附位点均匀分布,不存在差异;另一个是单层吸附。说明了EPS对铀酰离子的吸附都不是简单的单分子层吸附。通过拟合得到EPS对溶液体系中铀酰离子的吸附指数n=0.185,介于0.1和1.0之间[13],反映了EPS对溶液体系中铀酰离子的吸附反应比较容易进行,吸附性能也比较好。
2.8 吸附动力学研究
在研究吸附反应中固相和液相两相的吸附动力学时,比较常用的有两个模型[14]:一个是假一级反应动力学模型,另一个是假二级反应动力学模型。两个模型的表达式分别为:(qe-qt)=ln qe-其中:t,吸附反应的时间;qt,t时刻EPS对溶液体系中铀酰离子的吸附量,mg/g;qe,假一级反应动力学方程中吸附反应达到平衡时的吸附量,mg/g;qmax,2,假二级反应动力学方程中吸附反应的最大吸附量,mg/g;k1,假一级反应动力学模型速率常数;k2,假二级反应动力学模型速率常数。
对2.3节的试验数据进行拟合,得出反应动力学模型方程拟合曲线,结果示于图7。由图7可知,假一级反应动力学方程线性拟合较差,从相关系数评价的标准角度来看,假二级反应动力学模型更适合描述EPS对溶液体系中铀酰离子的吸附。假二级反应动力学模型作出了以下假设[15]:①吸附反应的作用方式是一种化学作用方式;②在整个的吸附过程中,在开始时吸附速率最快,大于其他任何时刻的瞬时吸附速率;③吸附位点对于吸附每个铀酰离子的吸附能都一样,不存在差异。
假二级反应动力学模型对EPS吸附铀酰离子的数据拟合,得出EPS对溶液体系中铀酰离子吸附最大吸附量(qmax)为46.253mg/g。
2.9 EPS吸附铀酰离子前后的红外光谱分析
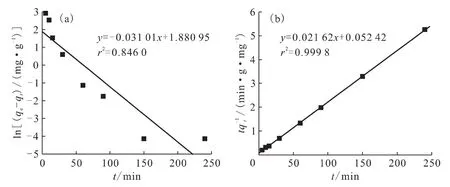
图7 假一级(a)和假二级(b)动力学方程拟合曲线Fig.7 First order reaction(a)and second order reaction(b)fitting curves of different kinetic equations
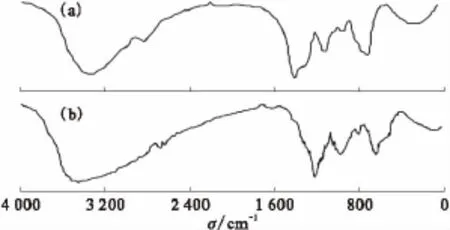
图8 EPS吸附铀酰离子前(a)后(b)的红外光谱图对比Fig.8 Comparison of FTIR spectra of EPS before(a)and after(b)adsorbed uranyl ion
EPS吸附铀酰离子前后的红外光谱图对比示于图8。由图8可知,EPS吸附铀酰离子前后红外谱图发生了一些变化,一些官能团的谱峰发生了漂移或强弱变化。吸附前谱图中1 200~1 600cm-1处有一个特征峰,表示EPS中存在羧基;800~1 200cm-1有几个强度不大的吸收峰,表示EPS中存在少量的多聚糖和苯环;800cm-1以下的特征峰表示EPS中存在磷酸基或硫酸基团;吸附反应后,这几个峰都不同程度的向右迁移。这说明在EPS吸附铀酰离子的过程中,羧基、多聚糖和苯环中的基团以及磷酸基或硫酸基团都参与了吸附反应;在3 200~3 600cm-1处的一个宽峰也发生了较大变化,但是很难确定是其中的哪种基团参与了吸附反应。EPS吸附前后的明显变化说明化学吸附存在于吸附过程中,且吸附过程复杂,有多种物质的基团参与反应,吸附方式多样。
3 结 论
(1)EPS对溶液体系中铀酰离子的吸附率随着温度、EPS投加量和pH的升高而增大,但随温度升高而变化的幅度较小。吸附量随着EPS投加量的增加而减小。反应进行到120min之后,EPS对铀酰离子的吸附率增长缓慢。EPS吸附铀酰离子的最优试验条件如下:25℃、pH=3.0、反应时间为120min、EPS投加量为300mg/L,相对应铀酰离子的吸附率为68.328%,并随溶液体系中KNO3浓度的增加,呈现下降的趋势。
(2)吸附热力学研究表明,Freundlich吸附模型比Langmuir吸附模型更适合用来描述EPS对溶液体系中铀酰离子的吸附过程。吸附动力学研究表明,假二级反应动力学模型要更加适用于EPS对铀酰离子的吸附,吸附反应是化学吸附。
(3)对比EPS吸附铀酰离子前后的谱图发现,EPS结构中的有些部位发生了改变,一些特征吸收峰在位置或强度上发生了变化,这一现象说明化学吸附方式存在于EPS吸附溶液体系中铀酰离子的吸附过程中,且吸附过程复杂。
[1] 王远红,张红波,罗世田,等.胞外聚合物对水中Cd(Ⅱ)的吸附性能研究[J].环境工程学报,2010,4(10):2185-2189.
[2] 王亮,陈桂秋,曾光明,等.白腐真菌胞外聚合物及其对菌体吸附Pb2+的影响[J].环境科学,2011,32(3):773-778.
[3] Wei X,Fang L C,Cai P,et al.Influence of extracellular polymeric substances(EPS)on Cd adsorption by bacteria[J].Environ Pollut,2011,159(5):1369-1374.
[4] Ha J,Gélabert A,Spormann A M,et al.Role of extracellular polymeric substances in metal ion complexation on shewanella oneidensis:batchuptake,thermodynamic modeling,ATR-FTIR,and EXAFS study[J].Geochim Cosmochim Acta,2010,74(1):1-15.
[5] Guibaud G,Hullebusch E V,Bordas F.Lead and cadmium biosorption by extracellular polymeric substances(EPS)extracted from activated sludges:pH-sorption edge tests and mathematical equilibrium modeling[J].Chemosphere,2006,64(11):1955-1962.
[6] 苑士超.厌氧活性污泥及厌氧污泥胞外聚合物(EPS)除铀试验研究[D].衡阳:南华大学,2012.
[7] Dominguez L,Rodríguez M,Prats D.Effect of different extraction methods on bound EPS from MBR sludges partⅡ:influence of extraction methods over molecular weight distribution[J].Desalination,2010,262:106-109.
[8] 陶琴琴.有机底物对活性污泥胞外聚合物吸附水中铜,锌的影响[D].南昌:东华理工大学,2012.
[9] 高伟.硅藻土和膨润土对铀的吸附研究[D].衡阳:南华大学,2006.
[10]Filius J D,Lumsdon D G,Meeussen J C L,et al.Adsorption of fulvic acid on goethite[J].Geochim Cosmochim Acta,2000,64(1):51-60.
[11]Shahwan T,Erten H N,Unugur S.A characterization study of some aspects of the adsorption of aqueous Co2+ions on a natural bentonite clay[J].J Colloid Interface Sci,2006,300:447-452.
[12]Langmuir I.The adsorption of gases on plane surfaces of glass,mica and platinum[J].Am Chem Soc,1918,40:1361-1403.
[13]Acar F N,Malkoc E.The removal of chromium(Ⅵ)from aqueous:solutions by fagus orientalis L[J].Bioresour Technol,2004,94:13-15.
[14]Cheung C W,Porte J F,Mckay G.Sorption kinetic analysis for the removal of cadmium ions from effluents using bone char[J].Water Res,2001,35:605-612.
[15]刘峙嵘,韦鹏,周利民.63Ni在泥煤水体系中的吸附动力学[J].应用化学,2007,24(4):420-423.
Adsorption of Uranyl on Extracellular Polymeric Substances From Activated Sludge
CHEN Shuai1,LIU Zhi-rong1,WU Zhen-yu2
1.School of Chemistry Biology and Materials Science,East China Institute of Technology,Nanchang 330013,China;2.School of Nuclear Engineering Technology,East China Institute of Technology,Nanchang 330013,China
The activated sludge got from sewage treatment plant was cultivated by sodium acetate.Extracellular polymeric substances(EPS)were extracted through NaOH extraction method.The adsorption behavior of EPS on uranyl was studied by static method.The influences of temperature,pH,adsorption time,the dosage of the EPS and ionic strength on the effect of adsorption of uranyl were discussed.Thermodynamic and kinetic of adsorption were discussed,too.The infrared spectra of EPS before and after adsorbing uranyl were compared.The experimental results indicate that the best adsorption temperature is 25℃,the best adsorption time is 120min,and the best dosage of EPS is 300mg/L.The ionic concentration has a strongly impact on adsorption.The study of adsorption thermodynamics indicates that the adsorption process conforms to the Freundlich adsorption model.The study of adsorption kinetics indicates that the adsorption process conforms to second order reaction kinetics model.
activated sludge;extracellular polymeric substances;uranyl ion;adsorption
TL941.19
A
0253-9950(2014)01-0047-06
10.7538/hhx.2014.36.01.0047
2013-09-23;
2013-11-13
国家自然科学基金资助项目(11375043);江西省自然科学基金资助项目(20114BAB203020)
陈 帅(1990—),男,江西吉安人,硕士研究生,分析化学专业,E-mail:451640544@qq.com
