与阳阳离子络合对Np(Ⅵ)/Np(Ⅴ)表观电位及可逆性的影响
2014-12-25李晓东郑卫芳晏太红谢书宝
李晓东,鲜 亮,郑卫芳,晏太红,谢书宝
中国原子能科学研究院,北京 102413
在后处理流程中,由于体系复杂,对Np(Ⅳ)、Np(Ⅴ)、Np(Ⅵ)三种价态间转化的影响因素很多,这使得对Np价态的控制变得十分困难,其中阳阳离子络合物的生成对其价态的影响不可忽略。法国的相关研究报告表明,在后处理流程中,如果不考虑Np的阳阳离子络合行为,将无法对Np的走向做出合理解释。对于Np在不同体系下各种价态间的电位,各国学者[1-5]曾开展过较多的研究。深入了解Np在不同溶液体系中价态间电位的变化,可以帮助我们较为直观的认识一些现象对Np氧化还原行为的影响。Sullivan等[1]曾通过电化学方法测量了不同浓度U(Ⅵ)高氯酸溶液中Np(Ⅵ)/Np(Ⅴ)表观电位的变化,结果表明,在高氯酸体系中,随着溶液中铀浓度的升高,Np(Ⅵ)/Np(Ⅴ)表观电位不断增大。在此过程中主要生成了Np(Ⅴ)-U(Ⅵ)阳阳离子络合物,这说明在该体系中Np(Ⅴ)阳阳离子络合物的生成使Np(Ⅴ)的氧化变得困难。后处理流程为硝酸体系,在该体系中能否同样观察到与高氯酸体系一样的现象和变化趋势,需开展相关研究。为此,本工作拟围绕后处理硝酸体系,系统开展Np(Ⅴ)与U(Ⅵ)阳阳离子络合行为对Np(Ⅵ)/Np(Ⅴ)表观电位影响研究,以为进一步揭示在后处理过程中阳阳离子络合行为对Np价态的影响提供基础理论依据。
1 实验部分
1.1 试剂和仪器
除Np以外的化学试剂均为市售优级纯或纯度更高;用于配制相关溶液的去离子水由Milli-Q系统提供。Np储备液制备过程参照文献[2],取少量进行液闪及分光光度测量,结果表明,溶液中的Np质量浓度约为43g/L,w≈55%的Np处于五价。含有不同酸度的1.5mol/L UO2(NO3)2和Mg(NO3)2储备液通过将一定量UO2(NO3)2·6H2O和Mg(NO3)2固体分别溶解于含有一定硝酸的水溶液中得到。工作电极(CHI107)和电化学工作站(CHI660D)均由上海辰华公司生产;电化学装置外接501A型恒温水浴槽(上海实验仪器有限公司)。
1.2 实验方法和步骤
1.2.1 阳阳离子络合物的生成 恒温25℃条件下,初始溶液为2mL只含有Np(Ⅴ)(2.4×10-3mol/L)的1.5mol/L Mg(NO3)2溶液,然后逐渐加入与Mg(NO3)2溶液离子强度相同的UO2(NO3)2溶液,用分光光度计测量各溶液在950~1 020nm处的吸光度曲线。前人[1,3-4]研究结果表明,Mg2+不与NpO+2发生阳阳离子络合。故采用Mg(NO3)2作为离子介质来控制溶液的离子强度。
1.2.2 阳阳离子络合对Np(Ⅵ)/Np(Ⅴ)表观电位及反应可逆性影响研究 在含有一定浓度Np(Ⅴ)和HNO3的1.5mol/L Mg(NO3)2溶液中不断加入1.5mol/L UO2(NO3)2溶液,采用循环伏安法和差分脉冲伏安法(differential pulse voltammetry,DPV)在0.6~1.2V范围内进行电位扫描,观察Np(Ⅵ)/Np(Ⅴ)表观电位的变化。增加溶液中酸度,重复上述操作,观察酸度对电位变化的影响。电化学测量前均用0.05μmγ-Al2O3抛光粉末对电极打磨约3min,并通N24min以上以除去溶液中溶解的氧气,实验温度控制在(25±0.01)℃。根据文献[1]研究结果,在恒温条件下,阳阳离子络合物的络合稳定常数不变,在U(Ⅵ)浓度远大于Np(Ⅴ)浓度的条件下,根据理论计算,生成阳阳离子络合物的Np(Ⅴ)浓度与溶液中Np(Ⅴ)总浓度存在如下关系:
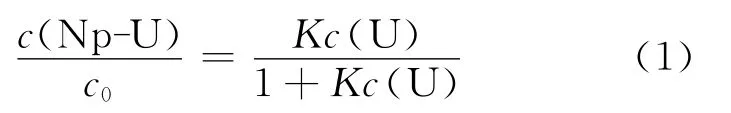
式中:c(Np-U)为生成的阳阳离子络合物中Np(Ⅴ)的浓度,c0为溶液中Np(Ⅴ)总浓度,K为Np(Ⅴ)-U(Ⅵ)阳阳离子络合物的络合稳定常数,c(U)为溶液中U(Ⅵ)浓度。由式(1)分析可知,在恒温及U(Ⅵ)浓度远大于Np(Ⅴ)浓度的条件下,溶液中生成的阳阳离子络合物的Np(Ⅴ)的量占Np(Ⅴ)总量的比例仅与溶液中U(Ⅵ)的浓度相关,此时仅改变溶液中Np的浓度(溶液中Np(Ⅴ)与Np(Ⅵ)的比例不变),对Np(Ⅵ)-Np(Ⅴ)电位的测量不构成影响。
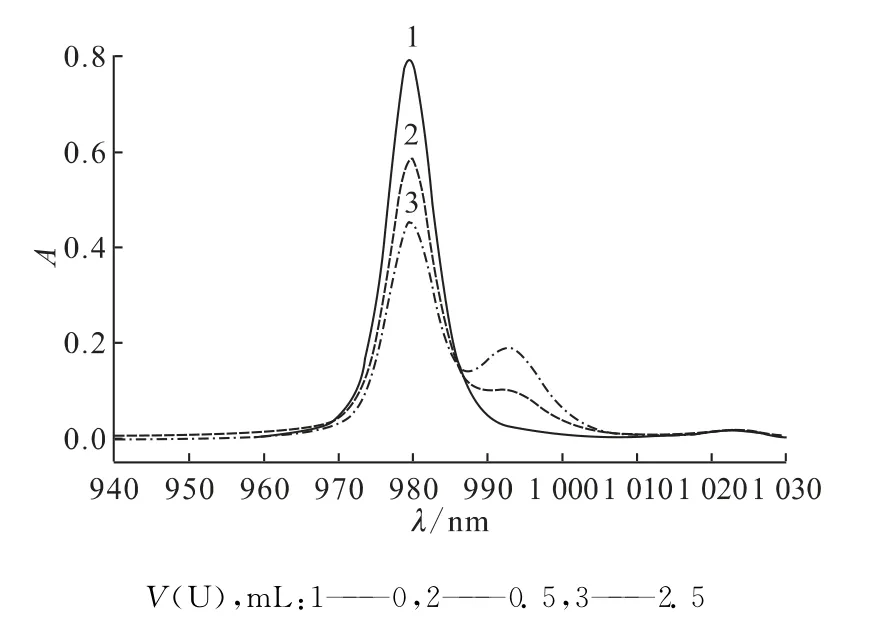
图1 Np(Ⅴ)在含Mg(NO3)2和UO2(NO3)2溶液中放置2h的吸光度曲线Fig.1 Absorption spectra of aqueous solutions of Np(Ⅴ)containing Mg(NO3)2and UO2(NO3)2(2hafter mixing)
2 结果与讨论
2.1 阳阳离子络合物的生成实验结果
在恒温25℃条件下,含有1.5mo/L Mg(NO3)2的Np(Ⅴ)溶 液 和 加 入 不 同 量 的1.5mol/L UO2(NO3)2的Np(Ⅴ)溶液在950~1 020nm处的吸光度曲线示于图1。由图1可以明显看出,体系中无U(Ⅵ)存在时,在950~1 020nm范围内只存在Np(Ⅴ)在980nm的特征吸收光谱,当加入U(Ⅵ)后,除980nm处的Np(Ⅴ)特征峰外,在992nm附近会形成新的吸收峰,这表明有新的化合物生成,这就是Np(Ⅴ)与U(Ⅵ)生成的阳阳离子络合物吸收峰。由曲线还可以看出,随着Np(Ⅴ)溶液中U(Ⅵ)浓度的逐渐增大,980nm处吸收峰不断减低,而992nm处吸收峰逐渐升高,这说明生成的Np(Ⅴ)-U(Ⅵ)阳阳离子络合物的量逐渐增加。
2.2 阳阳离子络合对Np(Ⅵ)/Np(Ⅴ)表观电位及反应可逆性影响研究结果
对酸度为0.05mol/L的Np(Ⅴ)-U(Ⅵ)溶液进行循环伏安扫描和差分脉冲伏安扫描,所得结果示于图2及表1(电位相对于Ag/AgCl参比电极,内部为3mol/L KCl溶液,本文后面所有电位值均相对于此参比电极),图中各曲线电流强度的差异是由于硝酸铀酰溶液对Np浓度的稀释造成的,对电位的测量不造成影响。
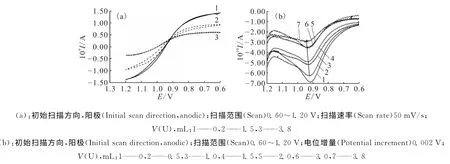
图2 0.05mol/L HNO3浓度时不同铀浓度条件下循环伏安法(a)和DPV法(b)测量结果Fig.2 CV(a)and DPV(b)of Np(Ⅴ)in different concentrations of U(Ⅵ)containing 0.05mol/L HNO3
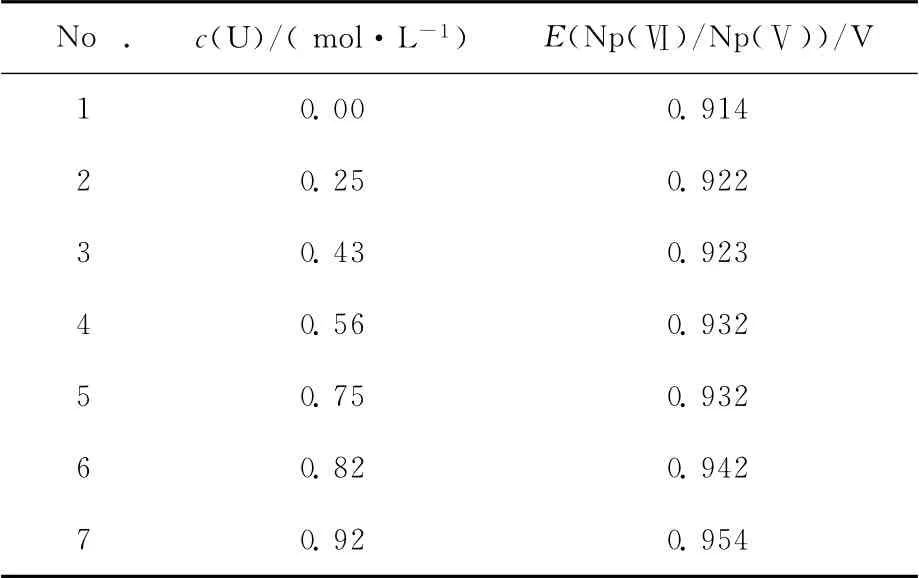
表1 0.05mol/L HNO3浓度时不同铀浓度条件下Np(Ⅵ)/Np(Ⅴ)电位值Table 1 Formal potential of Np(Ⅵ)/Np(Ⅴ)in different concentrations of U(Ⅵ)containing 0.05mol/L HNO3
由实验结果可以看出,随着溶液中铀浓度的升高,Np(Ⅵ)/Np(Ⅴ)间的电位不断增加(如图2(b)中箭头所示)。由表1数据可知,由纯Np溶液到溶液中铀浓度为0.92mol/L时,电位增大约为40mV。在本实验条件下,Np(Ⅴ)浓度最大为0.001 6mol/L,远低于U(Ⅵ)的浓度,根据式(1)分析可知,溶液中生成阳阳离子络合物的Np(Ⅴ)的量仅与U(Ⅵ)浓度相关,随着U(Ⅵ)浓度的逐渐增大,Np(Ⅴ)与U(Ⅵ)间阳阳离子络合物的生成逐渐增加,测得的Np(Ⅵ)/Np(Ⅴ)电位值逐渐增大。
根据Nernst方程:
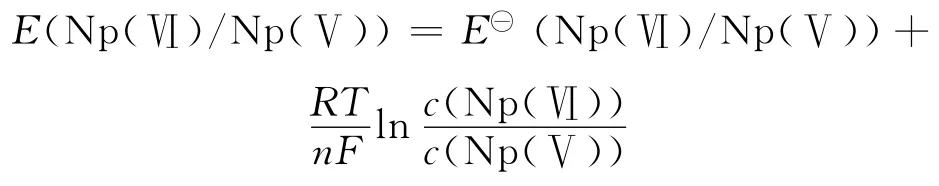
随着Np溶液中U(Ⅵ)浓度的逐渐增大,Np(Ⅴ)-U(Ⅵ)阳阳离子络合物生成量增加,溶液中自由Np(Ⅴ)浓度降低,从而使Np(Ⅵ)/Np(Ⅴ)浓度比增大,导致Np(Ⅵ)/Np(Ⅴ)表观电位增大。这说明阳阳离子络合物的生成使Np(Ⅴ)的氧化变得困难。这是由于Np(Ⅴ)的氧化属于电子转移过程,而形成阳阳离子络合物之后,要氧化络合物形态的Np(Ⅴ),需要先破坏该络合物结构才能实现Np(Ⅴ)的氧化,该过程较单纯的Np(Ⅴ)氧化而言会受到一定的抑制,速度变慢。
通过对循环伏安图像的比较可以看出,随着铀浓度的升高,测得的循环伏安曲线两侧平台逐渐消失,整体形状显示可逆性变差。根据Tomeš判据[6],由循环伏安图得到的3/4和1/4电位之间的差值ΔE=E3/4-E1/4及电子转移系数(transfer coefficient)α(通过文献[7]查得本实验体系的α=0.48),可以判断在本实验条件下Np(Ⅵ)/Np(Ⅴ)间氧化还原反应的可逆性,其中电势E3/4和E1/4分别是i=3id/4和i=id/4时对应的电势,id为极限扩散电流。不同铀浓度条件下计算得到的ΔE值列于表2。
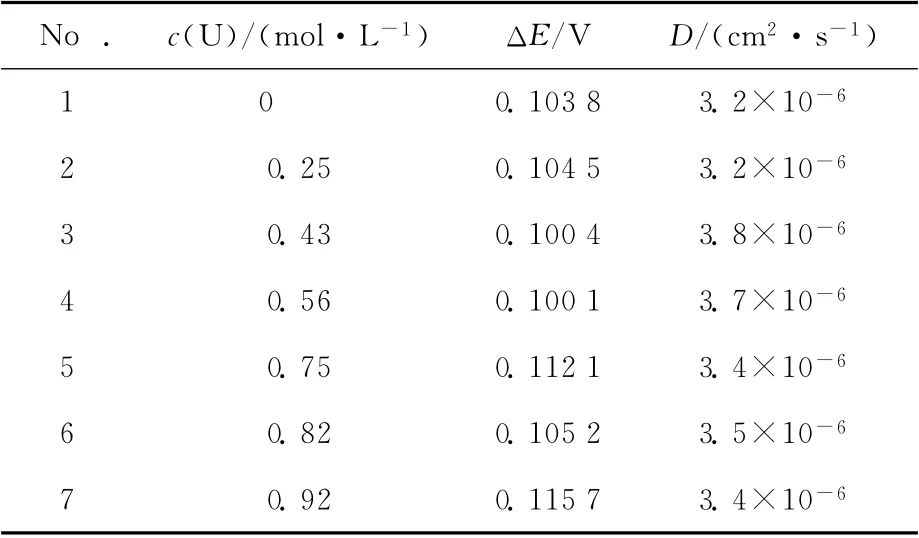
表2 ΔE值计算结果Table 2 Calculation results ofΔE
根据Tomeš判据,|ΔE|值在45.0/α-56.4/αmV(在本体系中为93.8~117.5mV)之间时,可认为反应是准可逆的,超过此范围时认为反应不可逆。根据所得实验结果知,本实验条件下该反应为准可逆,这与前人[8-9]在研究过程中提出的结论一致,从|ΔE|值整体变化趋势上可以判断,随着铀浓度的升高,ΔE值逐渐增大,这表明阳阳离子络合物的生成使Np(Ⅵ)/Np(Ⅴ)间转化反应的可逆性变差。
根据不同铀浓度时的电流值,结合公式Ⅰ=4nFDcr可以计算得到在该体系下溶液的扩散系数(表2),其中F为法拉第常数、D为扩散系数、c为Np浓度、r为电极半径。根据所得E3/4和E1/4电位及计算所得的扩散系数D值,通过文献[7]可查得本实验体系的κ0=0.25,标准速率常数k⊖(k⊖=Dκ0/r)为1.98×10-2cm/s,该值与准可逆体系的标准速率常数值相符,这也可说明该反应体系为准可逆体系。
还研究了酸度为0.5mol/L和1.5mol/L条件下,不同U(Ⅵ)浓度对Np(Ⅵ)/Np(Ⅴ)表观电位及反应可逆性的影响,各酸度条件下实验结果列于表3。
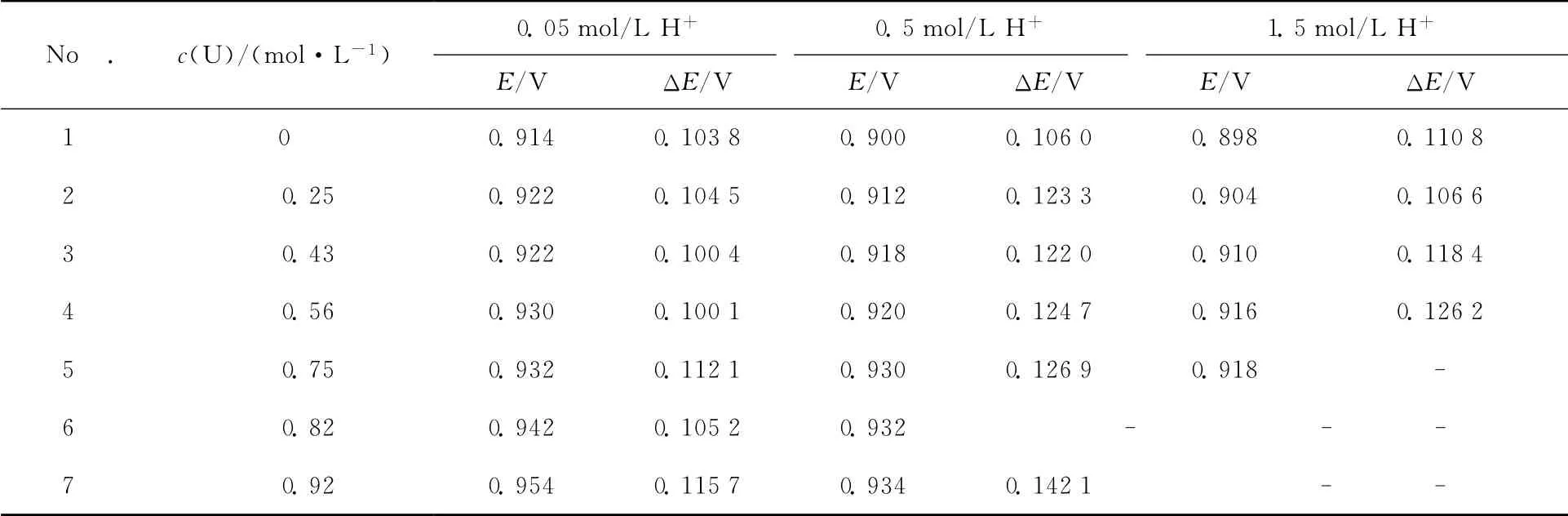
表3 0.05、0.5、1.5mol/L HNO3条件下Np(Ⅵ)/Np(Ⅴ)电位值及ΔE值随铀浓度变化结果Table 3 Formal potential of Np(Ⅵ)/Np(Ⅴ)andΔEas a function of U(Ⅵ)concentrations containing 0.05,0.5,1.5mol/L HNO3
根据前人[1,10]研究结果可知,溶液中酸度对阳阳离子络合物的生成影响不大,当溶液中H+浓度增加27倍时,阳阳离子络合物的络合稳定常数增大约20%,因此对于本实验体系,H+浓度对于阳阳离子络合物生成的影响可以忽略。
表3中的结果表明,在各酸度条件下,U(Ⅵ)浓度变化对Np(Ⅵ)/Np(Ⅴ)表观电位影响是一致的,即随着U(Ⅵ)浓度的增加,Np(Ⅵ)/Np(Ⅴ)表观电位不断升高。同时从表3结果还可以观察到,在相同U(Ⅵ)浓度条件下,随着酸度的升高,Np(Ⅵ)/Np(Ⅴ)表观电位不断降低,这与Np(Ⅴ)在不同H+浓度条件下的岐化速率变化趋势一致,也表明了本实验结果是合理的。
在开展循环伏安测量过程中发现,硝酸浓度的增加使循环伏安的测量过程变得更加困难,随着硝酸浓度的升高,电极测量变得不稳定,一次打磨后重复数次扫描,电位测量不断向负值飘移,只有采用一次打磨单次扫描的方法电位测量才有好的重现性,这可能与在扫描过程中出现某种物质吸附在电极表面有关。将该现象与开展不同硝酸浓度的0.005mol/L K3Fe(CN)6-1.5mol/L Mg(NO3)2溶液中Fe(Ⅲ)/Fe(Ⅱ)电位测量过程遇到的情况比较可以发现一些类似的问题。在开展不同酸度条件下K3Fe(CN)6溶液中Fe(Ⅲ)/Fe(Ⅱ)电位测量时,随着酸度的升高,促进了体系中普鲁士蓝的生成,该络合物会在电极表面沉积影响电位测量[11-14]。对于含Np溶液体系,随着酸度的升高,Np(Ⅴ)的歧化会加速,根据前人[15]的研究结果,Np(Ⅴ)的歧化会经历阳阳离子络合的中间过程,该络合物是否沉积在电极表面影响电位测量值得进一步研究。
由于电极稳定性的问题,对于更高酸度条件下U(Ⅵ)浓度对Np(Ⅵ)/Np(Ⅴ)表观电位的影响无法开展相关研究,但从目前的研究结果可以得出大致结论,对于后处理流程硝酸溶液体系,Np(Ⅴ)阳阳离子络合物的生成会使Np(Ⅵ)/Np(Ⅴ)表观电位增大,使Np(Ⅴ)的氧化变得困难。
3 结 论
本工作研究了不同酸度下,U(Ⅵ)浓度对Np(Ⅵ)/Np(Ⅴ)表观电位的影响,结果表明,U(Ⅵ)的加入会改变Np(Ⅵ)/Np(Ⅴ)表观电位,随着铀浓度的不断升高Np(Ⅵ)/Np(Ⅴ)表观电位不断向正值方向移动。在0.05mol/L硝酸中,溶液中铀浓度从0增加到0.92mol/L时,Np(Ⅵ)/Np(Ⅴ)表观电位增加约40mV。通过测量可得,在本实验条件下纯Np(Ⅵ)/Np(Ⅴ)氧化还原反应为准可逆反应,随着U(Ⅵ)浓度的增加,反应的可逆性变差。
[1]Sullivan J C,Hindman J C,Zielen A J.Specific interaction between Np(Ⅴ)and U(Ⅵ)in aqueous perchloric acid media[J].J Am Chem Soc,1961,83:3373-3378.
[2]Plock C E.Voltammetric determination of neptunium at the glassy carbon electrode[J].J Electroanal Chem,1968,18:289-293.
[3]Madic C,Guillaume B,Morisseau J C,et al.Cation-cation complex of pentavalent actinides-I[J].J Inorg Nucl Chem,1979,41:1027-1031.
[4]Murmann R K,Sullivan J C.The formation of a neptunium(Ⅴ)-rhodium(Ⅲ)complex:kinetics and equilibria in acidic solution[J].Inorg Chem,1967,6:892-900.
[5]Stout B E,Choppin G R.Cation-cation complexes of NpO+2[J].Radiochim Acta,1993,61:65-67.
[6]阿伦.J.巴德,拉里.R.福克纳.电化学原理和应用[M].第二版.邵元华,朱果逸,董献堆,等,译.北京:化学工业出版社,2008:140-141.
[7]Mirkin M V,Bard A J.Simple analysis of quasireversible steady-state voltammograms[J].Anal Chem,1992,64(19):2293-2302.
[8]Kim S Y,Asakura T,Morita Y.Electrochemical and spectroelectrochemical properties of neptunium(Ⅵ)ions in nitric acid solution[J].J Radioanal Nucl Chem,2004,262(2):311-315.
[9]Ikeda-Ohno A,Hennig C,Rossberg A.Electrochemical and complexation behavior of neptunium in aqueous perchlorate and nitrate solutions[J].Inorg Chem,2008,47:8294-8305.
[10]Guillaume B,Begun G M,Hahn R L.Raman spectrometric studies of“cation-cation”complexes of pentavalent actinides in aqueous perchlorate solutions[J].Inorg Chem,1982,21:1159-1166.
[11]Zhang D,Wang K,Sun D C,et al.Ultrathin layers of densely packed prussian blue nanoclusters prepared from a ferricyanide solution[J].Chem Mater,2003,15:4163-4165.
[12]Garcia-Jareno J J,Navarro-Laboulais J,Vicente F.Charge transport in prussian blue films deposited on ITO electrodes[J].Electrochim Acta,1996,41(6):835-841.
[13]Pharr C M,Criffiths P R.Infrared spectroelectrochemical analysis of adsorbed hexacyanoferrate species formed during potential cycling in the ferrocyanide/ferricyanide redox couple[J].Anal Chem,1997,69:4673-4679.
[14]Bustos E,Godínez L A.Modified surfaces with nano-structured composites of prussian blue and dendrimers:new materials for advanced electrochemical applications[J].Int J Electrochem Sci,2011,6:1-36.
[15]Hindman J C,Sullivan J C,Cohen D.Kinetics of the neptunium(Ⅲ)-neptunium(Ⅴ)reaction in perchlorate solution[J].J Am Chem Soc,1958,80:1812-1814.
