多重PCR快速诊断猪伪狂犬病毒、猪圆环病毒2型与猪细小病毒方法的建立
2014-12-24谢燕婷王隆柏张志刚
谢燕婷,郑 敏,石 磊,3,王隆柏,张志刚
(1.厦门银祥集团有限公司肉食品安全生产技术国家重点实验室,福建厦门361100;2.福建省农业科学院畜牧兽医研究所,福建福州350013;3.华南理工大学轻工与食品学院,广东广州510640)
从病料中分离出的具致病作用的病毒称为猪圆环病毒2型(porcine circovirus type 2,PCV2),而从传代细胞系PK-15中分离到的圆环病毒称为猪圆环病毒毒1型(porcine circovirus type 1,PCV1)[1].PCV2感染后会出现断奶仔猪多系统消耗综合征(postweaning multisystemic wasting syndrome,PMWS)、猪皮炎肾病综合征、猪呼吸系统混合疾病、繁殖障碍症.现“猪圆环病毒病”(porcine circovirus diseases,PCVD)的含义是指群体病或是与PCV2相关的疾病[2].PCV2是引起PMWS发生的主要原因,但其他病原如PPV等的混合感染也具有重要的协同致病性[3].伪狂犬病病毒(pseudorabies virus,PRV)又名猪疱疹病毒1型(SuHV-1),同样能够引起猪的繁殖障碍,在繁殖障碍中与PCV2混合感染[4],给养猪业造成严重的经济损失.常规的实验室病毒检测技术是通过细胞培养分离病毒,但耗时费力.本研究采用同时检测PRV、PCV2、PPV的多重聚合酶链式反应(multiplex PCR,mPCR),为这3种病毒的临床诊断以及流行病学的调查提供更加快速、灵敏、特异性的方法.
1 材料与方法
1.1 材料
1.1.1 病毒、菌株及细胞 猪伪狂犬病毒(PRV)、猪圆环病毒2型(PCV2)以及猪细小病毒(PPV)PK-15细胞均由福建省农业科学院畜牧兽医研究所畜病室提供.
1.1.2 病料及样品 采集福建省各地区病料18份作为PCR样品.
1.1.3 主要试剂 PCR 试剂(包括 Taq DNA 聚合酶、2.5 mmol·L-1dNTP、10 ×PCR buffer、25 mmo1·L-1dNTP、DL 1000 Marker、琼脂糖、低熔点琼脂糖)购于宝生物工程(大连)有限公司;Dneasy Blood&tissue kit购于德国Qiagen;AxyPrep DNA凝胶回收试剂盒购于美国Axygen;Endo-free Plasmid Mini KitⅠ质粒提取试剂盒购于美国Omega;TOPO TA Cloning Kit购自厦门英韦创津生物科技有限公司.
1.2 方法
1.2.1 引物设计 引物选择PRV gB基因、PCV2 ORF2基因、PPV VP2基因为其扩增靶序列,利用Primer Premier 5.0和DNAstar软件设计符合mPCR条件的3对引物[5,6].引物由厦门英韦创津生物科技有限公司合成(表1),合成引物保存于-20℃.
1.2.2 病毒DNA的提取 根据Dneasy Blood&tissue kit提取试剂盒说明书操作步骤进行病毒核酸提取.
1.2.3 PCR 方法的建立 PCR 反应在 25 μL 体系中进行,包括 10 × PCR buffer(Mg2+Free)2.5 μL、2.5 mmol·L-1dNTP 2 μL、25 mmol·L-1MgCl21.5 μL、10 μmol·L-1引物各1 μL、DNA 病毒模板1 μL、TaqTMDNA 聚合酶 0.15 μL,添加离子水至 25 μL,于 PCR 仪上扩增.反应条件:94.0 ℃预变性 5 min,94.0 ℃ 30 s,55.9 ℃ 45 s,72.0 ℃ 1 min,32个循环后取5 μL扩增产物通过1.5%琼脂糖凝胶电泳进行鉴定.
1.2.4 mPCR 方法的建立 mPCR 在 50 μL 体系中进行,包括 10 × PCR bufer(Mg2+Free)5 μL、2.5 mmol·L-1dNTP 4.8 μL、25mmol·L-1MgCl23.6 μL、10 μmol·L-1引物各1 μL ,TaqTMDNA 聚合酶5 U·μL-10.3 μL,用去离子水补足50 μL,于 PCR 仪上扩增.反应条件:94.0 ℃预变性5 min,94.0 ℃ 45 s,55.9 ℃ 50 s,72.0 ℃ 1 min,35个循环;72.0 ℃延伸10 min.取5 μL扩增产物通过1.5%琼脂糖凝胶电泳进行鉴定.
1.2.5 临床样品检测 将全省18份病料样品分别做单重PCR和mPCR,对比两种PCR检测方法是否存在差异.
2 结果与分析
2.1 PCR产物的克隆与鉴定
PRV、PCV2和PPV的PCR产物通过低熔点琼脂糖凝胶电泳试验进行胶回收,克隆至pcr2.1载体,转化TOP10,提取质粒后,利用载体Pcr2.1的酶切位点EcoRⅠ进行酶切试验(图1).结果表明,在PCV2目的片段的第306个位点处有EcoRⅠ的酶切位点,加上载体上被剪切的片段,酶切图显示与目的片段长度一致.经酶切鉴定确认后,送厦门英韦创津生物科技有限公司进行测序.测序结果与表1的3种病毒登录序号进行对比,与PRV、PCV2和PPV同源率分别为99%、92%和99%,表明扩增片段分别为各自病毒的特异性条带.
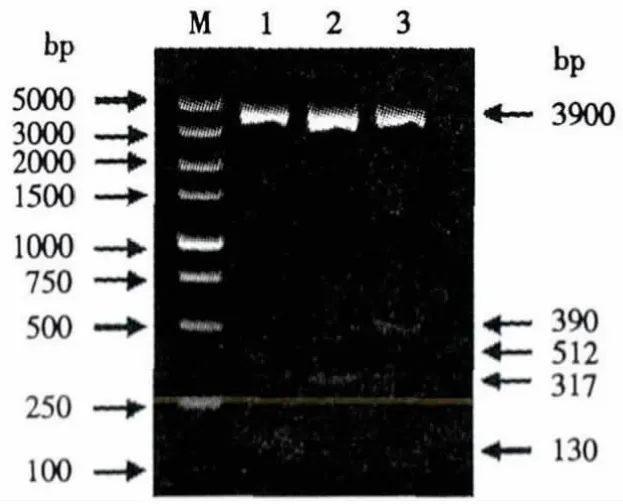
图1 质粒酶切鉴定图Fig.1 Restriction endonuclease map
2.2 mPCR反应的最佳退火温度
将 mPCR 反应的退火温度分别设置为 53.0、53.5、54.5、55.9、57.7、59.2 和60.0 ℃.从图2 可以看出,mPCR 的最佳退火温度为55.9 ℃ .

图2 不同退火温度的PCR反应Fig.2 The annealing temperature of mPCR
2.3 单重PCR与mPCR特异性试验
扩增产物通过琼脂糖凝胶电泳试验表明,PRV、PCV2和PPV分别为373、430和495 bp(图3).以PRV、PCV-2、PPV、双蒸水以及PRRSV、CSFV病毒的cDNA为模板分别进行mPCR反应.结果表明,双蒸水、PRRSV和CSFV病毒均未扩增出条带(图4).
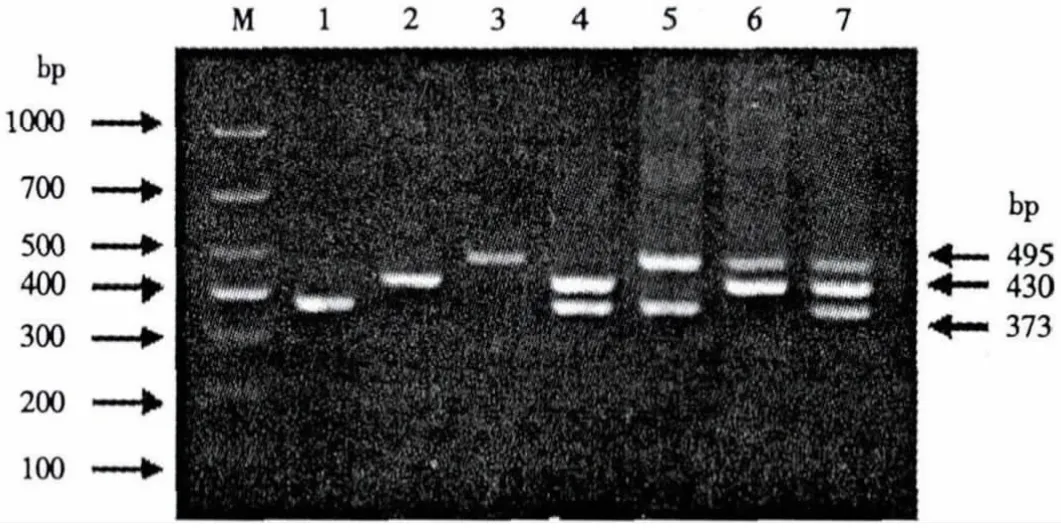
图3 单重PCR和mPCR反应Fig.3 Single PCR and multiple PCR

图4 mPCR特异性试验Fig.4 Specificity of the mPCR for the differentiation
2.4 PCR敏感性试验
利用紫外分光光度计测定PRV、PCV2和PPV质粒的核酸浓度,经过10次重复试验得出PRV、PCV2和 PPV 的质粒核酸浓度分别为161.75、146.94和128.16 ng·μL-1.用灭菌双蒸水进行10倍倍比稀释,取10倍倍比稀释的病毒质粒做模板,分别进行PCR和mPCR,检测其敏感性.结果表明,在PCR反应中,PRV、PCV2 和 PPV 的检测限量分别为 1.62 ×10-6、1.47 ×10-6和 1.28 ×10-6ng;在 mPCR 反应中,PRV、PCV2 和 PPV 的检测限量分别为1.62 ×10-6、1.47 ×10-6和1.28 ×10-4ng(图5-图8).

图5 PRV的PCR敏感性试验Fig.5 Sensitivity of single PCR for PRV
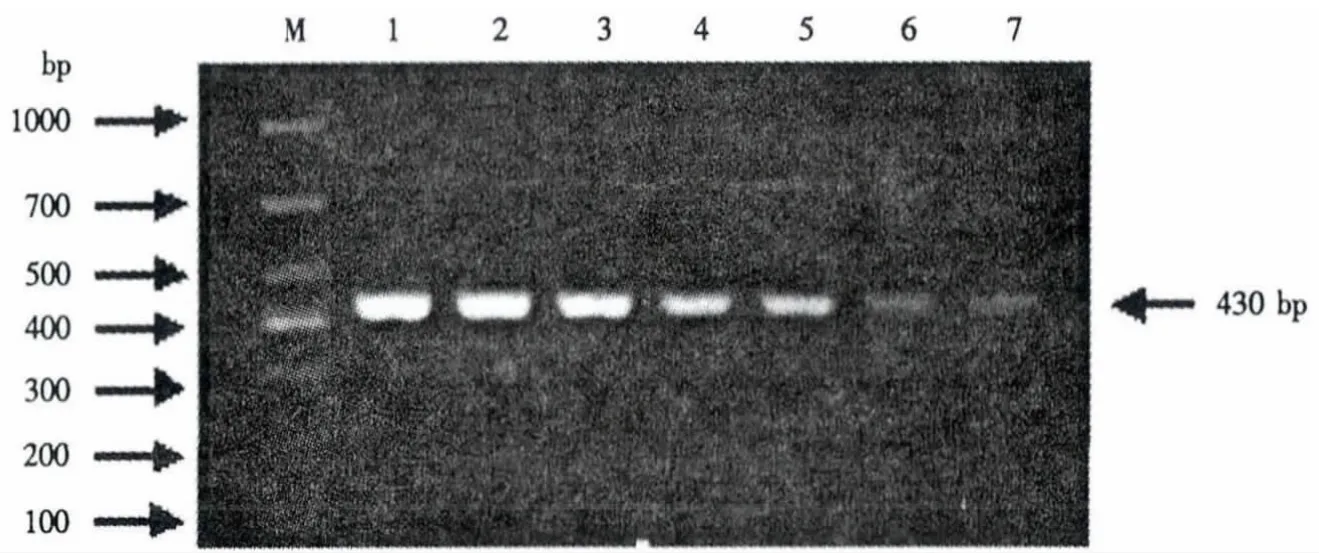
图6 PCV2的PCR敏感性试验Fig.6 Sensitivity of single PCR for PCV2
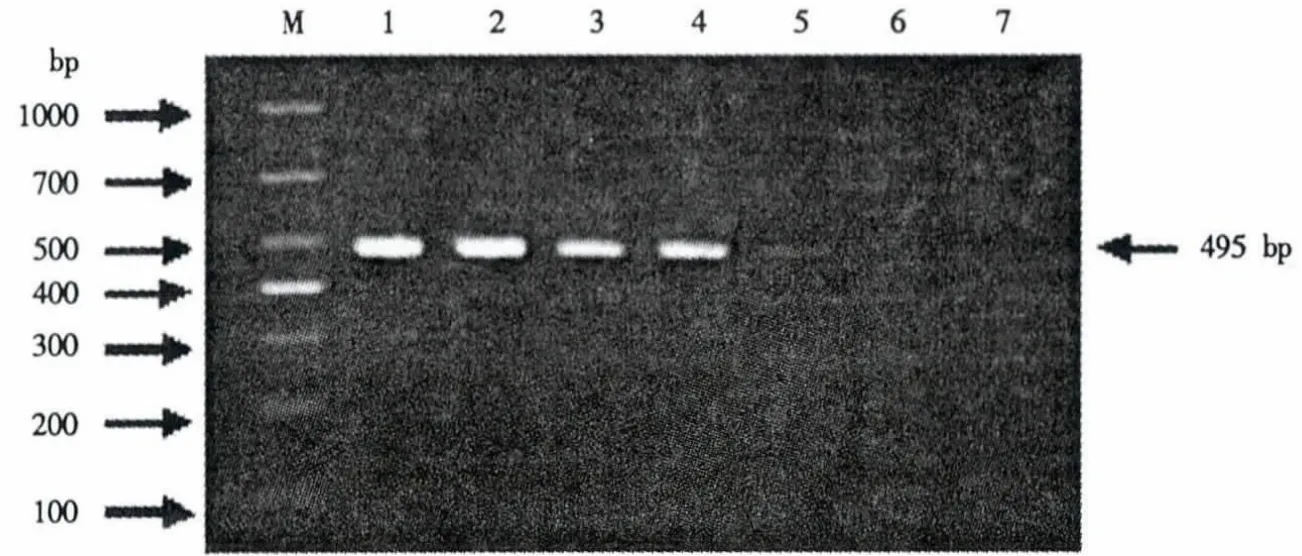
图7 PPV的PCR敏感性试验Fig.7 Sensitivity of single PCR for PPV
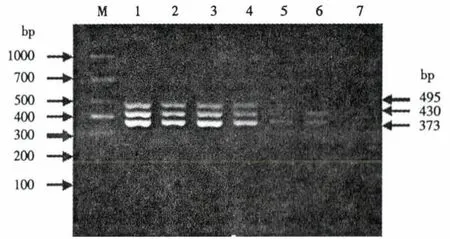
图8 mPCR敏感性试验Fig.8 Sensitivity of mPCR
2.5 单重PCR和mPCR检测结果
收集福建省各地区病料样品18份,分别进行单重PCR检测和mPCR检测,对两种PCR检测方法进行对比(表2).结果表明,在18份临床样品中,通过mPCR方法鉴定有7份PCV2检测出阳性反应,阳性率39%,PRV和PPV均未检出,阴性率为100%;通过单重PCR检测,PCV2检测出7份样品中为阳性反应,阳性率与mPCR的反应结果一致,PPV与mPCR一样均未检出,阴性率为100%,在PRV的检测中,单重PCR检出17份,检出率高达94%,但mPCR检测方法未检出,阳性率为0%.

表2 单重PCR和mPCR样品检测结果Table 2 Detection of virues in clinical samples by single PCR and mPCR
3 讨论
mPCR的反应原理、反应试剂和操作过程与常规普通PCR相同,但在反应过程中,mPCR比单对引物PCR更复杂,高质量的mPCR引物设计是关键[7].目前,运用PCR检测方法检测PRV、PCV2和PPV多采用其保守区域,分别为gB基因、ORF2基因和VP2基因,因此本研究根据这3个保守区域进行引物设计.从Genbank上分别下载了12株PRV gB基因、21株PCV2 ORF2基因和24株PPV VP2基因,在福建省内多以PRV NC006151、PCV2 NC 005148和PPV NC001718为常见病毒,因此以此为模板做设计.本研究在mPCR引物设计过程中,充分考虑到多重PCR引物设计要求,使每个病毒引物长度为18-21 bp,G+C含量为40%-55%,TM值尽量一致,避免引物二聚体及发卡结构.利用Primer Premier 5.0和DNAstar软件对上述病毒基因保守区进行引物设计,选出扩增序列为PRV gB基因(373 bp)、PCV2 ORF2基因(430 bp)和PPV VP2基因(495 bp)的3对引物.将PRV、PCV2和PPV的测序结果与GenBank上收录的序列进行比对,表明扩增片段分别为各自病毒的特异性条带.在对mPCR敏感性进行分析时,为了更准确地测定mPCR反应的敏感性,病毒核酸经10倍倍比稀释进行mPCR反应,结果表明,PRV、PCV2和PPV的核酸检测限量分别为 1.62 ×10-6、1.47 ×10-6和 1.28 ×10-4ng,具有较强的敏感性.mPCR 特异性试验结果表明,双蒸水、PRRSV和CSFV病毒cDNA的扩增结果均为阴性.在临床试验中,与单重PCR做对比,除PRV外,检测结果均与mPCR的检测结果相一致.PRV经单重PCR检测后,凝胶试验结果显示出微弱条带,在的PRV对单重PCR检测极敏感,检测限量为1.62×10-6ng.PRV中的gB片段作为疫苗的使用在临床上检测出微弱的条带并不能证明其为伪狂犬病的感染猪,还需进一步验证.此外,在疫病爆发的猪场,PRV、PCV2和PPV病毒均会有一定量的繁殖,在mPCR检测中,一般有足够的量显示出阳性,因此,猪伪狂犬病、猪圆环病毒2型和猪细小病毒病的mPCR快速诊断方法在临床上具有可行性.
[1]ALLAN G M,MEEHAN D,TODD S,et al.Novel porcine cireoviruses from pigs with wasting disease syndromes[J].Vet Rec,1998(142):467-468.
[2]BARBARA E S,JEFFERY J Z,SYLVIE D'ALLAIRE,et al.猪病学[M].赵德明,张仲秋,沈建忠,译.北京:中国农业大学出版社,2008:313-314.
[3]WELLENBORGG J,STOCKHOFE Z N,BOERSMA W J A.The presence of coinfections in pigs with clinical signs of PMWS in the Netherlands:a case-control study[J].Res Vet Sci,2004(77):177-184.
[4]史岩,秦爱建.猪圆环病毒2型生物学特性与致病特征研究进展[J].扬州大学学报:农业与生命科学版,2010,31(1):10-15.
[5]YUE F X,CUI S J,ZHANG C F,et al.A multiplex PCR for rapid and simuLtaneous detection of porcine circovirus type 2,porcine parvovirus,porcine pseudorabies virus,and porcine reproductive and respiratory syndrome virusin clinical specimens[J].Virus Genes,2009,38(3):392-397.
[6]HIROHITO O,OSAMU T,TAKUYA H,et al.Multiplex PCR and muLtiplex RT-PCR for inclusive detection of major swine DNA and RNA viruses in pigs with multiple infections[J].Journal of Virological Methods,2009,160(1/2):210-214.
[7]王稳,屈武斌,申志,等.利用MPprimer设计引物并优化扩增条件以提高多重PCR效率的实验研究[J].生物化学与生物物理进展,2010,37(3):342-346.
