渗透胁迫对龙眼胚性愈伤组织SOD活性的影响
2014-12-24曾丽兰林玉玲王亚婷赖钟雄
曾丽兰,林玉玲,王亚婷,赖钟雄
(福建农林大学园艺植物生物工程研究所,福建福州350002)
1975年,植物种质离体保存首次被提出,在植物界引起了高度重视[1].根据保存原理的差异可以将离体保存分为限制生长保存和超低温保存.限制生长保存是指通过添加生长延缓剂或抑制剂、提高培养基渗透压、降低温度、改变光照条件、降低气压等条件来限制培养物生长,从而延长继代间隔时间.要提高培养基的渗透压,可以通过添加渗透试剂造成一个渗透势负值,同时产生水分逆境,使植物细胞吸水相对困难,植物组织因缺水而减弱新陈代谢,与此同时植物的细胞壁酶的活性也受到抑制,最终实现延缓生长的目的.目前较为常用的渗透试剂有蔗糖、甘露醇、山梨醇、聚乙二醇等.有研究表明高渗试剂可以起到延缓植物细胞衰老和提高细胞活力的作用.
植物在长期的进化中,自身逐渐形成了一系列应答逆境胁迫的生理、代谢以及防御系统,如植物细胞内自身形成了清除有害的自由基和活性氧的保护酶类系统[2].其中,超氧化物歧化酶(superoxide dismutase,SOD)是清除活性氧反应过程中第一个发挥作用的抗氧化酶,且广泛参与植物体在各种逆境胁迫下的生理生化反应,对抗衰老和抗干旱都起到积极的作用,因此,研究SOD在各种逆境胁迫中发挥的作用具有重大意义.目前,国内外关于SOD对各种逆境胁迫的研究主要有低温、水分、高盐、光照、有毒气体、化学药剂、病害等.
龙眼(Dimocarpus longan Lour.)是我国南方广泛种植的重要热带亚热带果树,目前有关龙眼SOD及其它抗氧化系统相关酶的活性变化的研究已有少量报道,蔡英卿等[3]对不同成熟期龙眼品种及不同器官(根、枝、叶、新梢)中的 SOD 活性进行检测,结果表明,根(65.05 U·g-1)>叶(61.88 U·g-1)> 枝(51.13 U·g-1)>新梢(47.70 U·g-1);许家辉等[4]检测晚熟龙眼果实挂树期的果皮中的H2O2、丙二醛(malondialdehyde,MDA)含量和过氧化物酶(peroxidase,POD)、SOD、过氧化氢酶(catalase,CAT)活性变化,发现SOD活性在整个挂树保鲜期内无显著差异;李惠华等[5]和邵巍等[6]研究龙眼离体胚胎中抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性变化并对同工酶谱进行分析,在龙眼各个阶段胚性培养物中均检测到 APX活性,在后三个阶段酶活性迅速提高,在子叶形胚时酶活性最高;陈义挺等[7-8]研究了NaCl、光和温度胁迫对龙眼胚性愈伤组织谷胱甘肽过氧化物还原酶(glutathione peroxidase,GPX)和POD酶活性的影响,结果表明,随着盐胁迫和光强的不断增强,GPX活性均呈先上升后下降趋势,白光处理的GPX活性均高于绿光,随着温度的不断降低,GPX活性先升高后降低,高温(30℃)或低温(20℃)处理后龙眼体胚发生早期各阶段胚性培养物的POD活性均明显大于对照(25℃),随着胚性细胞的分化,POD活性总体呈下降趋势;林小苹等[9]检测不同光质条件下POD、SOD和CAT的活性变化,结果表明,不同光质对生长有不同效应,蓝光对愈伤组织生长有促进作用,而白光则有抑制作用;林玉玲[10]对龙眼活体胚胎或离体胚胎发生过程中SOD的酶活性变化及同工酶谱的分析研究表明,SOD对胚性细胞的分化以及晚期胚胎发育具有促进作用,但关于渗透胁迫对龙眼SOD保护酶活性的影响尚未见报道.渗透胁迫通常是由干旱、盐渍化和低温造成的,研究表明,SOD在植物抗性中起到最为重要的作用[11-12].为探讨SOD与龙眼抗衰老和抗旱性之间的关系,本研究利用聚乙二醇(polyethylene glycol,PEG)、甘露醇和蔗糖这3种高渗溶液,对龙眼胚性愈伤组织(emryogenic callus,EC)进行模拟干旱胁迫处理,研究在不同渗透胁迫下龙眼胚性愈伤组织中SOD的变化,以期找到龙眼在离体保存过程中有关延缓生长,延长继代时间的方法,还可以为研究龙眼抗干旱渗透胁迫的响应机制提供参考.
1 材料与方法
1.1 材料
本试验材料为福建农林大学亚热带果树研究所长期继代保存的龙眼“红核子”品种胚性愈伤组织LC2细胞系[13].继代保持采用 MS+2,4-D 1.0 mg·L-1+蔗糖20 g·L-1(简称 M1 培养基)和 MS+2,4-D 1.0 mg·L-1+KT 0.5 mg·L-1+AgNO30.5 mg·L-1+蔗糖 20 g·L-1(简称 M2 培养基)两种培养基交替培养[13-14].
1.2 方法
1.2.1 龙眼胚性愈伤组织的胁迫处理 取M1培养基上继代20 d并生长良好的红核子龙眼胚性愈伤组织,分别放入 PEG(0、10、20、30 g·L-1)、甘露醇(0、20、30、40、60、80、100 g·L-1)和蔗糖(0、20、30、50、70、90 g·L-1)的MS液体培养基中,摇床中振荡培养24 h(25℃,150 r·min-1),后放于滤纸上晾干,液氮速冻储存于-80℃超低温冰箱,供测试.
1.2.2 渗透胁迫下龙眼胚性愈伤组织SOD酶活性变化的测定 采用氮蓝四唑(nitro-blue tetrazolium,NBT)还原法[15],用0.05 mol·L-1磷酸缓冲液(pH 7.8)提取,4 ℃下离心20 min(10000 r·min-1),上清液为SOD粗提液,然后进行还原反应,将各显色反应体系在4000 lx日光灯下反应20 min(各管受光一致).反应结束后,以不照光的对照管做空白,用Cary 50型紫外光光度计在560 nm处比色测定.活力单位以抑制NBT光化学还原50%作为一个酶活性单位(U),用(U·g-1)表示,3次重复.
结果按下式进行计算:

式中:VT表示样品液总体积(mL);VS表示测定时样品用量(mL);W表示愈伤组织鲜质量(g);Ack表示照光对照管吸光度;AE表示样品管吸光度.
1.2.3 数据处理 试验数据采用 Excel 2003和DPS数据处理软件处理.
2 结果与分析
2.1 PEG胁迫下龙眼胚性愈伤组织的SOD活性变化
PEG是一种高分子渗透剂,能够迅速夺取水分从而对植物造成渗透胁迫.试验以龙眼胚性愈伤组织为材料,测定不同含量PEG对龙眼胚性愈伤组织SOD活性的影响,结果见表1.从表1可以看出,经10和20 g·L-1PEG处理,SOD活性上升,而在30 g·L-1PEG处理下SOD活性呈下降趋势,且变化显著.10 g·L-1PEG处理的SOD活性极显著高于对照,20 g·L-1PEG处理的SOD活性也极显著高于10 g·L-1PEG处理组,30 g·L-1PEG处理的SOD活性呈下降趋势,且极显著低于20 g·L-1PEG,说明PEG胁迫的进程较快,PEG溶于水后立即产生较高的渗透压,引起细胞内活性氧积累,激发植物细胞内SOD酶系统的保护能力,所以PEG胁迫导致植物细胞的SOD活性迅速升高,随着自由基急剧增加,对抗氧化酶系统造成伤害,导致SOD活性显著下降.

表1 不同PEG胁迫处理对龙眼EC的SOD活性变化的影响Table 1 Effects of PEG stress on SOD activities in the embryogenic callus of longan
2.2 甘露醇渗透胁迫下龙眼胚性愈伤组织的SOD活性变化
甘露醇的作用机理是降低细胞膨压,提高培养基的渗透势负值,造成水分逆境.试验以龙眼胚性愈伤组织为材料,测定不同浓度甘露醇胁迫处理下的龙眼胚性愈伤组织的SOD活性变化,试验结果见表2.由表2可以看出,随着甘露醇浓度的不断升高(20-80 g·L-1),龙眼胚性愈伤组织中的SOD活性不断升高,且一直维持在一个较高的水平上,说明胁迫处理下细胞中SOD活性被诱导升高,直到浓度高达100 g·L-1时才开始呈现缓慢下降的趋势,这可能是由于高浓度处理超出了细胞的生理耐受和反应极限,破坏了正常细胞生理活动引起的.20 g·L-1甘露醇的SOD活性极显著高于对照,浓度在20-30 g·L-1之间的SOD活性上升缓慢,40 g·L-1的SOD活性极显著高于20 g·L-1,浓度在40-60 g·L-1之间的SOD活性上升也较缓慢,的SOD活性极显著高于20 g·L-1的,且能使其SOD活性维持在一个较高的水平上,在峰值 80 g·L-1时的 SOD 活性达到140.07 U·g-1,比 PEG 胁迫达到的峰值134.63 U·g-1高,说明高浓度的甘露醇可以有效增强龙眼胚性愈伤组织的SOD活性.

表2 不同甘露醇胁迫处理对龙眼EC的SOD活性变化的影响Table 2 Effects of mannitol stress on SOD activities in the embryogenic callus of longan
2.3 蔗糖渗透胁迫下龙眼胚性愈伤组织的SOD活性变化
蔗糖既是植物组织培养中的最主要碳源,也是重要的渗透调节物质.试验以龙眼胚性愈伤组织为材料,测定不同浓度蔗糖胁迫处理下的龙眼胚性愈伤组织的SOD活性变化(以20 g·L-1蔗糖为对照),试验结果见表3.由表3可以看出,随着蔗糖浓度的升高,20-50 g·L-1浓度的蔗糖处理下,龙眼胚性愈伤组织中的SOD活性不断升高,50 g·L-1后开始下降,70-90 g·L-1的蔗糖处理下,SOD活性下降缓慢.30 g·L-1蔗糖处理的SOD活性极显著高于20 g·L-1处理和对照,50 g·L-1蔗糖处理的SOD活性极显著高于20 g·L-1的处理,可能是由于当渗透胁迫达到一定程度,SOD活性耐旱机制形成,有效地清除龙眼胚性愈伤组织内多余的活性氧;50 g·L-1蔗糖处理后SOD活性开始下降,70-90 g·L-1处理的SOD活性下降缓慢,说明随胁迫浓度的升高,“红核子”龙眼胚性愈伤组织内活性氧产生与清除的平衡关系被打破,“红核子”龙眼胚性愈伤组织内活性氧的积累在一定程度上抑制了SOD活性.蔗糖浓度50 g·L-1时的SOD活性达到峰值140.39 U·g-1,比PEG胁迫达到的峰值134.63 U·g-1高,说明高浓度的蔗糖可以增强龙眼胚性愈伤组织的SOD活性.
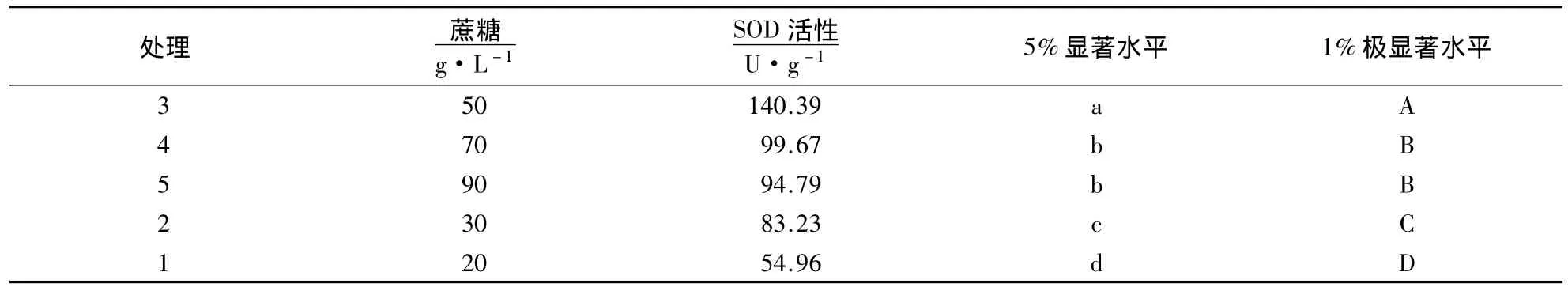
表3 不同浓度蔗糖胁迫处理对龙眼EC的SOD活性变化的影响Table 3 Effects of sucrose stress on SOD activities in the embryogenic callus of longan
3 讨论
3.1 甘露醇和蔗糖可以有效提高植物细胞活力
甘露醇的作用机理是降低细胞膨压,提高培养基的渗透势负值,造成水分逆境,使水分和养分吸收受阻,减少营养消耗[16].高浓度的蔗糖也会形成高渗透压环境,抑制细胞对培养基中其他营养物质的吸收.
本研究中随着甘露醇和蔗糖浓度的不断升高,龙眼胚性愈伤组织中的SOD活性不断升高,且维持在一个较高水平上,但当甘露醇浓度达到100 g·L-1时,SOD活性开始呈现缓慢下降的趋势;当蔗糖浓度升高到70 g·L-1时,SOD活性呈缓慢下降趋势.查向东等[17]的研究也表明,甘露醇处理下的叶片细胞SOD活性被诱导增强.
甘露醇与植物的抗逆性有关,将甘露醇合成酶转入烟草,有利于提高植株对高盐的耐受性,甘露醇作为一种重要的多元醇,还可直接清除·OH抵抗氧化反应[18],说明甘露醇也是一种活性氧清除剂[19,20].
在植物离体保存研究中,常利用甘露醇和蔗糖来延缓细胞衰老,以达到延长继代时间的目的.但是不同植物培养物保存所需要渗透压并不相同,研究表明,试管苗保存时间以及恢复生长率受培养基中高渗物质含量影响的变化趋势基本都呈抛物线型.Divakaran et al[21]将香草在MS+15 g·L-1蔗糖+15 g·L-1甘露醇培养基上进行保存,每年只需要继代1次.李黛等[22]将淡黄花百合在MS培养基(含1%-3%甘露醇)中进行保存,保存10个月的组培苗仍然具有92%存活率,而其存活的组培苗100%可以正常地生长和增殖.叶炜[23]、林秀莲[24]和徐清锋[25]研究表明,甘露醇对质膜系统有一定的保护作用,较高浓度的甘露醇处理可使龙眼胚性愈伤组织的SOD活性升高,但考虑延缓衰老和正常生长,均在培养基中加入20 g·L-1甘露醇.
本试验中在甘露醇和蔗糖胁迫下的SOD活性达到的最高值大于PEG胁迫下的最高值,且SOD活性的下降速度较缓慢,而PEG的胁迫进程太快,先迅速升高后迅速下降.徐清锋[25]比较不同浓度PEG对龙眼离体的保存效果,结果表明,PEG不能延长其保存时间,且非常不利于材料生长.龙眼胚性愈伤组织继代培养中,高浓度蔗糖同样能够提供很高的渗透压,但其抑制衰老的作用却较甘露醇相距甚远.林秀莲[24]的研究表明,50 g·L-1的蔗糖最有利于龙眼胚性愈伤组织的继代保存。本研究表明,蔗糖为50 g·L-1时,SOD活性最高,细胞活力也最高.
甘露醇和蔗糖虽然在提高植物细胞活力和延缓细胞衰老上起到一定作用,但是在植物的离体保存研究中,由于不同植物培养物保存所需要渗透压并不相同,因材料而异,甘露醇和蔗糖的浓度都应控制在一定范围内,才能保证材料正常生长、延长继代时间.
3.2 渗透胁迫下龙眼胚性愈伤组织SOD的响应机制
SOD作为植物体内抗氧化系统的第一道防线,可以作为植物细胞的抗旱指标.在植物抗旱性的研究中,PEG、甘露醇和蔗糖等高渗溶液模拟干旱胁迫处理是作物抗旱性室内鉴定的常用方法[26-27].
本试验对龙眼愈伤组织进行不同PEG含量的水分胁迫处理,结果表明,SOD活性在轻度、中度胁迫时上升,严重胁迫时呈下降趋势.目前,众多学者研究了PEG胁迫对不同植物SOD活性的影响,石永红等[28]、张卫华等[29]、王胤等[30]、许桂芳[31]等的研究表明,在 PEG 胁迫下,植物细胞中 SOD 活性呈先升高后下降的趋势,与本研究结果一致,说明胁迫处理引起细胞内活性氧积累,激发了植物细胞内SOD酶系统的保护能力,导致SOD活性显著升高,随着胁迫的加深,逐渐超过保护酶系统的清除能力,高浓度的PEG胁迫可能对抗氧化酶系统造成伤害,导致SOD活性呈现不断下降趋势.
PEG是一种高分子渗透剂,能够迅速夺取水分对植物造成渗透胁迫[27,32-33],甘露醇、蔗糖和PEG胁迫一样都能使植物细胞处于一种渗透胁迫中,但是PEG胁迫的进程较快,PEG溶于水后立即能产生强大的渗透压,所以PEG胁迫中植物细胞中的SOD活性能迅速升高,但是随着自由基的急剧增加,对抗氧化酶系统造成伤害,因此在30%PEG胁迫处理下其SOD活性大幅度下降,徐清锋[25]的研究表明,PEG无法延长其保存时间,不利于材料生长.
本试验结果表明,甘露醇(20-80 g·L-1)处理的龙眼胚性愈伤组织中的SOD活性维持在较高水平,蔗糖(20-50 g·L-1)处理的龙眼胚性愈伤组织中的SOD活性也维持在较高水平.说明甘露醇和蔗糖胁迫处理下,细胞中SOD活性显著被诱导增加.王娟等[34]用外源甘露醇和蔗糖处理水分胁迫下的玉米根系,结果表明,甘露醇和蔗糖可显著促进SOD活性,在4种有机溶质(甘露醇、蔗糖、甜菜碱、脯氨酸)中,甘露醇对酶活性的促进作用最为显著,蔗糖次之,而且甘露醇和蔗糖处理过的玉米根系,在几天连续的干旱胁迫下,SOD活性下降缓慢,SOD活性变化趋势与本研究结果一致.在渗透胁迫下,植物的普遍响应机制是通过积累相溶性溶质进行渗透调节[35],因为甘露醇和蔗糖均属于细胞相溶性物质,外施适当浓度的甘露醇和蔗糖有利于减少自由基对膜系统的损伤.耐旱植物与甜土植物的显著差异即前者积累溶质的能力强,因此可通过外施相溶性物质来提高植物的耐旱性,细胞相溶性物质在细胞低渗透势的条件下可以作为渗透调节物质,降低渗透势.本研究结果进一步说明细胞相溶性物质可提高干旱条件下细胞清除活性氧自由基的能力,使植物的保护酶活性增加,减少自由基对膜系统的损伤,提高植物的抗渗透能力.
[1]VILLALOBOS V,ENGELMANN F.Ex situ conservation of plant germplasm using biotechnology[J].World Journal of Microbiology and Biotechnology,1995,11(4):375-382.
[2]马旭俊,朱大海.植物超氧化物歧化酶(SOD)的研究进展[J].遗传,2003,25(2):225-231.
[3]蔡英卿,赖钟雄,徐丽珠,等.龙眼各营养器官SOD活性的测定分析[J].河北林果研究,2006,21(4):426-431.
[4]许家辉,东余,许玲,等.晚熟龙眼果实挂树期果皮活性氧代谢及抗氧化酶活性[J].热带作物学报,2009,30(6):725-729.
[5]李惠华,赖钟雄.龙眼体胚发生过程中抗坏血酸过氧化物酶活性的变化[J].亚热带植物科学,2006,35(3):9-11.
[6]邵巍,赖钟雄,赖呈纯,等.龙眼胚性培养物APX同工酶的分析方法建立及其在龙眼体胚发生过程中的变化[J].福建农林大学学报:自然科学版,2008,37(2):140-144.
[7]陈义挺,赖钟雄,李焕苓,等.NaCl、光和温度胁迫对龙眼胚性愈伤组织GPX酶活性的影响[J].中国农学通报,2009,25(7):149-153.
[8]陈义挺,赖钟雄,林玉玲,等.温度对龙眼体胚发生早期POD活性及同工酶的影响[J].中国农学通报,2009,25(9):32-37.
[9]林小苹,赖钟雄,黄浅.不同光质对龙眼胚性愈伤组织生长和细胞膜保护酶活性的影响[J].福建农林大学学报:自然科学版,2008,37(3):253-256.
[10]林玉玲.龙眼体胚发生过程中SOD基因家族的克隆及表达调控研究[D].福州:福建农林大学,2011.
[11]董润润,刘静.自由基、活性氧、SOD及植物衰老机理研究的现状与进展[J].濮阳职业技术学院学报,2005,5(2):23-24.
[12]SMIRNOFF N.Plant resistance to environmental stress[J].Current Opinion in Biotechnology,1998,9(2):214-219.
[13]赖钟雄,潘良镇,陈振光.龙眼胚性细胞系的建立与保持[J].福建农业大学学报,1997,26(2):160-167.
[14]赖钟雄,陈舂玲,黄素华,等.龙眼胚性愈伤组织的长期继代与染色体数目变异[J].福建农业大学学报,2001,30(1):29-32.
[15]朱广廉,钟海文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990:254-255.
[16]王晨,师校欣,杜国强,等.培养基渗透压对延缓生长的苹果组培苗生理代谢指标影响[J].植物生理科学,2008,24(6):222-225.
[17]查向东,肖亚中,郭振,等.玉米及马齿苋叶片SOD活性诱导研究[J].生物学杂志,2003,20(1):27-29.
[18]SHEN B,JENSEN R G,BOHNERT H J.Mannitol protects against oxidation by hydroxyl radicals[J].Plant Physiology,1997,115(2):527-532.
[19]陈文利,徐朗莱.盐胁迫下两品种大麦叶片H2O2累积及其清除酶活性的变化[J].南京农业大学学报,1998,22(2):97-100.
[20]郭振飞,樊剑鸣.照光对玉米黄化幼苗超氧物歧化酶活性的影响[J].植物生理学报,1997,23(3):279-282.
[21]DIVAKARAN M,NIRMAL B M,PETER K V.Conservation of vanilla species,in vitro[J].Scientia Horticulturae,2006,110(2):175-180.
[22]李黛,曾艳玲,魏福伦.淡黄花百合的离体保存[J].贵阳学院学报:自然科学版,2006,1(3):45-47.
[23]叶炜.福建龙眼种质资源离体保存初步研究[D].福州:福建农林大学,2006.
[24]林秀莲.龙眼胚性愈伤组织限制生长保存及其遗传机理的研究[D].福州:福建农林大学,2009.
[25]徐清锋.龙眼体胚发生系统的优化及其在种质保存与遗传转化上的应用[D].福州:福建农林大学,2010.
[26]BOUSLAMA M,SCHAPAUGH W.Stress tolerance in soybeans I.Evaluation of three screening techniques for heat and drought tolerance[J].Crop Science,1984,24(5):933-937.
[27]RAVIKUMAR R,PATIL B,SALIMATH P.Drought tolerance in sorghum by pollen selection using osmotic stress[J].Euphytica,2003,133(3):371-376.
[28]石永红,万里强,刘建宁,等.干旱胁迫对6个坪用多年生黑麦草品种抗旱性的影响[J].草地学报,2009,17(1):52-57.
[29]张卫华,张方秋,张守攻,等.马占相思抗旱性生理指标的选择研究[J].中南林学院学报,2005,25(6):56-59.
[30]王胤,姚瑞玲,梁厚宽,等.渗透胁迫对青钱柳MDA含量及SOD活性的影响[J].广西林业科学,2007,36(3):132-136.
[31]许桂芳.PEG胁迫对2种过路黄抗性生理生化指标的影响[J].草业学报,2008,17(1):66-70.
[32]ATREE S M,FOWKE L C.Embryogeny of gymnosperms:advances in synthetic seed technology of conifers[J].Plant Cell,Tissue and Organ Culture,1993,35(1):1-35.
[33]景蕊莲,昌小平.用渗透胁迫鉴定小麦种子萌发期抗旱性的方法分析[J].植物遗传资源学报,2003,4(4):292-296.
[34]王娟,李德全.细胞相容性溶质对水分胁迫下玉米根系SOD活性的促进作用[J].西北植物学报,2002,22(6):1312-1317.
[35]谢宗铭,董永梅,陈受宜.高等植物非生物胁迫适应的分子生理机制[J].安徽农业科学,2008,38(19):7996-7999.
