胎儿染色体非整倍体产前筛查进展
2014-12-24黄赛琼宋亦军刘俊涛
黄赛琼,宋亦军,刘俊涛
(中国医学科学院,北京协和医学院,北京协和医院妇产科,北京 100730)
过去30年里,胎儿染色体非整倍体产前筛查从单纯的孕妇年龄筛查到不同模式的母血清学筛查,检出率和准确度均逐渐提高。最近,随着基因测序和生物信息领域的进展,出现了检出率和准确度近似于产前诊断的无创产前检测方法(noninvasive prenatal testing,NIPT)。认识胎儿非整倍体检测的历史进展和近几十年分子生物学和生物信息学的进步,能更好地理解NIPT 及这一新方法在分子水平的应用前景。
一、传统的血清学筛查进展
1984年,Markatz 等[1]发现母血清甲胎蛋白(alpha-fetoprotein,AFP)降低与胎儿21三体、18三体等常染色体异常相关。同年Cuckle等[2]证实结合年龄和中孕期母血清AFP 的产前筛查方法对唐氏 综 合 征(Down’s syndrome,DS)的 检 出 率 为40%,假阳性率5%。之后Bogart等[3]报道孕育DS胎儿孕妇中孕期血清人绒毛膜促性腺激素β(human chorionic gonadotropinβ,βHCG)水平升高,非结合雌激素(unconjugated estriol,uE3)水平降低。1988年,Wald等[4]首先提出联合中孕期血清指标βHCG、AFP、uE3和孕妇年龄的筛查模式,将DS检出率提高到61%。胎儿非整倍体筛查进入多项孕妇血清标志物联合筛查的新纪元,并先后提出了中孕期筛查、早孕期筛查、早中孕期联合筛查的模式。
1.中孕期血清学筛查:中孕期血清学筛查包括二联(AFP+βHCG)筛查、三联(AFP+βHCG+uE3)筛查、四联[AFP+βHCG+uE3+Inh A(inhibin A))筛查。血清尿超声筛查研究(the serum,urine and ultrasound screening study,SURUSS)采用前瞻性多中心方法,纳入47 053例孕14~20周妊娠妇女,其中包括101例DS胎儿,以1:300为危险切割值进行筛查。研究结果显示,假阳性率为5%时,二联、三联、四联筛查DS 检出率分别为71%、77%、81%[5]。
目前临床中,中孕期血清学筛查指标也用于18三体的筛查。T18 胎儿母血清AFP、uE3和HCG 水平均降低:AFP≤0.75MoM(中位数倍数),HCG≤0.60MoM 和E3≤0.55MoM。Canick 等[6]采用固定切割值的计算方法,中孕期三联筛查模式可检出60%的T18胎儿,假阳性率0.4%。由于孕妇年龄和常染色体三体的发病率相关性不确切,不能合并到T18风险评估中,Palomaki等[7]通过似然比校正年龄风险计算每个孕妇孕育T18胎儿的风险,设定切割值为1:100时,T18检出率60%,假阳性率0.2%。事实上,两种方法的检出率和假阳性率变化比理论上变化还大。T18胎儿母血清Inh A水平比正常胎儿母血清约低25%[8],但相关文献较少。
另外,中孕期血清学筛查DS、T18高风险的部分胎儿染色体核型可能提示45,XO,以及性染色体三倍体等。目前有研究证实伴水肿或水囊瘤45,XO 胎儿的母血清AFP、uE3水平降低,βHCG 水平升高,不伴水肿的45,XO 胎儿母血清HCG 和inhibin A 水平降低[9-10];这与T21、T18 高危孕妇血清学变化相似。三倍体胎儿孕妇血清βHCG 水平可明显升高或降低,uE3水平降低,AFP 水平可升高或降低[10]。
血清学筛查结果受多胎妊娠,孕周不准确,或双胎之一胚胎停育影响。中孕期血清学筛查局限性是孕妇必须等到15 周后才可进行,故得知胎儿DS、T18异常的风险后无法进行早期干预。为了更早发现及干预DS、T18高风险胎儿,国际血清学筛查研究转向早孕期筛查。
2.早孕期血清学筛查:早孕期血清学筛查指标包括妊娠相关血浆蛋白A(pregnancy-associated plasma protein A,PAPP-A)和βHCG。早孕期DS胎儿母血清PAPP-A 水平降低,βHCG 水平升高;T18胎儿母血清PAPP-A 和β HCG 水平均降低。Brambati等[11]首先提出联合β HCG、PAPP-A 和孕妇年龄进行早孕期血清学筛查,孕8~12 周DS检出 率78.9%。Noble 等[12]发 现 早 孕 期 血 清β HCG 和胎儿颈项透明层(nuchal translucency,NT)是DS筛查的独立指标,将NT 引入早孕期血清筛查。NT 联合βHCG 的早孕期筛查模式的DS检出率85%,假阳性率5%。两年后有研究提出联合β HCG、PAPP-A、NT 和孕妇年龄的早孕期联合筛查模式。Wapner等[13]对8 514例10+4~13+6周孕妇进行多中心早孕期联合筛查,DS检出率78.7%,假阳性率5%,T18 检出率90.9%,假阳性率2%,证实早孕期联合筛查可用于临床。另外,多项前瞻性研究[5,13-15]发现假阳性率为5%时,早孕期联合筛查DS 检出率78.7%~85%,较中孕期检出率高。Avgidou等[14]前瞻性研究报道孕11~13+6周的早孕期联合筛查假阳性率7.5%时,可检出92.3%T18,88.9%T13,84.2%45,X 和86.1%其它染色体异常。
早孕期筛查最主要的优势是早发现、早诊断、早干预,早期终止妊娠相对于中期引产更安全;还可以减少孕妇及家属的焦虑。但是部分早孕期筛查提示的DS胎儿在中孕期筛查前自然流产,因此可能增加了不必要的人工流产术。绒毛染色体核型分析可能出现嵌合体,需要等到中孕期羊膜腔穿刺才确诊是否为限制性胎盘染色体嵌合。此外,NT 筛查的准确性受胎位、医师的经验和技术等多种因素的影响,NT 的准确性和可重复性较血清学指标差[16]。
3.早中孕期联合筛查:早中孕期联合筛查模式的检出率均较单纯早孕期或中孕期筛查高。早中孕期联合筛查模式包括序贯筛查(sequential screening,SS)、整合筛查(integrated screening,IS)、酌情筛查(contingency screening,CS),详见表1和表2。Malone等[17]的研究发现CS是最佳的早中孕期联合筛查模式;当CS假阳性率为4.3%时,DS检出率为93%;CS 早孕期DS 检出率为65.1%(1.5%孕妇需进行绒毛活检);CS 中孕期DS 检出率为27.9%(2.8%孕妇需进行羊膜腔穿刺)。
临床实践中,不同类型的早中孕期联合筛查模式各有优缺点。独立序贯筛查分别报告筛查结果,Malone等[15]报道其假阳性率11%和检出率94%,均较高,准确性降低,故不推荐使用。阶段序贯筛查假阳性率4.9%低于独立序贯筛查[17],但早孕期低危孕妇由于费用等原因可能选择终止筛查。完全整合筛查假阳性率4.0%较阶段序贯筛查更低[15],但孕妇均需等到中孕期得知筛查结果;大多数早孕期低危患者不能从中孕期筛查获益;早孕期高危孕妇不能早期诊断、早期干预。一方面,NT 的测量准确度依赖于超声科医师的技术水平;另一方面,相同假阳性率情况下整合血清学筛查检出率低于完全整合筛查,高于早孕期筛查、中孕期筛查。NT 测量水平有限的单位,可以选择整合血清学筛查方法。酌情筛查是效价比最高的模式[17],但是对于绒毛活检(CVS)不成熟的医疗机构,整合筛查是最佳选择。
二、NIPT 在产前筛查领域的研究进展
1.NIPT 的发现及临床应用:1997年,Lo等[18]通过聚合酶联反应(PCR)扩增得到母体外周血中Y染色体的特异性DNA 序列,从而证明怀有男性胎儿的母血浆中存在胎儿游离DNA(cell free fetal DNA,cffDNA)。cffDNA 几乎全部来源于胎盘滋养层细胞,DNA 片段相当小,约150bp。最早可孕5周在母血浆内测到cffDNA,孕7周胎儿胎盘循环建立后,cffDNA 即以一定的比例稳定存在于母体外周血中,并随着孕周的增大而增多,约5%~30%。游离DNA 半衰期仅为16.3 min,分娩2h后母血中的cffDNA 即完全降解。早在2006年,有研究报道可用等位基因比方法从母体血浆检测胎儿染色体非整倍体。此后,出现了许多基于DNA、RNA 等位基因的不同方法。同样也出现了多种分析方法如数字PCR、质谱分析法。但由于这些技术均存在局限性而未能广泛应用。2008 年,Chiu等[19]首次报道用大规模平 行测序(massively parallel sequencing,MPS)技术平台检测胎儿非整倍体,使cff DNA大规模用于临床产前检测。2011 年首个独立的多中心NIPT 临床研究[20]采用盲法验证,病例对照方法,从27个中心入组4 600多例胎儿非整倍体高危的孕妇(高龄,血清学筛查阳性,超声结果提示非整倍体,个人或家族非整倍体史,家族罗伯逊易位)。未经校正的测序数据显示DS检测率98.6%(209/212),假 阳 性率0.20%(2/1 471)。应 用 腺 苷 标 准 化 修 正(a correction for GC normalization and repeat masking)后,DS的灵敏度99.1%(210/212),特异性99.9%。同时该报道评估了使用MPS 进行DS 无创检测的测试性能,0.8%样 本 测 试 失 败。随 后 多 项 研 究[21-23]证 实NIPT 用 于21 三 体、18 三 体、13 三 体 产 前 筛 查 有良好的临床有效性(表3)。

表1 早中孕期联合筛查模式分类[15,17]
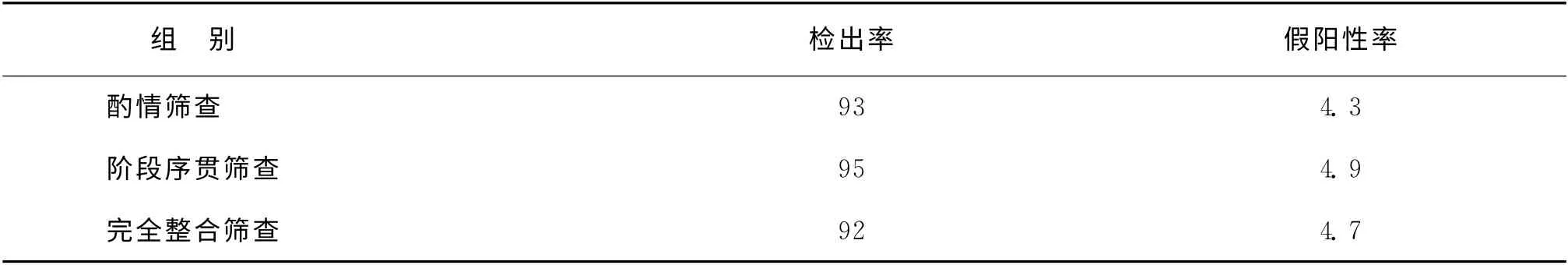
表2 不同早中孕联合筛查模式筛查效率比较[17](%)
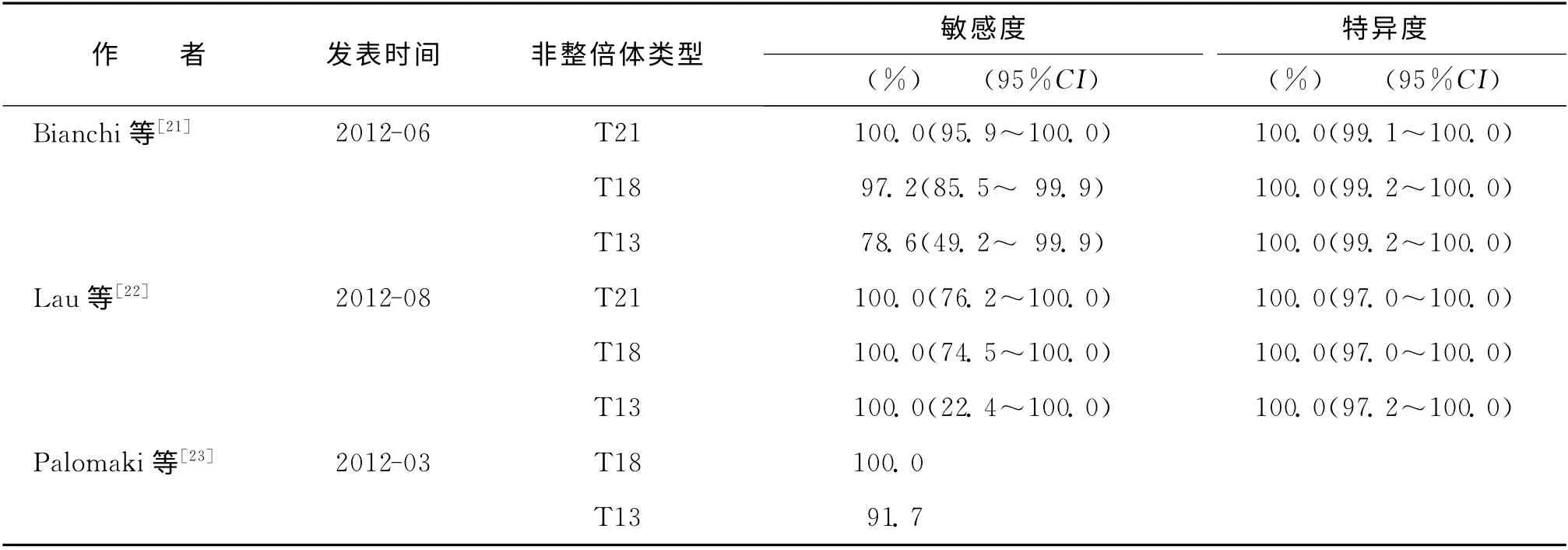
表3 T21、T18、T13的NIPT 筛查效率
另外,部分研究组用目标区域扩增测序法检测目标染色体(12、18、13、X、Y)。根据是否基于单核苷 酸 多 态 性(single nucleotide polymorphism,SNP),目标区域扩增测序法被分为两类。Norton等[24]进行前瞻性多中心队列研究并证实用DANSR(digital analysis of selected regions)方 法 和FORTE(fetal-fraction optimized risk of trisomy evaluation)方法进行风险评估,DS检测灵敏度和特异度分别为100%和99.97%,T18检测的灵敏度和特异度分别为97.4%和99.93%。另一类基于SNP的目标区域扩增法是通过多重PCR 技术扩增13、18、21、X 和Y 染色体上的SNP 位点后高通量测序扩增片段来获得母体和胎儿的基因型及等位基因频率信息。Zimmermann 等[25]用这种目标区域扩增法检测166例样本,检出全部非整倍体病例(包括2例T13,3例T18,11例T21,2例45,XO,2例47,XXY)。它潜在的优势是能减少大量无用信息,提高检测的效率及灵敏度。但目前尚无大规模临床研究结果。由于当时已经发表的研究仅限于非整倍体高危人群,所以2012年国际产前诊断学会(International Society for Prenatal Diagnosis,ISPD),美国妇产科学会(The American College of Obstetricians and Gynecologists,ACOG)与美国母胎医学会(The Society for Maternal-Fetal Medicine,SMFM),中国产前诊断技术专家组均只建议T21、T18、T13高危孕妇进行NIPT 检测[26-28]。但之后Song等[29]和Faibrother等[30]研究分别比较了低龄人群中孕期血清学筛查,早孕期联合筛查与NIPT的筛查效率,均证实NIPT 的假阳性率更低,可明显减少侵入性产前诊断,同时减少操作相关的不良后果。考虑到NIPT 昂贵的筛查费用,美国把NIPT作为二线筛查方案用于早孕期或中孕期筛查阳性孕妇,但这种筛查模式不能改善假阴性率,可能漏诊10%~15%DS[31]。边旭明[32]在国内外临床专家讨论的基础上,总结了NIPT 在产前筛查/产前诊断体系里5种可能的模式供选择。(表4)。

表4 无创DNA 产前检测的几种不同临床路径[32]
2.NIPT 的局限性及相关研究:NIPT 的局限性包括:(1)目前筛查目标疾病仅针对21 三体、18三体、13三体;(2)以下因素均可以通过cff DNA浓度影响NIPT 结果的准确性:孕妇体重、孕周、非整倍体类型、多胎妊娠、嵌合体;(3)限制性胎盘嵌合体、孕妇本人嵌合体、双胎之一胎死宫内或胚胎停育,或者孕妇本人患恶性肿瘤疾病等均可影响NIPT 阳性结果与染色体核型的一致性。针对NIPT 的局限性,一些研究分析了可能的原因,并报道了与其相关的新进展。
关于孕妇体重指数肥胖孕妇cff DNA 浓度降低,可能与增加的循环血量稀释cff DNA 有关[33];游离DNA 总量随体重指数按比例增加,而cff DNA不增加,即相当于cff DNA 浓度降低[34]。
关于胎儿非整倍体类型与染色体核型正常胎儿游离DNA 比较,T21 胎儿游离DNA 浓度增加,T18、T13、45,XO 则减少[35]。
关于多胎妊娠NIPT 检出所有非整倍体胎儿,DS中位Z值为12.3[36],如果双胎染色体核型一致则非整倍体Z值应该与cff DNA 呈线性相关,处理方法同单胎妊娠;因为cff DNA 含量不是翻倍,如果双胎非整部体核型不一致,则多胎妊娠每个胎儿的游离DNA 浓度减少,其中大约10%~15%病例游离DNA 浓度低于4%,可能导致假阴性结果。因此,香港中文大学研究组通过专有算法识别孕妇和胎儿序列不同的基因区域[37]来快速确认双合子双胎,并进一步计算评估双合子双胎的每个胎儿的游离DNA 浓度是否足够[38]。
关于性染色体起初MPS检测常染色体非整倍体胎儿的研究发现性染色体非整部体的检出率较低[21]。这可能与X 染色体GC 含量导致的测序偏移,X、Y 染色体标记序列相似,Y 染色体偏小,孕妇或胎儿嵌合体有关[39]。采用染色体核型和NIPT同时检测试验模板中的1 546例样本的性染色体异常,总敏感度100%(95%CI 82.3%~100%),假阳性率0.1%(95%CI 0%~0.3%),失败率6%(95%CI4.9%~7.4%)。在单盲试验设计中,这种方法的敏感度96.2%(95%CI 78.4%~99.8%),假阳性率0.3%(95%CI 0%~1.8%),检测失败率5%(95%CI 3.2%~7.7%)。191 例染色体核型为女性的样本中MSP检测结果4例男性,1例45X 假阳性,1例45X 假阴性,185例检测准确(167例XX,17例XO,1例XXX),199例男性样本中1例检测为女性,其他样本NIPT 结果与染色体核型一致为(191例XY,5 例XXY,2 例XYY)。Guex等[40]用改良的方法处理性染色体GC 序列偏移;有文献[41]报道,用SNP 分析性染色体避开X 染色体的生物学特性来改善NIPT 性染色非整倍体检出率。
3.NIPT 的展望:在相当短的时间里,已经利用cff DNA 进行NIPT 测试,并应用于常见胎儿染色体非整倍体检测。未来NIPT 的临床应用进展最可能延伸至胎儿亚显微染色体异常[31]。Peters等[42]证实,可以通过母体血浆游离DNA 检测胎儿染色体微缺失如22q11.2,也称DiGeorge 综合征。Lo等[43]构建的基因组水平检测染色体复制数量异常的框架证明,染色体微缺失或微重复检测不需要基因分析方法的根本变化,只需要新的测序数据计算函数。虽然cffDNA 检测染色体微缺失、微重复开始转向临床应用,但它的广泛应用取决于测序深度和分析的费用。另外,Lo等[44]证明可以通过母血浆内的cff DNA 重建胎儿全基因。但利用cffDNA重建胎儿全基因方法的临床应用仍需要进一步的研究。随着测序技术的快速发展,无创胎儿染色体核型分析成本降低后也可能替代染色体核型分析。连续流式PCR(continuous-flow polymerase chain reaction,CF-PCR)芯片、荧光原位杂交(fluorescence in-situ hybridization,FISH)和 微 阵 列 芯 片(microarrays)分析为目前应用前景较好的方法。
[1] Merkatz IR,Nitowsky HM,Macri JN,et al,An association between low maternal serum alpha-fetoprotein and fetal chromosomal abnormalities[J].Am J Obstet Gynecol,1984,148:886-894.
[2] Cuckle HS,Wald NJ,Lindenbaum RH.Maternal serum alpha-fetoprotein measurement:a screening testing for Down syndrome[J].Lancet,1984,1:926-929.
[3] Bogart MH,Pandian MR,Jones OW.Abnormal maternal serum chorionic gonadotropin levels in pregnancies with fetal chromosome abnormalities[J].Prenat Diagn,1987,7:623-630.
[4] Wald NJ,Cuckle HS,Densem JM,et al.Maternal serum screening for Down’s syndrome in early pregnancy[J].BMJ,1988,297:883-887.
[5] Wald NJ,Rodeck C,Hackshaw AK,et al.First and second trimester antenatal screening for Down’s syndrome:the results of the serum urine and ultrasound screening study(SURUSS)[J].J Med Screen,2003,10:56-104.
[6] Canick JA,Palomaki GE,Osthanondh R.Prenatal screening for trisomy 18in the second trimester[J].Prenat Diagn,1990,10:546-548.
[7] Palomaki GE,Knight GJ,Haddow JE,et al.Risk-based prenatal screening for trisomy 18 using alpha-fetoprotein,unconjugated oestriol and human chorionic gonadotropin[J].Prenat Diagn,1995,15:713-723.
[8] Wenstrom KD,Chu DC,Owen J,et al.Maternal serum AFP and dimeric inhibin-A detect aneuploidies other than Down syndrome[J].Am J Obstet Gynecol,1998,179:966-970.
[9] Lambert-Messerlian GM,Saller DN,Tumber MB,et al.Second trimester maternal serum inhibin A levels in fetal trisomy 18and Turner syndrome with and without hydrops[J].Prenat Diagn,1998,18:1061-1067.
[10] Saller DN,Canick JA,Schwartz S,et al.Multiple marker screening in pregnancies with hydropic and nonhydropic Turner syndrome[J].Am J Obstet Gynecol,1992,167:1021-1024.
[11] Brambati B,Tului L,Bonacchi I,et al.Serum PAPP-A and free beta-hCG are first-trimester screening markers for Down syndrome[J].Prenat Diagn,1994,14:1043-1047.
[12] Noble PL,Abraha HD,Snijders RJ,et al.Screening for fetal trisomy 21in the first trimester of pregnancy:maternal serum free beta-hCG and fetal nuchal translucency thickness[J].Ultrasound Obstet Gynecol,1995,6:390-395.
[13] Wapner R,Thom E,Simpson JL,et al.First trimester maternal serum biochemistry and fetal nuchal translucency screening(BUN)study group.First-trimester screening for trisomies 21and 18[J].N Engl J Med,2003,349:1405-1413.
[14] Avgidou K,Papageorghiou A,Bindra R,et al.Prospective first-trimester screening for trisomy 21in 30,564pregnancies[J].Am J Obstet Gynecol,2005,192:1761-1767.
[15] Malone FD,Canick JA,Ball RH,et al.First-trimester or second-trimester screening,or both,for Down’s syndrome[J].N Engl J Med,2005,353:2001-2011.
[16] Haddow JE,Palomaki GE,Knight GJ,et al.Screening of maternal serum for fetal Down’s syndrome in the first trimester[J].N Engl Med,1998,338:955-961.
[17] Malone FD,Cuckle H,Ball RH,et al.Contingent screening for trisomy 21results from a general population screening trial[J].Am J Obstet Gynecol,2005,193:S29.
[18] Lo YM,Crobetta N,Chamberlain PF,et al.Presence of fetal DNA in maternal plasma serum[J].Lancet,1997,350:485-487.
[19] Chiu RW,Chan KCA,Gao Y,et al.Noninvasive prenatal diagnosis of fetal chromosomal aneuploidy by massively parallel genomic sequencing of DNA in maternal plasma[J].ProcNatl Acad Sci USA,2008,105:20458-20463.
[20] Palomaki GE,Kloza EM,Lambert-Messerlian GM,et al.DNA sequencing of maternal plasma to detect Down syndrome:an international clinical validation study[J].Genet Med,2011,13:913-920.
[21] Bianchi DW,Platt LD,Goldberg JD,et al.Genome-wide fetal aneuploidy detection by maternal plasma DNA sequencing[J].Obstet Gynecol,2012,119:890-901.
[22] Lau TK,Chen F,Pan X,et al.Noninvasive prenatal diagnosis of common fetal chromosomal aneuploidies by maternal plasma DNA sequencing[J].J Matern Fetal Neonatal Med,2012,25:1370-1374.
[23] Palomaki GE,Deciu C,Kloza EM,et al.DNA sequencing of maternal plasma reliably identifies trisomy 18and trisomy 13 as well as Down syndrome:an international collaborative study[J].Genet Med,2012,14:296-305.
[24] Norton ME,Brar H,Weiss J,et al.Noninvasive chromosomal evaluation(NICE)study:results of a multicenter prospective cohort study for detection of fetal trisomy 21and trisomy 18[J].Am J Obstet Gynecol,2012,207:137.e1-8.
[25] Zimmermann B,Hill M,Gemelos G,et al.Noninvasive prenatal aneuploidy testing of chromosomes 13,18,21,X,and Y,using targeted sequencing of polymorphic loci[J].Prenat Diagn,2012,32:1-9.
[26] Benn P,Borrell A,Cuckle H,et al.Prenatal detection of down syndrome using massively parallel sequencing(mps):a rapid response position statement from a committee on behalf of the board of the international society for prenatal diagnosis[J].Prenat Diagn,2012,32:1-2.
[27] ACOG.Committee opinion no.545:noninvasive prenatal testing for fetal aneuploidy[J].Obstet Gynecol,2012,120:1532-1534.
[28] 蒋宇林,朱宇宁,吕时铭,等.2012年产前分子诊断新技术专家座谈会纪要[J].中华妇产科杂志,2012,47:804-807.
[29] Song Y,Liu C,Qi H,et al.Noninvasive prenatal testing of fetal aneuploidies by massively parallel sequencing in a prospective Chinese population[J].Prenat Diagn,2013,33:700-706.
[30] Faibrother G,Johnson S,Musci TJ,et al.Clinical experience of noninvasive prenatal testing with cell-free DNA for fetal trisomies 21,18,and 13,in a general screening population[J].Prenat Diagn,2013,33:580-583.
[31] Bianchi DW,Wikins-Haug L.Integration of noninvasive DNA testing for aneuploidy into prenatal care:what has happened since the rubber met the road?[J].Clin Chem,2014,60:78-87.
[32] 边旭明.胎儿染色体非整倍体的无创产前检测[J].实用妇产科学杂志,2013,29:330-333.
[33] Canick JA,Palomaki GE,Kloza EM,et al.The impact of maternal plasma DNA fetal fraction on next generation sequencing tests for common fetal aneuploidies[J].Prenat Diagn,2013,33:667-674.
[34] Vora NL,Johnson KL,Basu S,et al.A multifactorial relationship exists between total circulating cell-free DNA levels and maternal BMI[J].Prenat Diagn,2012,32:912-914.
[35] Ashoor G,Poon L,Syngelaki A,et al.Fetal fraction in maternal plasma cell-free DNA at 11-13weeks’gestation:effect of maternal and fetal factors[J].Fetal Diagn Ther,2012,31:237-243.
[36] Canick JA,Kloza EM,Lambert-Messerlian GM,et al.DNA sequencing of maternal plasma to identify Down syndrome and other trisomies in multiple gestations[J].Prenat Diagn,2012,32:730-734.
[37] Jiang P,Chan KC,Liao GJ,et al.Fetal Quant:deducing fractional fetal DNA concentration from massively parallel sequencing of DNA in maternal plasma[J].Bioinformatics,2012,28:2883-2890.
[38] Leung TY,Qu JZ,Liao GJ,et al.Noninvasive twin zygosity assessment and aneuploidy detection by maternal plasma DNA sequencing[J].Prenat Diagn,2013,33:75-81.
[39] Mazloom AR,Dzakula Z,Oeth P,et al.Noninvasive prenatal detection of sex chromosomal aneuploidies by sequencing circulating cell-free DNA from maternal plasma[J].Prenat Diagn,2013,33:591-597.
[40] Guex N,Iseli C,Syngelaki A,et al.A robust secondgeneration genome-wide test for fetal aneuploidy based on shotgun sequencing cell-free DNA in maternal blood[J].Prenat Diagn,2013,33:707-710.
[41] Samango-Sprouse C,Banjevic M,Ryan A,et al.SNP-based non-invasive prenatal testing detects sex chromosome aneuploidies with high accuracy[J].Prenat Diagn,2013,33:643-649.
[42] Peters D,Chu T,Yatsenko SA,et al.Noninvasive prenatal diagnosis of a fetal microdeletions syndrome[J].N Engl J Med,2011,365:1847-1848.
[43] Yu SC,Jiang P,Choy KW,et al.Noninvasive prenatal molecular karyotyping from maternal plasma[J/OL].PLoS One,2013,8:e60968.
[44] Lo YM,Chan KC,Sun H,et al.Maternal plasma DNA sequencing reveals the genome-wide genetic and mutational profile of the fetus[J].Sci Transl Med,2010,2:61ra91.
