宫颈上皮内瘤变患者淋巴细胞亚群的分析
2014-12-24吕江涛孙婷婷陈飞谭先杰
吕江涛,孙婷婷,陈飞,谭先杰
(中国医学科学院,北京协和医学院,北京协和医院妇产科,北京 100730)
宫颈 上 皮 内 瘤 变(cervical intraepithelial neoplasia,CIN)是由高危型人乳头瘤病毒(human papilloma virus,HPV)持续感染引起的一种较常见的宫颈疾病。根据异常细胞所占宫颈上皮层范围的不同,可以将CIN 由轻到重分为CIN1、CIN2、CIN3(包括原位癌)三级。已经清楚,高危型HPV 感染是CIN 和宫颈癌的必要条件,但非充分条件。有资料表明,妇女一生中感染HPV 的机会高达80%,但多数妇女可在数月之内清除病毒,仅少数演变为持续感染,进而发展成为CIN 甚至宫颈癌[1]。这一现象表明,大多数妇女具备完善的防御机制对抗和清除HPV,仅少数妇女的防御机制存在缺陷。研究提示HPV 的清除失败与机体的细胞免疫功能异常有关[2],但关于CIN 患者的全身免疫功能的研究尚少。本研究通过对不同级别的CIN 患者的外周血进行T 淋巴细胞亚群的检测,以进一步了解CIN 患者的全身免疫功能的变化。
资料与方法
一、研究方案
在2013年7月~2013年12月,前瞻性招募于我院门诊就诊的宫颈病变患者,与患者签署知情同意书之后将其入组研究。所有患者均有液基细胞学检查(TCT)以及HPV的杂交捕获二代技术(HC2)定量检测结果。纳入条件有:(1)TCT 结果为低度上皮内瘤变(LSIL)及以上;(2)TCT 为不明确意义的不典型鳞状上皮(ASC-US),高危型HPV 的HC2数值>1.0。排除条件有:(1)全身的急、慢性感染性疾病;(2)血液系统疾病;(3)确诊为肿瘤患者。所有患者在纳入之后,均进行阴道镜检查及多点活检。在活检之前行术前检查,额外抽取患者2ml外周血。
二、主要仪器设备和试剂
主要仪器包括FACS 流式细胞仪(Beckman Coulter,美国)和离心机(安亭仪器厂)。主要试剂包括IgG1-异硫氰酸荧光素(FITC)、HLA-DRFITC、CD45RA-FITC、CD45RO-PE、CD38-FITC、CD3-PC5、CD4-PC7、CD8-PC7、溶 血 素(Beckman Coulter,美国)以及PBS溶液(自配)。
三、实验方法
采集患者2ml外周血,从体检中心获得20份健康女性的外周血标本。乙二胺四乙酸(EDTA)抗凝,20h 内进一步处理。根据实验目的,将抗体进行如下组合:IgG1-FITC/CD3-PC5/CD4-PC7;人类白 细 胞 抗 原(HLA)-DR-FITC/CD3-PC5/CD4-PC7;HLA-DR-FITC/CD3-PC5/CD8-PC7;CD38-FITC/CD3-PC5/CD4-PC7;CD38-FITC/CD3-PC5/CD8-PC7 为三色方案。IgG1-FITC/IgG1-PE/CD3-PC5/CD4-PC7;CD45RA-FITC/CD45RO-PE/CD3-PC5/CD4-PC7;CD45RA-FITC/CD45RO-PE/CD3-PC5/CD8-PC7为四色方案。取8只试管,向其中加入100μl抗凝全血,分别加入上述8种抗体组合,振荡均匀后避光孵育15min。FITC、PE 标记的抗体加入量为10μl,PC5、PC7标记的抗体加入量为5μl。每管中分别加入500μl的溶血素,充分振荡均匀以保证红细胞完全碎裂,避光放置10min。每管中加入500μl的PBS缓冲液,混合均匀后离心(1 500r/min,5min)。弃上清液后,再向每管加入500μl的PBS缓冲液,混合均匀后进行流式细胞仪的检测。流式细胞仪获得数据之后,利用软件CELL QUEST 进行荧光参数分析。调整电压及根据同型对照进行颜色补偿,以淋巴细胞设门,读取免疫表型为CD3+、CD3+CD8+、CD3+CD4+、CD3+CD4+CD38+、CD3+CD4+HLA-DR+、CD3+CD8+CD38+、CD3+CD8+HLADR+、CD3+CD4+CD45RO+CD45RA-、CD3+CD4+CD45RO-CD45RA+、CD3+CD8+CD45RO-CD45RA+、CD3+CD8+CD45RO-CD45RA+亚群的百分比。
四、统计学分析
采用SPSS 18.0软件行统计学分析。各淋巴细胞亚群的百分率均用均值±标准差表示,方差分析用于多组间均数比较,Dunnett法用于各患者组与健康对照组的两两比较。以P<0.05为差异有统计学意义。
结 果
一、基本情况
本研究共收集38 例CIN 患者的外周血,其中CIN1 12例、CIN2 15例、CIN3 11例。与20例对照组相比,各组患者在年龄、孕产次、HC2值方面没有显著性差异。图1以CD3+CD4+CD38+T 细胞的分析过程为例,说明三色方案分析淋巴细胞亚群的过程。A图中纵坐标为前向散射光(forward scatter light,FS),与标本中细胞的大小有关,横坐标为侧向散射光(side scatter light,SS),与标本中血细胞表面被荧光染料标记的细胞数有关。B图中被圈出的细胞为CD3+T细胞,占所有白细胞总数的40.7%。C 图中横坐标为CD3的表达量,纵坐标为CD4的表达量,CD3+T 细胞被较好地划分为CD3+CD4+T 细胞和CD3+CD4-T 细 胞。D 图 中 纵 坐 标 为CD38 的 表 达 量,得 到CD3+CD4+CD38+T 细胞占CD3+CD4+T 细胞的比例为26.6%。同理,图2以CD3+CD4+CD45RO+T细胞和CD3+CD4+CD45RA+T 细胞的分析过程为例,说明四色方案分析淋巴细胞亚群的过程。
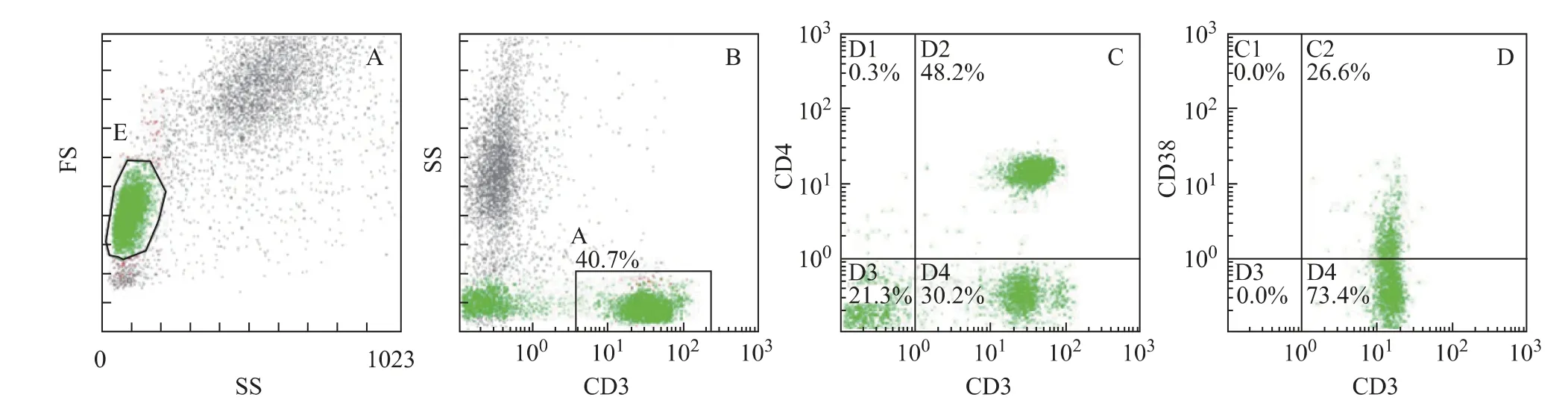
图1 三色方案分析淋巴细胞亚群
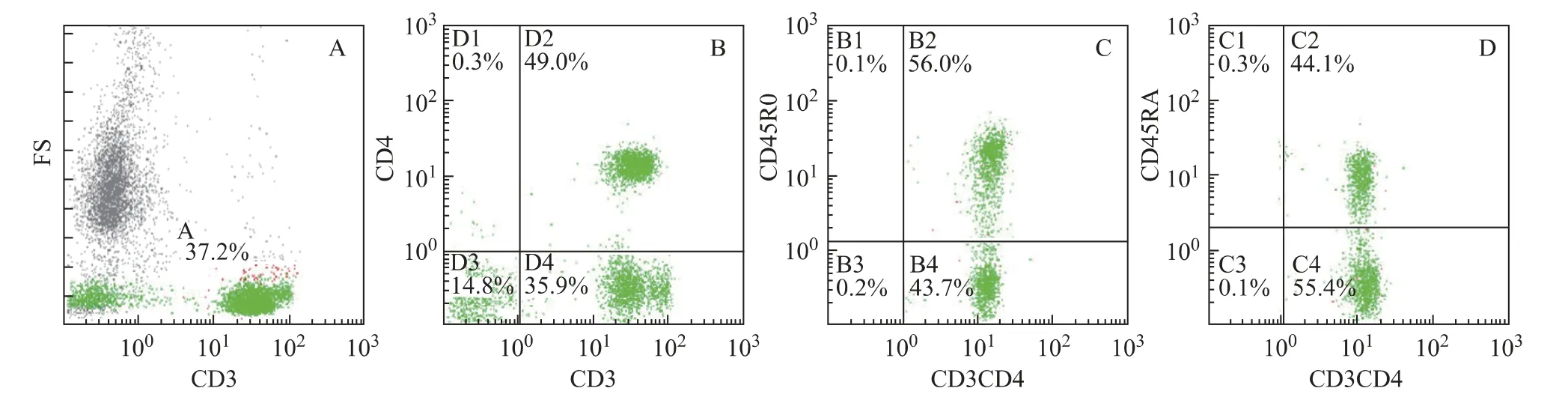
图2 四色方案分析淋巴细胞亚群
二、CD4+T细胞和CD8+T细胞的分析结果
与健康对照相比,CIN 患者的CD4+T 细胞比例有逐渐下降的趋势,而CD8+T 细胞比例有逐渐增加的趋势,但是各组间的差异均没有统计学意义。CD4+T细胞/CD8+T细胞的比值随宫颈病变级别增加下降的趋势。CIN2 患者(1.05±0.52)与对照组(1.46±0.43)相比及CIN3患者(0.99±0.58)与对照组相比,CD4+T 细胞/CD8+T 细胞的比值均有显著性差异(表1)。
三、CIN患者T淋巴细胞亚群的细分结果
进一步利用流式细胞技术对CD4+T 细胞和CD8+T 细胞的亚群进行细分。结果发现CD8+T细胞的激活亚群(CD38、HLA-DR),CD4+T 细胞和CD8+T 细胞的纯真亚群(CD45RA)、记忆亚群(CD45RO)在各组之间没有明显的统计学差异。而CIN3患者的CD4+T 细胞中的激活亚群(HLA-DR)的比例与健康对照组比较有显著增加(表2)。
表1 CIN 患者CD4+T 细胞和CD8+T 细胞的分析(±s)
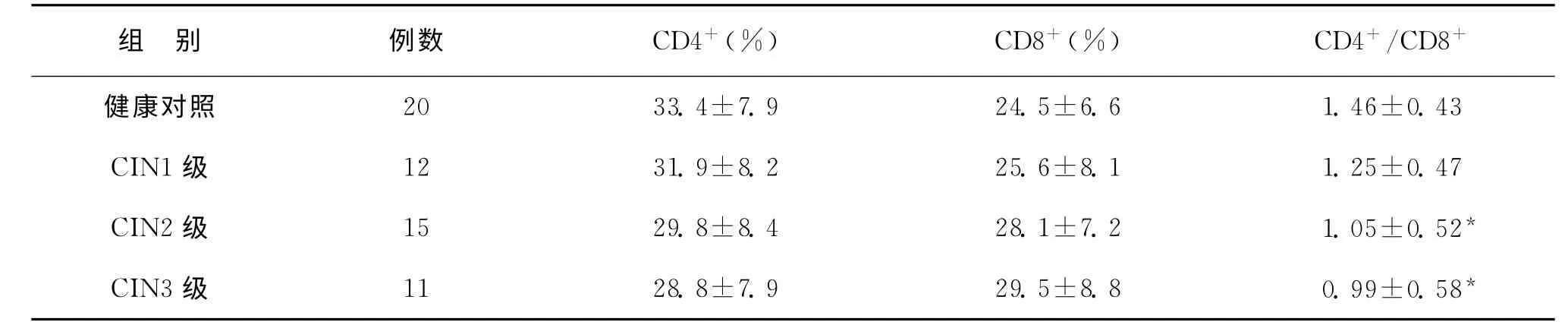
表1 CIN 患者CD4+T 细胞和CD8+T 细胞的分析(±s)
注:与健康对照组比较,*P<0.05
组 别 例数 CD4+(%) CD8+(%) CD4+/CD8+健康对照 20 33.4±7.9 24.5±6.6 1.46±0.43 CIN1级 12 31.9±8.2 25.6±8.1 1.25±0.47 CIN2级 15 29.8±8.4 28.1±7.2 1.05±0.52*CIN3级 11 28.8±7.9 29.5±8.8 0.99±0.58*
表2 CIN 患者T 淋巴细胞亚群的细分结果[(±s)%]
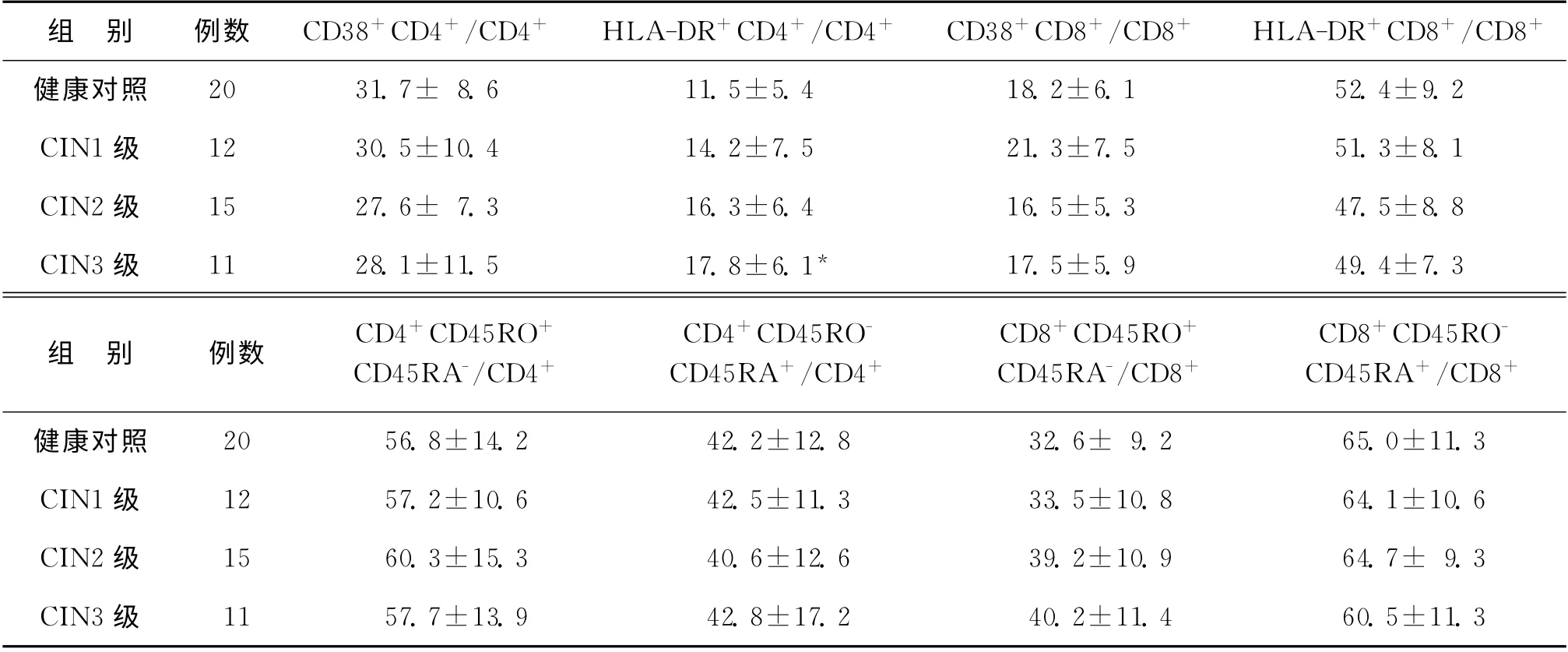
表2 CIN 患者T 淋巴细胞亚群的细分结果[(±s)%]
注:与健康对照组比较,*P<0.05
组 别 例数 CD38+CD4+/CD4+ HLA-DR+CD4+/CD4+ CD38+CD8+/CD8+ HLA-DR+CD8+/CD8+健康对照20 31.7± 8.6 11.5±5.4 18.2±6.1 52.4±9.2 CIN1级 12 30.5±10.4 14.2±7.5 21.3±7.5 51.3±8.1 CIN2级 15 27.6± 7.3 16.3±6.4 16.5±5.3 47.5±8.8 CIN3级 11 28.1±11.5 17.8±6.1* 17.5±5.9 49.4±7.3组 别 例数 CD4+CD45RO+CD45RA-/CD4+CD4+CD45ROCD45RA+/CD4+CD8+CD45RO+CD45RA-/CD8+CD8+CD45ROCD45RA+/CD8+健康对照20 56.8±14.2 42.2±12.8 32.6± 9.2 65.0±11.3 CIN1级 12 57.2±10.6 42.5±11.3 33.5±10.8 64.1±10.6 CIN2级 15 60.3±15.3 40.6±12.6 39.2±10.9 64.7± 9.3 CIN3级11 57.7±13.9 42.8±17.2 40.2±11.4 60.5±11.3
讨 论
T 淋巴细胞是人体细胞免疫系统中具有重要功能的细胞群。在正常机体中,只有各T 淋巴细胞亚群相互作用并维持一定的比例,才能确保人体免疫功能的正常作用。人体免疫系统紊乱的发生与不同淋巴细胞亚群的功能和数量发生异常有密切关联。人体感染了人免疫缺陷病毒(HIV)后,主要病理过程就是T 淋巴细胞免疫系统受损,尤其是CD4+T淋巴细胞遭到损害,导致各种机会性感染和肿瘤[3]。HIV 感染导致免疫功能异常,特别是细胞免疫功能受损会大大增加感染HPV 的风险,而且感染后容易进展成为CIN 和宫颈癌[4]。
HPV 是一种嗜上皮细胞病毒,病毒不进入血液中复制,因此HPV 导致的免疫系统变化应该与HIV 有很大不同。上皮细胞感染HPV 之后,并不会导致细胞崩解,病毒复制和装配都发生在细胞内,等待细胞死亡之后,再释放出大量的完整病毒颗粒[5]。在这个过程当中,没有炎症发生,机体也就不会启动针对HPV 的免疫清除机制[6]。尽管HPV感染之后,机体产生的抗体微乎其微,但是以病毒包膜蛋白为主要成分的HPV 预防性疫苗却取得了显著的效果[7]。然而,在已经被HPV 感染甚至已经出现CIN 病变的患者中,起主要清除病变作用的是机体的细胞免疫功能[2]。
CD4+T 淋巴细胞/CD8+T 淋巴细胞的比值是反映系统细胞免疫功能的重要指标之一。本研究通过特异性荧光抗体标记,用流式细胞仪对38 例宫颈上皮内瘤变患者的外周血进行了T 淋巴细胞亚群的检测。结果发现,与健康对照相比CIN 患者的CD4+T 细胞和CD8+T 细胞的比例均没有显著性变化,但CIN2患者和CIN3患者的CD4+T 细胞/CD8+T 细胞的比值显著下降。这表明CIN 患者确实存在机体的全身细胞免疫功能异常,提示CIN 患者存在CD8+T 细胞相对增加而带来的细胞毒免疫的增强和CD4+T 细胞相对下降而带来T 辅助细胞比例异常的现象。导致此现象的原因可能是机体的免疫应答受到了HPV 感染或者异型增生的宫颈鳞状上皮细胞的影响,导致外周血中CD4+T 淋巴细胞减少,γ-干扰素、白细胞介素-2等细胞因子水平下降,自然杀伤细胞活性降低、数量减少。
HIV 感染发病后,人体免疫系统主要表现为CD4+T 细胞计数减少,特别是纯真CD4 细胞(CD4+CD45RA+)数目下降;功能亚群(CD28+)表达降低;CD8 细胞激活亚群(CD8+CD38+、CD8+HLA-DR+)增加,并与HIV 的病毒载量呈正相关[3]。研究发现,在HPV 持续感染的年老妇女的外周血中,表达CD69和HLA-DR 的激活亚群以及CD8+T 细 胞 的 分 化 记 忆 亚 群(CD45RO+CD27-CD8+)出现显著性增加[8]。本研究的独创之处在于在CIN 患者中进行T 淋巴细胞亚群的细分研究。结果发现,与健康对照组相比CIN3患者的CD4+T细胞中的激活亚群比例增加,提示尽管CIN 患者随着病情加重CD4+T 细胞的相对数目下降,但是却存在异常比例的激活亚群。这可能是CIN 病变加重的原因,也可能是高级别CIN 病变的结果。在离体实验中,HPV 持续感染的人群的外周血单个核细胞对促有丝分裂原和抗原的刺激反应减弱[9]。结合此项研究的结果,我们可以推论慢性HPV 感染引起的CIN 病变,尽管仅存在于宫颈局部,但仍可以引起外周血T 细胞亚群的比例变化。
本研究通过对CIN 患者的CD4+T 细胞和CD8+T 淋巴细胞进行了分析,同时还对它们的细胞表面分化标记进行研究,从而发现了CIN 患者的系统免疫功能的异常。这为CIN 患者的免疫治疗提供了理论基础。但是由于本研究属于单个时间点的横断面研究而且纳入的病例数较少,暂不能判断CIN 患者的全身免疫功能的异常是疾病引起的结果还是导致疾病进展的原因。未来的工作将扩大样本量,并在多个时间点连续观察CIN 患者的系统免疫功能变化,以更好地理解HPV 感染导致的CIN病变与人体免疫系统的关系。
[1] 邢志艳,徐东艳,郝百连,等.955 例妇科就诊妇女人乳头瘤病毒 感 染 筛 查 结 果 分 析[J].生 殖 医 学 杂 志,2013,22:951-953.
[2] Stanley MA.Immune responses to human papilloma viruses[J].Indian J Med Res,2009,130:266-276.
[3] Chakrabarti LA,Simon V.Immune mechanisms of HIV control[J].Curr Opin Immunol,2010,22:488-496.
[4] van der Burg SH,Palefsky JM.Human immunodeficiency virus and human papilloma virus-why HPV-induced lesions do not spontaneously resolve and why therapeutic vaccination can be successful[J].J Transl Med,2009,7:108.
[5] Stanley MA.Epithelial cell responses to infection with human papillomavirus[J].Clin Microbiol Rev,2012,25:215-222.
[6] Kanodia S,Fahey LM,Kast WM.Mechanisms used by human papillomaviruses to escape the host immune response[J].Curr Cancer drug Tar,2007,7:79-89.
[7] Paavonen J,Jenkins D,Bosch FX,et al.Efficacy of a prophylactic adjuvanted bivalent L1virus-like-particle vaccine against infection with human papillomavirus types 16and 18 in young women:an interim analysis of a phase III doubleblind,randomised controlled trial[J].Lancet,2007,369:2161-2170.
[8] Rodriguez AC,Garcia-Pineres AJ,Hildesheim A,et al.Alterations of T-cell surface markers in older women with persistent human papillomavirus infection[J].Int J Cancer,2011,128:597-607.
[9] Garcia-Pineres AJ,Hildesheim A,Herrero R,et al.Persistent human papillomavirus infection is associated with a generalized decrease in immune responsiveness in older women[J].Cancer Res,2006,66:11070-11076.
