离子色谱-紫外检测法同时分析碘酸根、碘离子、溴酸根和溴离子
2014-12-24郑秀荣
李 朦, 于 泓, 郑秀荣
(哈尔滨师范大学化学化工学院,黑龙江 哈尔滨150025)
碘是人体发育的必要元素,甲状腺功能的正常发挥有赖于适当水平的碘摄入,碘缺乏与碘过量均对人体健康造成威胁。加碘食盐是人摄取碘的一个重要途径,碘酸钾和碘化钾由于具有含碘量高和价格较低等优点通常被添加到食盐中。研究表明,溴酸根是饮用水臭氧消毒的重要副产物,产生于源水中溴离子的臭氧氧化过程,其达到一定浓度对人体有潜在的致癌作用,被国际癌症研究机构定为2B级化合物(可能致癌)。在我国沿海地区,咸潮带入、海水倒灌以及相关的工业污染等都会导致水体中溴、碘离子含量上升,从而在饮用水消毒过程中会产生较高浓度的溴酸盐及碘酸盐的相关副产物,对人体具有潜在的健康风险。此外,溴离子、碘离子均为组成离子液体的主要阴离子。可见,在高离子强度基质(如海水)、饮用水测定、离子液体分析等相关领域,对碘酸根、碘离子、溴酸根和溴离子分析方法的研究有重要的价值。
分析碘酸根、碘离子、溴酸根和溴离子的方法主要 有离 子 色 谱 法[1-9]、高 效 液 相 色 谱 法[10,11]、光 度法[12,13]、电 化 学 法[14,15]等,其 中 离 子 色 谱 法 最 为 有效。用离子色谱法分析卤素含氧酸根离子可以采用柱后衍生法,但存在基质干扰(主要是高浓度氯离子的干扰)、对仪器要求较高等缺点。此外,离子色谱-电感耦合等离子体质谱法(IC-ICP-MS)也被用于分析卤素含氧酸根,但其设备昂贵,且操作相对复杂。用电导检测的离子色谱法亦可分析这4种离子,但检测灵敏度较低。本研究发展了同时分析碘酸根、碘离子、溴酸根和溴离子的离子色谱-紫外检测分析方法,并将方法应用于离子液体样品和地下水样品的分析,灵敏度和选择性较好。
1 实验部分
1.1 仪器与试剂
LC-20A 型高效液相色谱仪,配有SPD-20A 紫外-可见双波长检测器、LC-20AD sp流动相输液泵、CTO-20AC 柱温箱(温度控制精确到0.1 ℃)、SIL-20A 自 动 进 样 器、SCL-10A vp 系 统 控 制 器 和LC Solution Ver 1.1 色谱工作站(岛津公司)。PHSF-3F型pH 计(上海精密科学仪器有限公司),Simplicity 纯 水 系 统(美 国 Millipore 公 司),DOAP504-BN 型无油真空泵(美国IDEX 公司)。
酒石酸、苹果酸、琥珀酸、氢氧化钠为分析纯试剂,柠檬酸为优级纯,碘酸钾、碘化钾、溴酸钾、溴化钠为分析纯试剂,均购自天津光复精细化工研究所。乙腈为色谱纯试剂,购自北京迪马科技有限公司。电阻率≥18.2 MΩ·cm 的超纯水。
1.2 标准溶液和流动相的配制
标准溶液:首先用超纯水配制被测离子质量浓度为1 000 mg/L的标准储备液,保存于冰箱冷藏室中。待用时,取适量标准储备液稀释至实验所需浓度,经0.22μm 滤膜过滤后使用。
流动相:根据实验需要,用超纯水配制流动相的酸溶液,用1 mol/L 氢氧化钠溶液调节流动相pH值。流动相经0.22μm 滤膜过滤,真空脱气15 min后使用。
1.3 色谱条件
色谱柱为Shim-pack IC-A3阴离子交换柱(150 mm×4.6 mm,5μm;岛津公司),柱填料为表面带季铵基的聚丙烯酸酯树脂。流动相为1.0 mmol/L柠檬酸-乙腈(85∶15,v/v;pH 5.0),流速为0.9 mL/min,柱温为40 ℃,进样体积为20μL,紫外检测波长为210 nm。进样前用流动相冲洗色谱系统至基线稳定。每天进样分析结束后,用至少30 mL超纯水冲洗色谱柱至初始状态。
2 结果与讨论
2.1 紫外检测波长的影响
溴酸盐、溴化物和碘酸盐的最大吸收波长在200 nm,碘化物的最大吸收波长在227 nm。为了同时检测4种离子,考察了检测波长的影响。设定流动相组成为1.0 mmol/L柠檬酸-乙腈(85∶15,v/v;pH5.0),流速为0.9 mL/min,温度为40 ℃,分别在200、210、220、230、240 nm 波长下检测4 种离子,表1为不同波长下4种离子的检出限。结果表明,波长的选择对检测结果影响较大。在200、210 nm 处,碘酸根、溴酸根、溴离子都有较强的紫外吸收,检出限相对较低;在230、240 nm 处,溴离子出现负峰,可能的原因是在230和240 nm,流动相的背景紫外吸收强度大于被检测溴离子的紫外吸收强度,当溴离子被洗脱时,出现负峰。当检测波长为200 nm 时,基线不稳定。在210 nm 检测波长下,检出限较低,灵敏度较好,基线较平稳。综合以上因素,选择检测波长为210 nm。

表1 不同检测波长下4种离子的检出限Table 1 Detection limits(LODs,S/N=3)of the four anions at different wavelengths
2.2 流动相种类的选择
考察了4种无特征紫外吸收的有机酸作为流动相对4 种离子检测的影响。在210 nm 检测波长、柱温为40 ℃、流速设为0.9 mL/min下,分别采用1.0 mmol/L 的酒石酸、苹果酸、琥珀酸、柠檬酸溶液与乙腈(85∶15,v/v;pH5.0)为流动相进行分离。结果表明,4种离子在4种情况下均有保留,但检测灵敏度和保留时间各不相同。表2列出了不同有机酸种类下4种离子的检出限及保留时间。采用琥珀酸作流动相时,4种离子的保留时间最长,且灵敏度差。采用柠檬酸作流动相时,离子保留时间最短,且色谱峰形较好,因此选择柠檬酸作为流动相的组成成分。

表2 以不同有机酸作流动相成分时4种离子的检出限及保留时间Table 2 Detection limits(LODs,S/N=3)and the retention times(tR)of the four anions in different organic acids as mobile phases
2.3 柠檬酸浓度的影响
将色谱柱温度设为40 ℃,流速设为0.9 mL/min,改变流动相中柠檬酸的浓度分别为0.6、0.8、1.0、1.2、1.4 mmol/L与乙腈组成流动相(85∶15,v/v;pH5.0),观察4种离子的保留时间与分离的变化。结果表明,随着柠檬酸浓度的增大,离子的保留时间逐渐缩短。柠檬酸的浓度为1.0 mmol/L时,可以获得良好的色谱基线和峰形,系统峰不干扰测定;柠檬酸浓度低时,保留时间较长;而浓度较高时,对色谱系统有一定的影响。过高的盐浓度在有机相浓度高、温度低时易析出,堵塞色谱柱。因此,柠檬酸浓度不宜过大,本文选择柠檬酸浓度为1.0 mmol/L。
2.4 乙腈比例对离子保留的影响
固定色谱柱温度40 ℃、流速0.9 mL/min,分别以1.0 mmol/L柠檬酸水溶液与体积分数为6%、9%、12%、15%和18%的乙腈(色谱柱允许的最大有机溶剂含量为20%)组合为流动相(pH5.0),考察流动相中乙腈的体积分数对待测阴离子保留的影响。结果表明,随着乙腈体积分数的增加,碘酸根的保留时间增长,可能原因是流动相中乙腈含量的增加影响了柠檬酸的电离,导致淋洗离子浓度减小,从而使流动相的洗脱能力减弱,碘酸根的保留时间增长。与碘酸根的情况相反,碘离子的保留时间随乙腈体积分数的增加而缩短,其原因是碘离子为疏水性离子,与固定相之间有较强的疏水作用,当流动相中乙腈含量增加时,减弱了碘离子与固定相之间的疏水作用,使保留时间缩短。随着乙腈含量的变化,溴酸根和溴离子的保留时间变化不明显,可能是以上几种因素共同作用的结果。由关系式lgk =cφ(ACN)+d[16](k 是离子的保留因子,φ(ACN)是乙腈的体积分数),求得线性回归方程(见表3)。对碘离子,方程的斜率为负值,说明随着乙腈体积分数增加,碘离子的保留时间缩短。对碘酸根,方程的斜率为正值,说明随着乙腈体积分数增加,碘酸根的保留时间增长。综合考虑,乙腈的比例选定为15%。

表3 离子的lgk 与乙腈体积分数之间的线性回归方程Table 3 Linear regression equations of the lgk vs φ(ACN)for the anions
2.5 流动相pH 值对离子保留的影响
将流动相的pH 值分别调节为4.5、5.0、5.5、6.0,考察流动相pH 值对离子分离效果的影响。结果表明,随着pH 值增大,各离子的保留时间均缩短。原因是随着流动相pH 值增大,柠檬酸的离解程度增大,其淋洗能力增强,导致离子的保留时间均缩短。当流动相pH 值为4.5时,离子保留时间很长,且系统峰干扰溴离子的测定。pH 值为6.0时,碘酸根离子峰与系统峰未能完全分离。当pH 值为5.0时,4种离子能在较短的时间内分离,基线平稳,且色谱峰形良好。因此选择流动相的pH 值为5.0。
2.6 定量分析参数
在选定的色谱条件下,测定4种阴离子的混合标准溶液。在此条件下,碘离子的保留时间仍然相对较长(见图1)。如选择亲水性较强的分离柱,可能会减弱对疏水性较强的碘离子的保留,使其保留时间缩短;如选择可承受较高浓度有机溶剂的分离柱,则可通过增加流动相中有机溶剂浓度使碘离子的保留减弱。但限于本实验室的条件,目前没有开展该实验考察。
对不同质量浓度的4种离子的标准溶液进行测定,以峰面积(y)对离子的质量浓度(x,mg/L)进行线性回归,得到线性回归方程。以3倍信噪比(S/N=3)计算检出限,连续5次重复测定4种离子的标准溶液,得到保留时间和峰面积的相对标准偏差(n=5)。由表4可见,该方法具有较低的检出限,较好的线性关系和重现性。
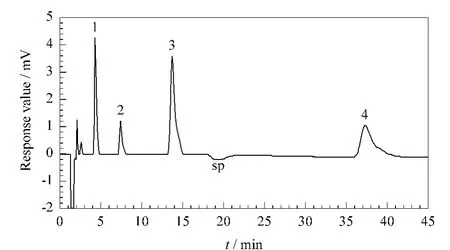
图1 4种阴离子混合标准溶液的色谱图Fig.1 Chromatogram of a mixed standard solution of the four anions
2.7 样品分析
采用本方法测定离子液体样品溴化N-己基吡啶([HPy]Br)中的溴离子和碘化N-乙基吡啶([EPy]I)中 的 碘 离 子。分 别 准 确 称 量0.152 8 g[HPy]Br和0.185 2 g[EPy]I,各配制成100 mL溶液作为浓溶液。再分别取0.1 mL浓溶液稀释至50 mL。稀释液经0.22μm 滤膜过滤后按照本方法选定的色谱条件进行分析,得到离子液体样品的色谱图(见图2),其分析结果及加标回收率见表5。结果说明该方法具有良好的准确性,能够满足实际样品的定量分析要求。
另取地下水样品,经0.22μm 滤膜过滤后在选定的色谱条件下进行分析。在地下水样品中未检测到被测离子(见图3)。其加标回收率数据见表5。
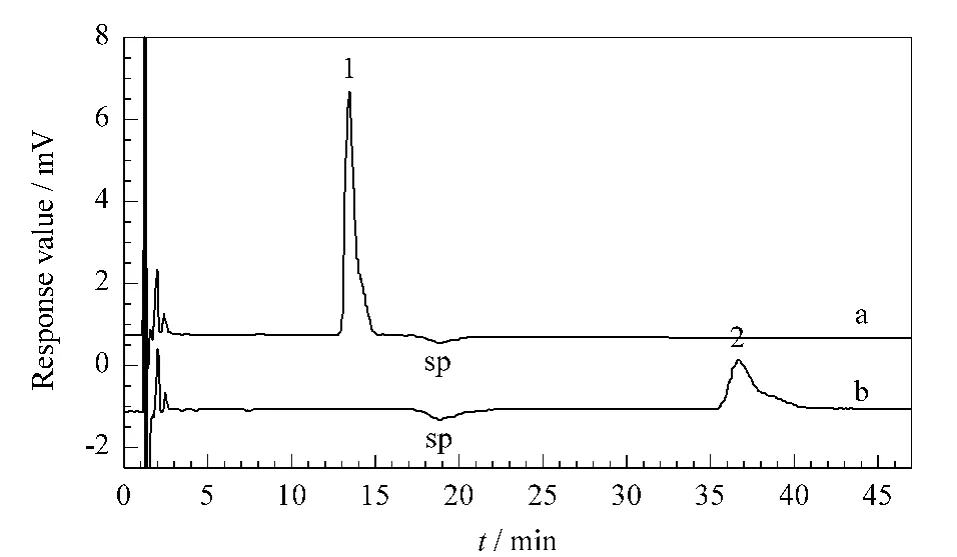
图2 离子液体(a)[HPy]Br和(b)[EPy]I样品的色谱图Fig.2 Chromatograms of(a)[HPy]Br and(b)[EPy]I ionic liquid samples

图3 地下水样品色谱图Fig.3 Chromatogram of an underground water sample

表5 离子液体及地下水样品中阴离子的测定结果及加标回收率Table 5 Analytical results and spiked recoveries of anions in ionic liquids and underground water samples
3 结论
建立了离子色谱-紫外检测同时分析碘酸根、碘离子、溴酸根和溴离子的方法。采用紫外检测器检测有特征紫外吸收的4种离子,与离子色谱-电导检测[6,7]比较,本方法检出限低,色谱峰形更好。用于检测离子液体样品中碘离子、溴离子及地下水样品中的溴酸根、碘酸根等,结果准确、可靠。该方法拓展了样品中溴离子、碘离子等的分析方法。
[1] Lin L,Wang H B,Shi Y L.Chinese Journal of Chromatography(林立,王海波,史亚利.色谱),2013,31(3):281
[2] Zhou Y Q,Wang Z J,Xu Y P,et al.Chinese Journal of Chromatography(周益奇,王子健,许宜平,等.色谱),2007,25(3):430
[3] Lin L,Chen G,Chen Y H.Chinese Journal of Chromatography(林立,陈光,陈玉红.色谱),2011,29(7):662
[4] Rebary B,Paul P,Ghosh P K.Food Chem,2010,123(2):529
[5] Zhou S,Gao W,Yu H.Journal of Instrumental Analysis(周爽,高微,于泓.分析测试学报),2009,28(11):1279
[6] Liu Y Z,Yu H,Li S W.Chinese Journal of Chromatography(刘玉珍,于泓,李偲文.色谱),2011,29(11):1036
[7] Ai H J,Chen Q,Yu H.Chinese Journal of Analysis Laboratory(艾红晶,陈倩,于泓.分析试验室),2011,30(11):65
[8] Li R S,Yu H,Gao W,et al.Chinese Journal of Analysis Laboratory(李睿姝,于泓,高微,等.分析试验室),2010,29(3):85
[9] Wang H Q,Xiao H L,Ruan X J,et al.Journal of Instrumental Analysis(王红青,肖海龙,阮小娇,等.分析测试学报),2013,32(3):385
[10] Yokota A,Kubota H,Komiya S,et al.J Chromatogr A,2012,1262:219
[11] Hou Y X,Liu L P,Du Z X.Physical Testing and Chemical Analysis Part B:Chemical Analysis(侯艳霞,刘丽萍,杜振霞.理化检验:化学分册),2011,47(11):1262
[12] Borges S S,Peixoto J S,Feres M A,et al.Anal Chim Acta,2010,668:3
[13] Xie J Y,Lei M J,Yu J Y.Chinese Journal of Analysis Laboratory(谢建鹰,雷明建,余锦玉.分析试验室),2011,30(8):54
[14] Li T J,Lin C Y,Balamurugan A,et al.Anal Chim Acta,2012,737:55
[15] Ciftci H,Tamer U.Anal Chim Acta,2011,687:137
[16] Ruiz-Angel M J,Berthod A.J Chromatogr A,2006,1113:101
