离子交换色谱法测定葡萄糖氧化反应液中的葡萄糖和葡萄糖酸*
2014-12-24王鑫梁文辉刘颖慧赵富华法芸
王鑫,梁文辉,刘颖慧,赵富华,法芸
(1.青岛大学化学科学与工程学院,山东青岛 266071;2.中国科学院青岛生物能源与过程研究所,生物基材料重点实验室,山东青岛 266101;3.山东农业大学食品科学与工程学院,山东泰安 271018)
葡萄糖酸和葡萄糖酸盐是具有广泛用途的有机酸(盐),它们可直接用作食品、饮料及医药生产中的添加剂,可替代能污染环境的多磷酸盐来制造清洁剂,可成为生物降解的螯合剂,还可作为织物加工和金属加工的助剂,在建筑工业上作为混凝土的塑化剂、减水剂和缓凝剂,及用于电镀、胶卷制造等许多工业领域[1]。然而目前我国葡萄糖酸盐的年产量不足千吨,因此对葡萄糖氧化制葡萄糖酸(盐)反应的研究具有重要意义。相关研究需要准确了解不同反应阶段或反应类型的样品中葡萄糖和葡萄糖酸含量[2–5]。
高效液相色谱(HPLC)法是目前广泛应用的分析手段[6–8],其中离子色谱法利用离子排斥分离,但反应物葡萄糖与其氧化产物葡萄糖酸钠的出峰位置重合,需要串联紫外检测器和示差检测器检测[9–10]。该方法的灵敏度相对较低,低浓度的组分不易检测。含有金属催化剂的反应体系,基体对离子色谱柱的影响较大,检测结果不够理想。高效阴离子交换色谱–积分脉冲安培法已经广泛应用于多种食品和饮料中糖的分析[11–16],主要利用离子色谱专用糖柱来分离,如Thermo Fisher公司的CarboPac PA20,CarboPac PA10等色谱柱,但该体系用于葡萄糖和葡萄糖酸(盐)的分离仍存在共淋洗的问题。
笔者采用阴离子柱IonPac AS11–HC,利用积分脉冲安培检测,实现了葡萄糖与葡萄糖酸的完全基线分离,有效解决了基体干扰和灵敏度低的问题。该方法简单,分析速度快,分析结果准确可靠。
1 实验部分
1.1 主要仪器与试剂
多功能离子色谱系统:ICS–5000型,双泵模块、电化学检测器/色谱模块、淋洗液自动发生器模块、自动进样器模块,Chromeleon 6.8色谱软件,美国Thermo Scientific公司;
超纯水制备仪:Milli-Q®Advantage A10型,美国密理博公司;
葡萄糖与葡萄糖酸钠标准品:优级纯,纯度不低于99.5%,阿拉丁试剂(上海)有限公司;
样品:镍催化剂,碱性条件下的葡萄糖氧化反应液;
实验用水为超纯水(电阻率为18.2 MΩ·cm)。
1.2 色谱条件
色谱柱:IonPac AS11–HC型阴离子交换色谱柱(250 mm×4 mm),IonPac AG11–HC型保护柱(50 mm×4 mm);流动相:5 mmol/L KOH溶液,流量为1.0 mL/min,等度洗脱;进样体积:25μL;柱温:30℃;脉冲安培检测;金工作电极;Ag/AgCl 参比电极;检测电位波形见表1。
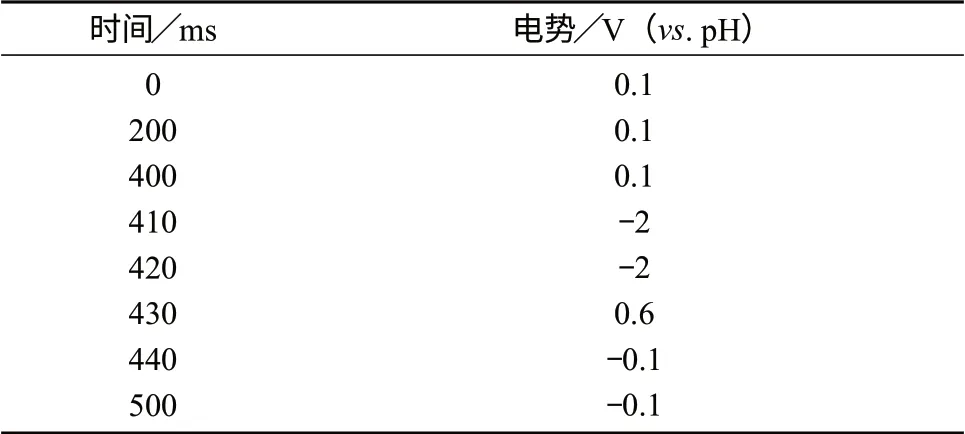
表1 检测电位波形
1.3 标准曲线的绘制
配制100 mg/L葡萄糖和葡萄糖酸钠的标准储备液,然后用其配成表2中不同浓度的混合标准溶液,按1.2色谱条件进样分析,以峰面积y为纵坐标,以标准溶液的质量浓度x (mg/L)为横坐标,绘制标准曲线。
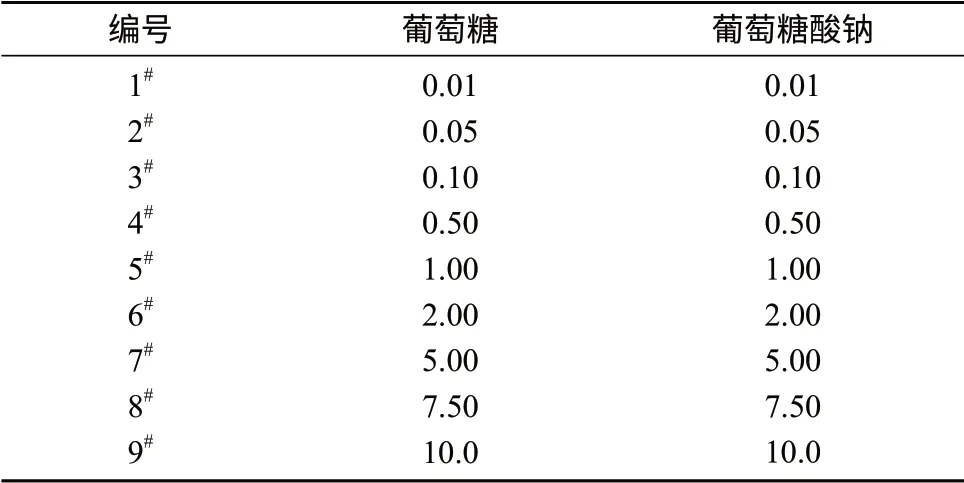
表2 系列混合标准溶液的质量浓度 mg/L
1.4 样品处理
取3.0 mL样品,置于5 mL塑料离心管中,以6 000 r/min速度离心5 min,固体杂质沉淀于离心管底。取适量上清液经0.22 μm滤膜过滤除去微米级悬浮物,滤液待检测。
2 结果与讨论
2.1 色谱条件的选择和优化
利用离子排斥原理分离,若采用BioRad Aminex HPX–87H色谱柱,流动相为0.005 mol/L的H2SO4水溶液,葡萄糖与其氧化产物葡萄糖酸钠,出峰位置重合,需要串联紫外检测器和示差检测器检测。利用阴离子交换原理分离,先选择Thermo Fisher的专用糖柱CarboPac PA20,CarboPac PA10色谱柱对混合标准溶液进行分析,葡萄糖和葡萄糖酸(盐)的分离仍存在共淋洗。因此选择季铵盐乳胶直径小的IonPac AS11–HC色谱柱分离。
一般来说,无机和有机酸的pKa值大于7的盐均可作IC中的离子淋洗液。OH–是最合适的淋洗离子,因为只要抑制器的容量足够大,OH–在抑制器全部被转化为水而与其初始及最终浓度无关。OH–淋洗液是碱性溶液,容易吸收空气中的二氧化碳,因此必须严格控制配制条件[17]。而用淋洗液在线发生器是一个很好的选择,可以消除人工配制溶液和试剂杂质等引入的误差,色谱重现性良好。
试验了多个淋洗液浓度(1.0,2.0,2.5,5.0,7.5,10.0,15.0 mmol/L),流量为1.0 mL/min进行等度洗脱,结果发现5.0 mmol/L KOH淋洗液可使葡萄糖和葡萄糖酸钠实现了完全的基线分离,而且分析工作在15 min内完成,效率较高。因此选择KOH淋洗液的浓度为5.0 mmol/L。
2.2 标准工作曲线
按照表2数据配制的系列混合标准溶液依次进样,以峰面积y为纵坐标、标准溶液的质量浓度x(mg/L)为横坐标进行线性回归,线性方程、相关系数和检出限(3倍的噪音/响应值)见表3。

表3 线性方程、相关系数及检测限
2.3 方法精密度
选择表2中5#混合标准溶液连续进样6次,测定结果见表4。由表4可知,葡萄糖及葡萄糖酸测定结果的相对标准偏差均小于1.50%。
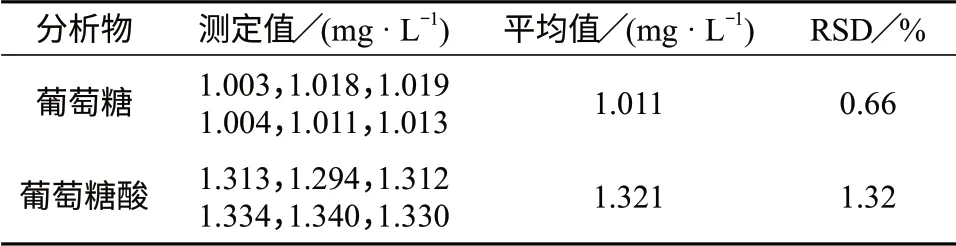
表4 精密度试验结果(n=6)
2.4 加标回收试验
在反应时间为2.0 h的样品中,加入质量浓度均为10.0 mg/L的葡萄糖、葡萄糖酸钠标准溶液,按照1.3样品处理方法处理后测定,测定结果见表5。由表5可知,葡萄糖、葡萄糖酸钠的平均回收率分别为99.50%,109.0%,表明本法测量准确度较高。

表5 样品加标回收试验结果
图1为加标质量浓度为1.00 mg/L的样品色谱图。由图1可知,葡萄糖、葡萄糖酸实现了完全的基线分离。
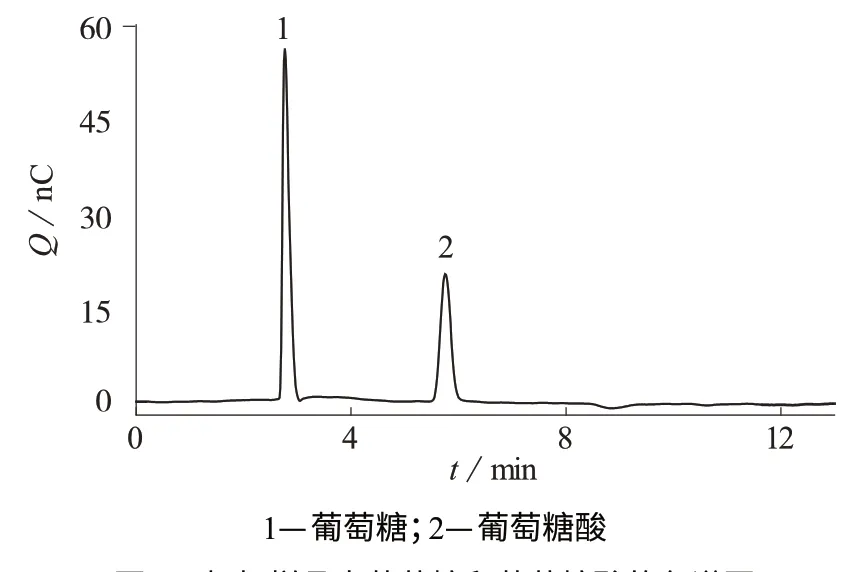
图1 加标样品中葡萄糖和葡萄糖酸的色谱图
2.5 实际样品分析
将4个不同反应时间的葡萄糖催化反应液样品按照1.3样品处理方法进行处理,样品中葡萄糖和葡萄糖酸钠得到了较好分离,色谱峰形尖锐,测定结果列入表6。图2为测定4个实际样品的离子色谱图。
3 结语
采用阴离子交换–脉冲安培检测法测定葡萄糖催化反应液中葡萄糖和葡萄糖酸钠的含量,该法操作简单,灵敏度较高,重现性和相关性好。该方法为葡萄糖氧化制葡萄糖酸(盐)反应的研究提供了有效的技术手段。

表6 不同反应时间样品的测定结果 mg/L
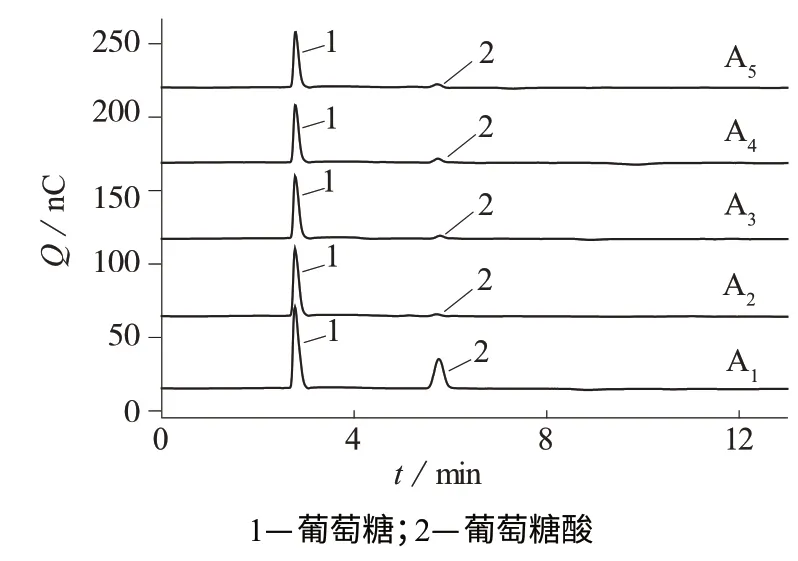
图2 标准混合物和四种样品的色谱图。
[1]郭凤华,刘昌俊.葡萄糖酸合成方法研究进展[J].化学工业与工程,2007,24(2): 173–177.
[2]Ishida T,Watanabe H,Bebeko T,et al. Aerobic oxidation of glucose over gold nanoparticles deposited on cellulose[J].Applied Catalysis A: General,2010,377(1): 42–46.
[3]Okatsu H,Kinoshita N,Akita T,et al. Deposition of gold nanoparticles on carbons for aerobic glucose oxidation[J].Applied Catalysis A: General,2009,369(1): 8–14.
[4]Saliger R,Decker N,Prüße U. D-Glucose oxidation with H2O2on an Au/Al2O3catalyst[J]. Applied Catalysis B: Environmental,2011,102(3): 584–589.
[5]Baatz C,Prüße U. Preparation of gold catalysts for glucose oxidation[J]. Catalysis today,2007,122(3): 325–329.
[6]杜军,纪晓俊,黄和,等.离子排斥色谱法同时测定2,3-丁二醇发酵液中的葡萄糖和木糖及各种代谢产物[J].分析化学,2009,37(5): 681–648.
[7]López E F,Gómez E F. Simultaneous determination of the major organic acids,sugars,glycerol,and ethanol by HPLC in grape musts and white wines[J]. Journal of Chromatographic Science,1996,34(5): 254–257.
[8]Hayakawa K,Ando K,Yoshida N,et al. Determination of saccharides in sake by high performance liquid chromatography with polarized photometric detection[J]. Biomedical Chromatography,2000,14(2): 72–76.
[9]梁曦.等离子体制备贵金属催化剂在葡萄糖氧化反应中的应用[D].天津大学:2010.
[10]林峰,张汉英. HPLC 测定葡萄糖酸盐的研究[J].分析测试学报,1997,16(1): 68–71.
[11]施超欧,丁卉,刘菊,等.高效阴离子交换–脉冲安培法测定化妆品中葡萄糖酸锌含量[J].离子交换与吸附,2012,28(2): 171–175.
[12]Martens D,Frankenberger Jr W. Determination of saccharides by high performance anion-exchange chromatography with pulsed amperometric detection[J]. Chromatographia,1990,29(1–2): 7–12.
[13]Lee Y. Carbohydrate analyses with high-performance anionexchange chromatography[J]. Journal of Chromatography A,1996,720(1): 137–149.
[14]Yu H,Ding Y S,Mou S F,et al. Simultaneous determination of amino acids and carbohydrates by anion-exchange chromatography with integrated pulsed amperometric detection[J]. Journal of Chromatography A,2002,966(1): 89–97.
[15]Clarke A P,Jandik P,Rocklin R D,et al. An integrated amperometry waveform for the direct,sensitive detection of amino acids and amino sugars following anion-exchange chromatography[J]. Analytical Chemistry,1999,71(14): 2 774–2 781.
[16]Rocklin R D,Clarke A P,Weitzhandler M. Improved longterm reproducibility for pulsed amperometric detection of carbohydrates via a new quadruple-potential waveform[J]. Analytical Chemistry,1998,70(8): 1 496–1 501.
[17]牟世芬,刘克纳,丁晓静.离子色谱方法及应用[M]. 2版.北京;化学工业出版社,2005: 55–58.
