利用pHsh 载体克隆与表达多功能半纤维素酶
2014-12-23彭静静
彭静静
(泰山学院生物与酿酒工程学院,山东 泰安271021)
农业废弃物是指农业生产和农副产品加工后的剩余物,主要包括农作物或果树的秸秆或枝条、杂草、落叶、果实外壳、玉米芯、甘蔗渣、麦麸皮、玉米麸等,其主要化学成份是纤维素、半纤维素、木质素等,是亟待开发的重要可再生资源[1]。中国是一个农业大国,每年秸秆产量达6.7×108t,占世界秸秆总产量的20% ~30%[2]。开发利用这一大类半纤维素资源具有一定的经济效益和社会效益。利用富含木聚糖类半纤维素的农业废弃物提取木糖(生产木糖醇)和制备低聚木糖的研究已成为当前该领域的研究前沿。
研究发现,来自嗜热厌氧乙醇菌(Thermoanae robacter ethanolicusJW200)的阿拉伯/木糖苷酶,以人工底物测试,其木糖苷酶活性和阿拉伯糖苷酶活性分别为180 IU/mg和1 000 IU/mg,远远高于其他木糖苷酶或阿拉伯糖苷酶所显示的活性[3]。疏棉状嗜热丝孢菌(Thermomyces lanuginosusDSM 5826)所产生的木聚糖酶A(XynA)属于G/11 家族,具有较好的热稳定性,在高温和碱性条件下有效且稳定,没有纤维素活性,具有极大的工业化应用前景。该木聚糖酶优先降解高聚合度的木聚糖链,产物是不同聚合度的低聚木糖,不产生木单糖,这对于生产低聚木糖具有很好的应用价值[4]。
同时使用多种自然克隆到的特异水解某一多糖结构的水解酶来降解木聚糖,虽然清洁高效,但工序复杂,成本高。在不改变酶自身优良性质的条件下,如果将有关的水解酶融合串联成一个具有多种水解酶活性的多功能酶,或通过融合标签回收重复利用酶,来提高融合酶的综合效率,这将大大简化工序和降低成本[5-6]。
pHsh 及其衍生质粒是近年发展起来的新型大肠杆菌表达载体,其调控外源基因表达的原理不同于其他表达系统,并且具有表达水平高、成本低廉等特点[7]。本研究用pHsh 作为表达载体,将嗜热厌氧乙醇菌的双活性阿拉伯/木糖苷酶(XarB)和来源于疏棉状嗜热丝孢菌的木聚糖酶A(XynA)进行基因融合,期望得到多功能酶的融合表达质粒pHsh-xarB-xynA,为工业化酶法降解半纤维素提供有效的技术路线。
1 材料与方法
1.1 材料
嗜热厌氧乙醇菌(T.ethanolicusJW200)编号ATCC31550,由美国佐治亚大学微生物系Wiegel 教授分离并惠赠。采用厌氧培养基培养,69 ℃静置培养8 h[8-9]。大肠杆菌为Escherichia coliJM109 (购自Promega 公司)。采用Luria-Bertani(LB)培养基:胰蛋白胨10 g/L,酵母膏5 g/L,NaCl 10 g/L,2%的琼脂粉。
含有疏棉状嗜热丝孢菌(T.lanuginosusDSM 5826)木聚糖酶A(XynA)基因的质粒pHsh-xynA2由本实验早期构建并保存。质粒pHsh 属于热激表达载体,由大肠杆菌σ32因子调控,包括一个热激启动子和终止子,通过热激诱导外源基因表达[10-12]。
1.2 方法
1.2.1 基因操作
1.2.1.1 重组质粒pHsh-xarB的构建 嗜热厌氧乙醇菌(T.ethanolicusJW200)基因组提取与DNA操作采用分子克隆技术标准方法进行。用电转化方法进行质粒转化,质粒和PCR 产物采用Qiagen plasmid kit 和PCR purification kit(Qiagen USA)纯化。
根据GenBank 中T.ethanolicusJW200 双活性阿拉伯/木糖苷酶(XarB)的基因序列(GenBank 登录号AF135015)设计引物xarB-N 和xarB-C。xarBN:5'-GCAAGCCATTATATTTAGATTC-3';xarB-C:5'-CCCCTCGAGCTATTTATTCTCTACCCTTAC -3';下划线为XhoI 酶切位点;
以提取的嗜热厌氧乙醇菌的基因组为模板,利用相应的上下游引物扩增基因xarB。为提高所扩增片段的保真性,用Pyrobest DNA 聚合酶对模板进行扩增。反应体系(50 μl):10×Buffer 5 μl;dNTP(每种碱基各2.5 mmol/L)4 μl;xarB-N(50 μmol/L)1 μl;xarB-C(50 μmol/L)1 μl;模板(10 μg/ml)1 μl;Pyrobest DNA polymerase(1.25 U/μl)1 μl;H2O 37 μl。95 ℃变性5 min,加Pyrobest DNA 聚合酶1 μl;然后94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min 30 s,循环30 次后,72 ℃保温10 min。
PCR 产物验证正确后过柱纯化,用XhoI 进行单酶切,并与经XhoI 和平端酶StuI 双酶切的质粒pHsh 16 ℃下连接6 ~12 h,将连接液电击转化至E.coliJM109 中,挑取阳性克隆,提取并验证质粒,所得质粒命名为pHsh-xarB,双酶切验证正确的质粒送上海美吉生物技术公司测序。
1.2.1.2 重组质粒pHsh-xarB-xynA的构建 根据GenBank 中T.lanuginosusDSM 5826 木聚糖酶A(XynA)基因序列(GenBank 登录号U35436)以及本实验室最终优化的pHsh-xynA2的木聚糖酶A(XynA)基因序列,设计引物xynA-N 和xynA-C。xynAN: 5'-CAGACTACCCCGAACAG-3'; xynA-C: 5'-CATATGTTTTTCTCCTTCTTG-3'。
以pHsh-xynA2为模板,利用相应的上下游引物xynA-N 和xynA-C 进行PCR,扩增出线性pHsh-xynA2,以测序正确的pHsh-xarB为模板,以xarB-N 和xarB-C 为引物扩增出xarB,并将其磷酸化处理,之后与线性pHsh-xynA2进行连接反应,转化连接液至E.coliDH 10B,得到重组质粒pHsh-xarB-xynA,酶切验证正确的质粒送上海美吉生物技术公司测序。
扩增线性pHsh-xynA2时,为提高所扩增片段的保真性,用Pyrobest DNA 酶对模板进行扩增。反应体系50 μl:10 ×Buffer 5 μl;dNTP(每种碱基各2.5 mmol/L)4 μl;xynA-N(50 μmol/L)1 μl;xynA-C(50 μmol/L)1 μl;模板(10 μg/ml)1 μl;Pyrobest DNA polymerase(1.25 U/μl)1 μl;H2O 37 μl。95 ℃变性5 min,加Pyrobest DNA 聚合酶1 μl;然后94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸3min,循环30次后,72 ℃保温10 min。PCR 扩增产物电泳检测正确后纯化,割胶回收DNA 片段,乙醇沉淀浓缩,16 ℃下连接6 ~12 h。
1.2.2 重组蛋白的表达与纯化 重组质粒pHsh
xarB-xynA电转化到宿主细胞E.coliJM109 中,挑取重组单菌落接种于含100 g/ml 的氨苄青霉素的LB 培养液中,30 ℃振荡培养至OD600达到0.6 ~0.8时转入42 ℃水浴摇床进行热激表达,继续培养8 h后离心收集菌体。用50 mmol/L pH 值为7.5 的Tris-HCl 缓冲液洗涤细胞2 次,并用相同缓冲液重悬细胞,置于冰水浴中用超声波破碎后,将细胞碎片于12 000 r/min 离心10 min,去除上清液即为粗酶液。将粗酶液在60 ℃热处理30 min 后,4 ℃12 000 r/min离心30 min 去除变性蛋白。
1.2.3 阿拉伯/木糖苷酶活性测定 阿拉伯/木糖苷酶活性是根据底物对硝基苯酚-木糖苷/阿拉伯呋喃糖苷释放对硝基苯酚(pNP)的量来确定,采用分光光度法。测定体系为200 μl,包括10 μl 20 mmol/L底物pNPAF/pNPX,180 μl 50 mmol/L pH 6.2 的邻苯二甲酸氢钾-咪唑(PIB)缓冲液,10 μl 适量稀释的粗酶液,于90 ℃/70 ℃反应5 min。然后加入600 μl 1 mol/L Na2CO3终止反应并显色,最后于405 nm 下测定吸光值。一个酶活单位U 定义为在一定反应条件下,1 min 内催化产生1 μmol 的对硝基苯酚的酶量。
1.2.4 阿拉伯/木糖苷酶、木聚糖酶及融合多功能半纤维素酶的动力学参数测定 用pH 6.2 的PIB缓冲液配制0.02 ~0.38 mmol/L的pNPX,用pH 5.8的PIB 缓冲液配制0.05 ~1.50 mmol/L的pNPAF,用pH 6.2 的PIB 缓冲液0.25 ~5.00 mg/ml的燕麦木聚糖(OSX)作为底物,然后分别在最适温度90℃、70 ℃、65 ℃测重组融合酶的木糖苷酶、阿拉伯糖苷酶和木聚糖酶的活性。采用Lineweaver-Burk作图法,计算游离酶和重组融合酶多种活性的米氏常数(Km)及酶促最大反应速率(Vmax)值。以上所有测定均重复3 次,保留木糖苷酶和阿拉伯糖苷酶的相对活性平均偏差(SD)小于2%以及木聚糖酶相对活性平均偏差小于5%的数据。
1.2.5 活性着色Xyn-SDS-PAGE 做胶:1%OSX加到分离胶中(其他和常规SDS-PAGE 相同),蛋白样品加上样Buffer,75 ℃、3 min ,75 V 低温冰浴跑蛋白胶。用250 ml 10 mmol/L Tris-HCl(PH 7.0)复性,1%Triton-X100 过夜漂洗,10 mmol/L Tris-HCl(PH 7.0)37 ℃过夜温育。0.5%刚果红室温处理15 min 进行着色,1 mol/L NaCl 脱色,直到胶体呈现透明带[13-14]。
2 结果与分析
2.1 重组质粒pHsh-xarB 的构建
扩增得到的DNA 片段经XhoI 单酶切后纯化,与载体pHsh 分别经过StuI 和XhoI 双酶切和连接,得到重组质粒pHsh-xarB。阳性转化子抽提质粒,采用XhoI 单酶切表达质粒pHsh-xarB后释放出4 700 bp 左右的断带,正好是载体pHsh(2 400 bp)与xarB基因(2 300 bp)的和,酶切结果见图1。测序结果显示该基因插入到载体正确位置。
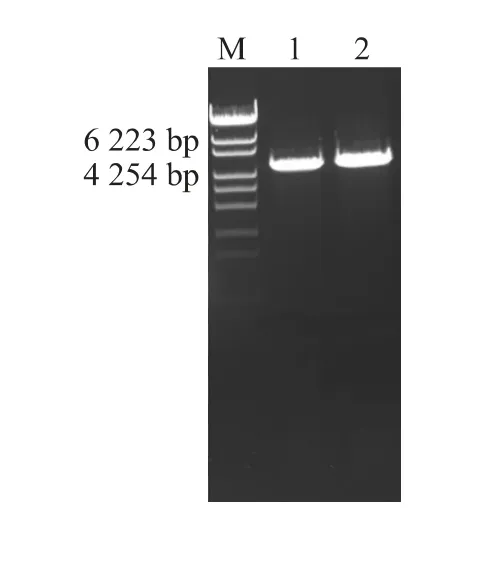
图1 重组质粒pHsh-xarB 的酶切鉴定Fig.1 Enzymatic digestion of recombinant plasmid pHsh-xarB with Xho I
2.2 重组质粒pHsh-xarB-xynA 的构建
以pHsh-xynA2为模板,利用相应的上下游引物xynA-N 和xynA-C 进行PCR,扩增出基因线性pHshxynA2,约3 000 bp(图2A),磷酸化处理后的xarB基因大小为2 300 bp(图2A)。将线性pHsh-xynA2和磷酸化处理后的xarB进行连接,采用XhoI 单酶切表达质粒pHsh-xarB-xynA后释放出5 300 bp 左右的断带,正好是载体pHsh(2 400 bp)与xarB+xynA基因(2 900 bp)的和(图2B)。测序结果显示两基因已插入到正确位置。
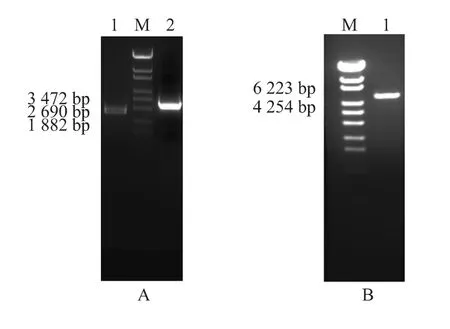
图2 PCR 产物和重组质粒pHsh-xarB-xynA 酶切鉴定Fig.2 PCR products of xarB and pHsh-xynA2 and enzymatic digestion of pHsh-xarB-xynA
2.3 重组多功能半纤维素酶的表达及检测
SDS-PAGE 电泳结果显示,重组菌pHsh-xarBxynA能产生大小约108 000的特异条带,与预期的蛋白相对分子量大小一致(图3)。
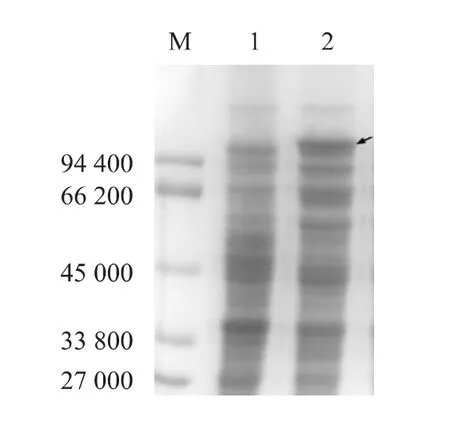
图3 SDS-PAGE 分析重组质粒pHsh-xarB-xynA 在E.coli 中的表达Fig.3 Expression of pHsh-xarB-xynA in E.coli revealed by SDS-PAGE
2.4 游离酶及融合多功能半纤维素酶的动力学参数
游离酶XynA、XarB和融合酶XarB-XynA以OSX,pNPX 和pNPAF 作为底物的动力学参数见表1。如表1 所示,融合多功能半纤维素酶对pNPAF 和OSX的Km值均高于游离酶,而对pNPX 的Km值稍稍低于游离酶;同时,相应的融合多功能半纤维素酶作用于OSX 的Vmax则高于游离酶,而对pNPX 和pNPAF的Vmax值低于游离酶。这些数据表明,融合多功能半纤维素酶立体结构产生的空间位阻分别对木聚糖酶和双活性阿拉伯/木糖苷酶活性产生了不同影响。
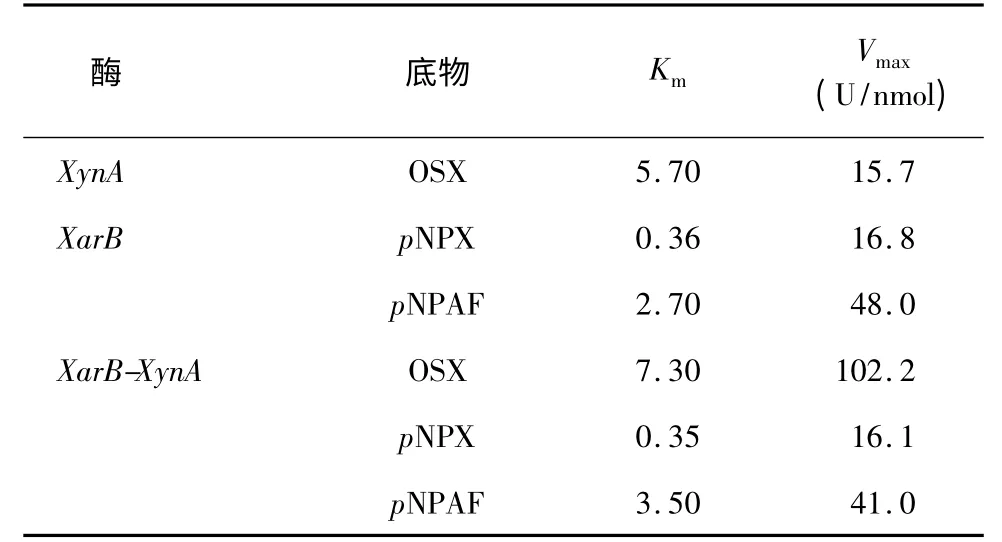
表1 游离酶及融合多功能半纤维素酶的动力学参数Table 1 Kinetic parameters of free and multi-functional enzymes
2.5 活性着色Xyn-SDS-PAGE 分析
由于木聚糖酶基因xynA在融合时放在基因xarB的后面,为了更直观地检测融合后的蛋白是否具有木聚糖酶的活性,可以通过往蛋白胶里添加燕麦木聚糖作为底物,结合刚果红着色后的结果来判断。如图4,纯化后的木聚糖酶和纯化后的融合酶经过跑胶又复性后,仍具有木聚糖酶活性,降解底物后,在胶体目的蛋白的位置上呈现明显的透明区,而其他地方由于燕麦木聚糖没有降解,所以仍然是蓝黑色的。
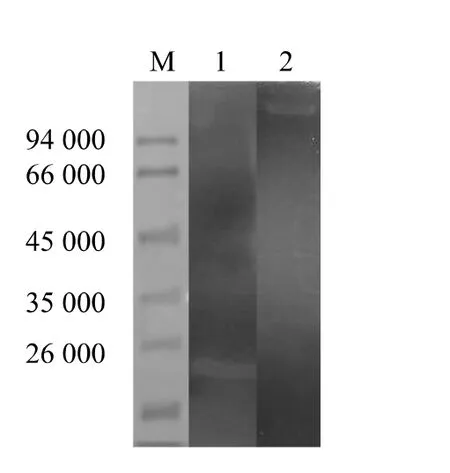
图4 木聚糖酶的Xyn-SDS-PAGEFig.4 Xylanase activity of recombinant protein XarB-XynA rerealed by Xyn-SDS-PAGE
3 讨论
由于木聚糖是高度分支的多糖,其主链和侧链含有不同的侧枝,主要有乙酰基、阿拉伯糖基和葡萄糖醛酸基等;当内切木聚糖酶随机作用木聚糖时便受到这些基团的空间阻碍,而不能到达所作用的木糖苷键,所形成的产物只能是带侧枝的低聚糖。因此,木聚糖的完全降解需要多种水解酶的协同作用。同时使用多种自然克隆到的特异水解某一多糖结构的水解酶来降解木聚糖,虽然清洁高效,但工序复杂,成本高。在不改变酶自身优良性质的条件下,将有关的水解酶融合串联成一个具有多种水解酶活性的多功能酶,或通过融合标签回收重复利用酶,来提高融合酶的综合效率[9-11],这将大大简化工序和降低成本。因此今后我们考虑将木聚糖降解需要的其他类型水解酶进行基因融合,用基因工程和蛋白工程的手段得到多功能、高效率、耐高温的降解木聚糖的融合酶。
构建合适的嗜热菌的外源基因表达系统,高效率地表达一些耐热酶,一直是人们研究的热点。pHsh 作为一种新型表达载体,通过热激就可以高效表达外源基因,与传统的化学诱导剂如IPTG 相比,热激诱导大幅度减少基因诱导表达时的成本,这无疑在工业化应用中具有巨大的优越性和现实意义[13-14]。本研究中pHsh 系统成功表达了来源于嗜热厌氧乙醇菌T.ethanolicusJW200 的双活性阿拉伯/木糖苷酶(XarB)。由于该酶的编码基因含有较多的稀有密码子,因此在将来的工作中还可将这些稀有密码子定点突变成大肠杆菌的优势密码子,通过对表达质粒的TIR 区域进行mRNA 二级结构分析,优化mRNA 二级结构,以进一步提高其表达水平。
[1] 邓 惠,陈 淼,刁晓平,等.蚯蚓处理甘蔗渣和牛粪混合废弃物的初步研究[J].江苏农业科学,2013,41(9):329-331.
[2] BASTAWDE K B.Xylan structure,microbial xylanase,and their mode of action[J].World J microbiol Biotechnol,1992,8:353-368.
[3] YIN E K,LE Y L,PEI J J,et al.High-level expression of the xylanase fromThermomyces lanuginosusinEscherichia coli[J].World J Microbiol Biotechnol,2008,24 (2):275-280.
[4] XUE Y M,LU C,MAO Z G,et al.Cloning and expression of arabinofuranosidase/xylosidase gene ofThermoanaerobacter ethanolicusinEscherichia coliand stability of expression products[J].J China Agri Univ,2003,8(5):9-13.
[5] LI W,ZHANG W W,YANG M M,et al.Cloning of the thermostable cellulase gene from newly isolatedBacillus subtilisand its expression inEscherichia coli[J].Molecular Biotechnology,2008,40(2):195-201.
[6] BANEYX F.Recombinant protein expression inEscherichia coli[J].Curr Opin Biotechnol,1999,10(5):411-421.
[7] 蒋钰瑶,何嘉荣,王未未,等.新型大肠杆菌高效表达载体pHsh 的构建与应用[J].微生物学通报,2012,39(3):394-400.
[8] JIANG Y,ZHOU Q,WU K,et al.A highly efficient method for liquid and solid cultivation of the anaerobic hyperthermophilic eubacteriumThermotoga maritima[J].FEMS Microbiol Lett,2006,259(2):254-259.
[9] MACY J M,SNELLEN J E,HUNGATE R E.Use of syringe methods for anaerobiosis[J].J Clin Nutr,1972,25(12):1318-1323.
[10] SHAO W L,WU H W,PEI J J.Novel expression vector system regulated by sigma32 and methods for using it to produce recombinant protein:US,US 2007/ 0254335A1[P].2007-11-07.
[11] WU H W,PEI J J,WU G G,et al.Overexpression of GH10 endoxylanaseXynBfromT.maritimainE.coliby a novel vector with potential for industrial application[J].Enzyme Microb Technol,2008,42(3):230-234.
[12] WU H W,PEI J J,JIANG Y,et al.pHsh vectors,a novel expression system ofEscherichia colifor the large-scale production of recombinant enzymes[J].Biotechnology Letters,2010,42(3):795-801.
[13] LU P,FENG M G,LI W F,et al.Construction and characterization of a bifunctional fusion enzyme ofBacillus-sourced β-glucanase and xylanase expressed inEscherichia coli[J].FEMS Microbiol Lett,2006,261(2):224-230.
[14] JIN M A,YOUNG K K,WOO J L,et al.Evaluation of a novel bifunctional xylanase-cellulose constructed by gene fusion[J].Enzyme Microb Technol,2005,36(7):989-895.
