不结球白菜氮代谢关键酶在不同氮素条件下的表达分析
2014-12-23孙菲菲李建刚侯喜林
孙菲菲, 李建刚, 王 夏, 王 强, 侯喜林
(1.南京市蔬菜科学研究所,江苏 南京210042;2.南京农业大学作物遗传与种质创新国家重点实验室,江苏 南京210095;3.中国科学院土壤环境与污染修复重点实验室,中国科学院南京土壤研究所,江苏 南京210008)
在蔬菜生产中,氮素营养是影响蔬菜产量和品质的关键因素。众所周知,NO-3的同化是蔬菜作物获取氮素营养的主要途径。硝酸还原酶(NR)是NO-3同化步骤中的第一个酶,也是整个同化过程的限速酶,在植物氮素代谢过程中起关键作用[1]。植物吸收利用环境中的NO3-,需经过2 个同化反应步骤:首先由NR将NO3-还原为亚硝态氮(NO2-),然后再由亚硝酸还原酶(NiR)将NO-2还原为NH+4 ,才能进一步进行氨基酸及蛋白质的合成。氨的初始同化发生在GS/GOGAT(谷氨酸合成)循环中,该循环承担着氮代谢的中心作用[2],而谷氨酰胺合成酶(GS)是处于氮代谢中心的多功能酶,参与多种氮代谢的调节[3]。一些学者研究认为追施外源氮素能够提高植物叶片NR和GS的活性[4-5]。王月福等[3]报道纯氮对提高冬小麦叶片NR和GS的活性以及籽粒蛋白质含量有促进作用。柴小清等[5]研究发现NO-3-N 和NH+4-N 能够显著提高小麦GS及NR的活性。但是,在分子水平上研究氮代谢关键酶的基因表达在国内鲜有报道。
不结球白菜是喜硝态氮的蔬菜,在其栽培过程中适量施用硝态氮可大大提高其产量和品质,但是过量的硝酸盐供应可导致土壤中高硝酸盐残留而使土壤受到污染。本试验通过实时定量PCR 法,在转录水平上研究氮代谢关键酶(硝酸还原酶、亚硝酸还原酶和谷氨酰胺合成酶)基因在NO-3-N 和NH+4-N 2 种不同形态氮素条件下以及NO-3-N 不同浓度和时间处理下的表达变化,在分子水平上揭示氮素条件和氮代谢关键酶基因表达的关系,为不结球白菜的优质育种和科学栽培提供参考依据。
1 材料与方法
1.1 植物材料
植物材料为不结球白菜品种苏州青,由南京市蔬菜科学研究所提供。种子消毒后催芽,播在装有蛭石和珍珠岩的育苗盘中,出苗后浇去离子水,7 d 后浇1/4 Hoagland 营养液,至幼苗长至3 片真叶时使用。
1.2 方法
1.2.1 处理方法 营养液配方以1/2 浓度Hoagland 营养液配方[6]为基础,并加以改进。NO3- 以Ca(NO3)2和KNO3为硝态氮源;NH4+以(NH4)2SO4为铵态氮源。硝态氮营养液的组成成分如下:
Ca (NO3)2·4H2O 590.00 mg/L、KNO3253.00 mg/L、KH2PO468.00 mg/L、MgSO4·7H2O 347.00 mg/L、H3BO31.43 mg/L、MnSO4·4H2O 1.07 mg/L、ZnSO4·7H2O 0.11 mg/L、CuSO4·5H2O 0.04 mg/L、(NH4)Mo7O24·4H2O 0.01 mg/L、Na2Fe-EDTA(乙二胺四乙酸铁钠盐)12.00 mg/L,硝态氮的浓度依次为0、10 mg/L、20 mg/L、30 mg/L、40 mg/L。铵态氮营养液配方中以(NH4)2SO4、CaCl2和KCl 代替Ca(NO3)2和KNO3,其他组分与硝态氮营养液相同,铵态氮的浓度分别为5 mg/L和10 mg/L。为了维持营养液中NO3-和NH4+的浓度及离子平衡,用0.1 mmol/L KOH 和0.1 mmol/L HCl 调 节pH 值 至6.5 ~6.8。分别用上述7 种营养液培养幼苗,以1/2浓度Hoagland 营养液培养的幼苗为对照。4 h 后同时采集对照及各处理的根系及叶片,保存于-70 ℃冰箱。另外,使用NO3--N 浓度为30 mmol/L的营养液对幼苗进行培养,分别在处理0 h(对照)、2 h、4 h、6 h、8 h、12 h 时同时采集对照与各处理幼苗的根系和叶片,作为试验材料。考虑到光照对基因表达的影响,在每一个处理过程中都给予持续光照。
1.2.2 RNA 提取和鉴定 总RNA 提取按T Simple RNA 提取试剂盒(美国Bioflux 公司)说明书进行。根据OD260/OD280比值判定RNA 样品的纯度满足实时定量PCR 的要求。
1.2.3 sscDNA 的合成 反转录反应参照大连TaKaRa 生物公司的TaKaRa RNA PCR Kit(AMV)Ver.2.1 试剂盒说明书进行。
1.2.4 引物设计 目的基因包括不结球白菜硝酸还原酶基因(BcNR)、亚硝酸还原酶基因(BcNiR)、细胞质型谷氨酰胺合成酶基因(BcGS1)和 叶绿体型谷氨酰胺合成酶基因(BcGS2),引物序列见表1。内标基因选用不结球白菜Actin基因,引物为:反向5'-GTTGCTATCCAGGCTGTTCT-3'和正向5'-AGCGTGAGGAAGAGCATAAC-3',PCR 产物长度为118 bp。
1.2.5 实时定量PCR 采用实时定量PCR 法在Roter Gene 3000 real-time PCR 仪(Gene 公司)上进行上述基因的表达分析,以对照根系中基因的表达作为标准,数值设为1,其余样本为其相对表达值BcGS1只在根系中检测,以对照根系中该基因的表达作为标准。BcGS2只在叶片中检测,以对照叶片中该基因的表达作为标准,每个样品设置3 次重复。使用TaKaRa 公司的SYBR PremixEx TaqTM试剂盒进行实时定量PCR 检测。反应体系为25 μl 反应混合物,每个引物最终浓度为400 nmol/L。热启动程序为:95 ℃变性2 min;95 ℃10 s,57℃(BcNR)、56 ℃(BcNiR)、55 ℃(BcGS1)、56 ℃(BcGS2)20 s,72 ℃20 s,共40 个循环。数据由Roter Gene 6.0(Gene 公司)和Excel 软件分析。

表1 目的基因引物序列Table 1 Primer sequences of genes of interest
2 结果
2.1 不同氮素条件对BcNR 基因表达的影响
2.1.1 NO3--N 由图1A 可见,叶片中BcNR基因的转录明显高于根系,几乎是根系的4 倍之多。但无论是根系还是叶片中,在0 ~30 mmol/L NO3--N处理4 h 条件下,BcNR基因的表达均随NO3--N 浓度的增加而增加,在30 mmol/L NO3--N 诱导条件下达到最大值,此时叶片中的BcNR的表达与对照相比增加了3.2 倍,根系中也增加了2 倍。40 mmol/L NO3--N诱导条件下,BcNR基因的表达较对照增加,但是低于30 mmol/L 下的表达量。说明太高浓度的NO3--N 反而不利于BcNR基因的表达。
以含30 mmol/L NO3--N 的营养液对不结球白菜根系和叶片的BcNR基因持续诱导,叶片中BcNR基因的表达在诱导4 h 时达到最大,几乎是对照的4倍之多,而根系中的BcNR基因在诱导6 h 的表达量最大,之后随着时间的延长均持续下降,到诱导12 h时根系BcNR基因表达量是对照的近9 倍,而叶片中比对照高1.2 倍(图1B)。
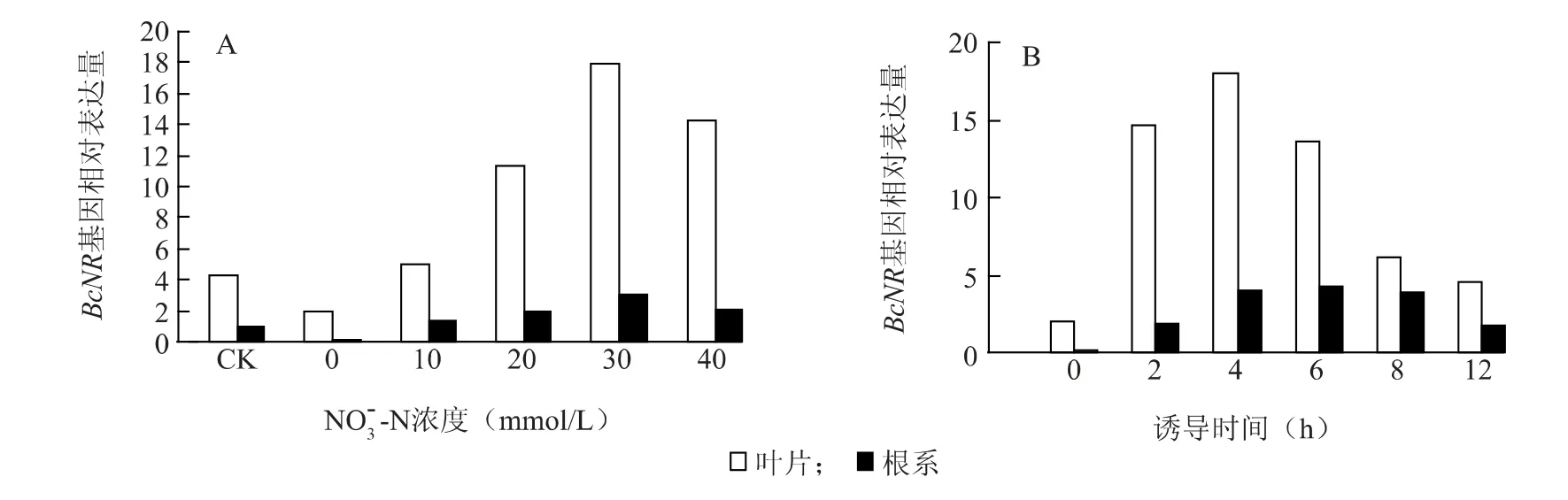
图1 NO -3 -N 浓度(A)和持续诱导时间(B)对BcNR 基因表达量的影响Fig.1 Concentrations(A)and induction time of duration(B)of NO -3 -N on BcNR gene expression in the leaves and roots of non-heading Chinese cabbage
2.1.2 NH4+-N 5 mmol/L 的NH4+-N 对根系和叶片中BcNR的表达水平影响不大,10 mmol/L的NH4+-N 对其表达产生了很大的抑制作用,根系中BcNR的表达下降了约50%,而叶片中下降了约40%(图2)。
2.2 不同氮素条件对BcNiR 基因表达的影响
在不同氮素条件下,BcNiR基因的表达与BcNR呈现出几乎相同的变化规律。
2.2.1 NO3--N 根系和叶片中BcNiR基因都是在30 mmol/L NO3--N 浓度下达到最大表达量,根系中相对于对照增加了1.8 倍,叶片中也增加了3 倍;40 mmol/L NO3--N 下的BcNiR的表达量较30 mmol/L略有下降(图3A)。

图2 NH 4+ -N 浓度对不结球白菜根系和叶片BcNR 基因表达的影响Fig.2 Effects of NH 4+ -N concentrations on BcNR expressions in the leaves and roots of non-heading Chinese cabbage
以含30 mmol/L NO-3-N 的营养液对不结球白菜根系和叶片的BcNiR基因持续诱导,无论在根系还是叶片中BcNiR的表达都是在4 h 达到最大值,6 h 时虽然有所下降,但是下降幅度很小,与BcNR的表达相比,BcNiR在12 h 的叶片中仍然有很高的表达量,几乎达到对照的5.2 倍(图3B)。
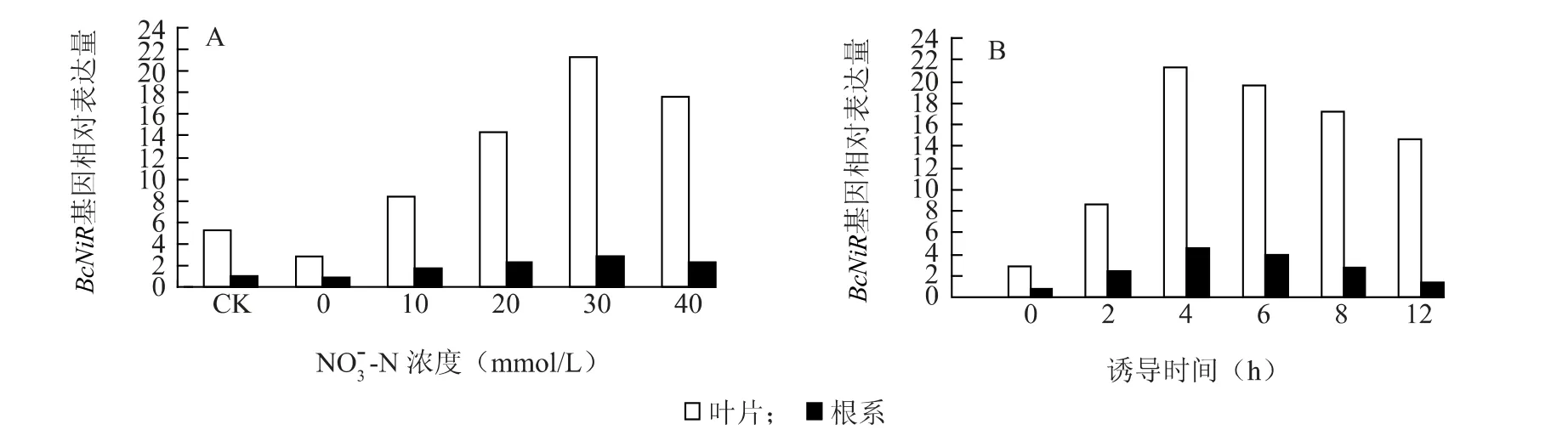
图3 NO 3- -N 浓度(A)和诱导时间(B)对不结球白菜根系和叶片BcNiR 基因表达的影响Fig.3 Effect of NO 3- -N concentrations(A)and induction time of duration(B)of NO 3- -N on BcNiR expression in the leaves and roots of non-heading Chinese cabbage
2.2.2 NH4+-N NH4+-N 诱导同样对BcNiR基因的表达有一定的抑制作用,在5 mmol/L NH+4 -N 诱导条件下,根系和叶片中该基因的表达量下降了约20%,在10 mmol/L NH+4 -N 处理下,下降了约50%(图4)。
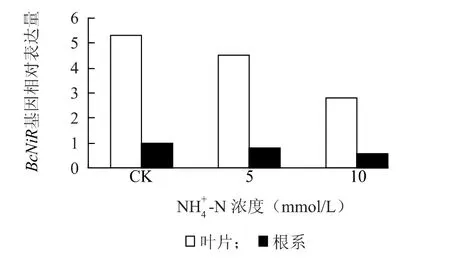
图4 NH 4+ -N 浓度对不结球白菜根系和叶片BcNiR 基因表达的影响Fig.4 Effect of NH 4+ -N concentrations on BcNiR expressions in the leaves and roots of non-heading Chinese cabbage
2.3 不同氮素条件对根系中BcGS1 基因表达的影响
2.3.1 NO3--N NO3--N 诱导促进了BcGS1基因的表达,20 mmol/L NO3--N 诱导使BcGS1基因的表达量达到最大,30 mmol/L 下该基因的表达与20 mmol/L 相近,40 mmol/L 时虽有所下降,仍达到对照的3.6 倍(图5A)。
在NO3--N 诱导前期随着时间的延长BcGS1基因的表达逐渐增加,到6 h 达到最大值,达到对照的17 倍,后期的诱导反而使BcGS1基因的表达持续下降(图5B)。
2.3.2 NH4+-N NH4+-N 促进了BcGS1基因的表达,5 mmol/LNH4+-N 诱导使BcGS1基因的表达提高 了139% ,10 mmol/LNH4+-N诱导使BcGS1基因的表达提高了236% (图6)。
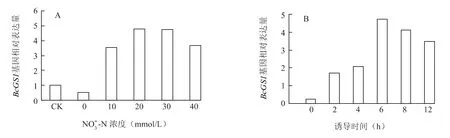
图5 NO -3 -N 浓度(A)和处理时间(B)对不结球白菜根系BcGS1 基因表达的影响Fig.5 Effects of NO -3 -N concentrations(A)and induction time of duration(B)of NO -3 -N on BcGS1 expression in the root of non-heading Chinese cabbage
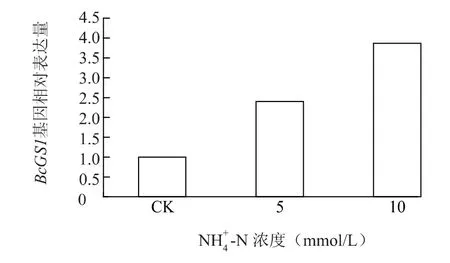
图6 不同NH 4+ -N 浓度对不结球白菜根系BcGS1 基因表达的影响Fig.6 Effects of NH 4+ -N concentrations on BcGS1expressions in the root of non-heading Chinese cabbage
2.4 不同氮素条件对叶片中BcGS2 基因表达的影响
2.4.1 NO3--N NO3--N 对BcGS2基因的表达具有一定的促进作用。由图7A 可见,0 ~20 mmol/LBcGS2基因的表达随着NO3--N 浓度的增大而增加,20 mmol/L NO3--N 诱导使BcGS2基因的表达增加近7 倍,NO3--N 浓度高于20 mmol/L后,BcGS2基因的表达水平不再增加。说明适当提高氮素浓度可以有效促进GS2基因表达,提高叶片中GS酶的浓度,从而降低叶片中NH4+的浓度,提高同化吸收氮素的效率。
随着NO3--N 诱导时间的延长,BcGS2基因的表达量持续上升,直到12 h 仍没有下降的趋势,但上升幅度明显减少。
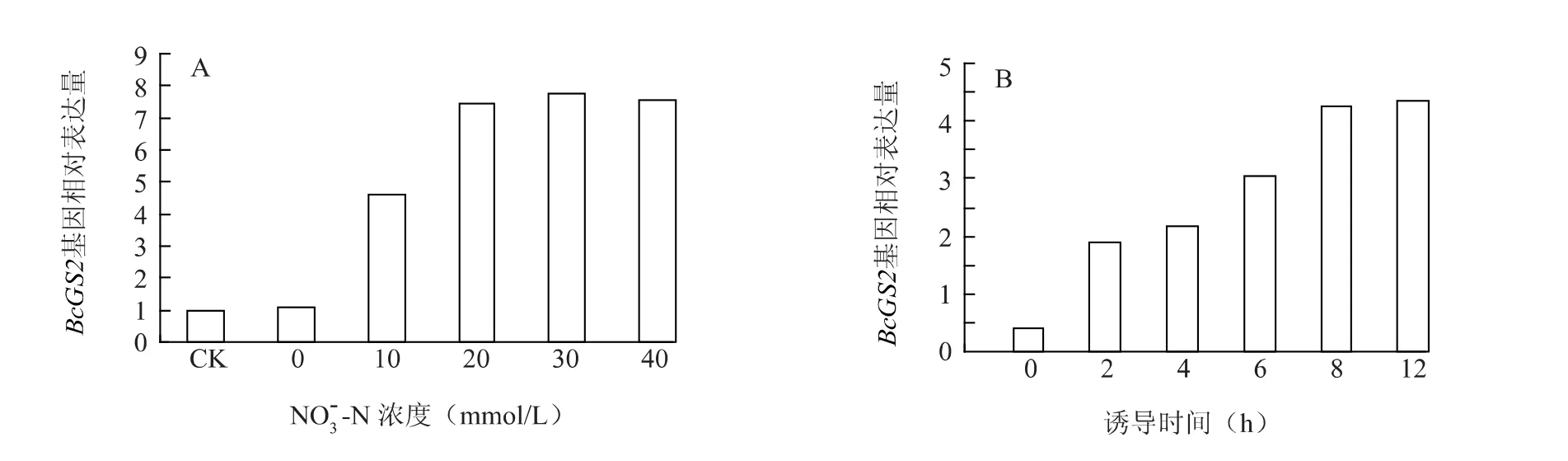
图7 NO 3- -N 浓度(A)和诱导时间(B)对不结球白菜叶片BcGS2 基因表达的影响Fig.7 Effects of NO3- -N concentrations(A)and induction time of duration on BcGS2 expression in the leaves of non-heading Chinese cabbage
2.4.2 NH4+-N NH4+-N 诱导显著促进了BcGS2基因的表达,5 mmol/L NH4+-N 诱导使该基因的表达量增加了68%,10 mmol/L NH4+-N 诱导使其增加了133%(图8)。

图8 NH 4+ -N 浓度对不结球白菜叶片BcGS2 基因表达的影响Fig.8 Effects of NH 4+ -N concentrations on BcGS2 expressions in the leaves of non-heading Chinese cabbage
3 讨论
硝酸还原酶(NR)是植物NO3-同化的关键酶,植物体内硝酸还原酶活力的高低直接影响介质中NO3-的利用,是作物的营养指标之一[7]。硝酸还原酶基因的表达受到很多外界因子的调控,如NO3-[8]、谷氨酰胺[9]、NO2-[10]、碳代谢产物[11]等。在高等植物中,NO3-是诱导植物硝酸还原酶体内合成的最重要因子,NO3-对硝酸还原酶的调控研究也最多。NO3-能诱导硝酸还原酶的表达,这在很多作物上己经得到证实,如拟南芥[12-13]、烟草[14]、油菜[15]等。本研究中,NO3-诱导了不结球白菜硝酸还原酶BcNR和亚硝酸还原酶BcNiR两个基因的表达,说明NO3-的诱导作用发生在转录水平上,这与Crawford[16]的结论一致。
Miyazaki[17]将大麦在无氮条件下培养7 d,然后转移到15 mmol/L 硝酸盐介质中培养,硝酸盐诱导2 h 后NR 基因即表达。本研究中在30 mmol/L NO3--N的诱导下,BcNR在2 h 就有很高的表达,说明硝酸盐对BcNR基因的诱导具有瞬时效应。30 mmol/L NO3--N 诱导4 h 可使BcNR基因的表达达到高峰,高于30 mmol/L或长于4 h 的诱导都不能再提高BcNR的表达。这可能是由于NO-3-N 刺激BcNR基因的表达从而增加了酶蛋白的合成,使硝酸盐的同化效率增加,进而产生了较多的氮代谢产物如NH+4、谷氨酰胺、天冬酰胺等,这些代谢产物的积累对BcNR基因的表达产生了反馈抑制作用[18-20]。Andrea 等[14]也认为,谷氨酰胺和(或)天冬酰胺的体内积累对NR基因表达有负调控作用。因此,高浓度(10 mmol/L)的NH4+-N 处理降低了BcNR基因的表达。本研究发现,无论是NO3--N 还是NH4+-N 处理,BcNiR与BcNR在根系和叶片中表现出几乎相同的表达模式,意味着它们在各自的启动子区共享一个调节元件,这与Back等[21]在菠菜上的报道一致。
GS存在多种同功酶,根据其在亚细胞的定位,可以分为胞液型GS1和质体型GS2。GS1在植物的根中大量存在,其主要功能是催化根中硝酸盐还原的铵和从土壤中吸收的铵同化成有机形态氮[22];GS2普遍存在于植物叶片的叶绿体中,其不但在硝酸还原生成的NH+4的初级同化起作用,更重要的是负责光呼吸过程中和氨基酸代谢产生的NH+4的再同化,在高等植物吸收同化氮素的过程中发挥着重要作用[23]。因此,我们在根系中只检测BcGS1的表达,而BcGS2的表达只在叶片中检测。植物以硝态氮为氮源时,需通过硝酸还原酶和亚硝酸还原酶把NO3-还原为NH4+,这2 种酶即成为影响植物吸收氮素和GS的主要因素。本研究以NO3--N 为外部氮源时,处理初期可以明显促进根系中BcGS1基因的表达,且表达水平随着氮浓度的增大而增加。这可能是由于根系中吸收了大量的NO3-,而NO3-是硝酸还原酶的底物,NO3-可以促进BcNR和BcNiR基因的表达同时刺激它们的活性,在根部累积大量的NH4+,从而促进了BcGS1基因的表达。叶片中BcGS2基因的表达也受到NO3--N 的诱导,这是因为NO3-可以通过茎维管系统直接运输至叶片,进而刺激叶片中大量的NO3-还原为NH4+,从而提升了叶部NH4+的水平,促进了BcGS2基因的表达。随着硝态氮处理时间的增加,不结球白菜根系中的BcGS1的转录水平呈现下降趋势。因为植物同化氮素营养的能力除了和GS基因表达有关之外,还和GS酶的活性息息相关。Hayakawa 等研究证实,NO3-在水稻幼苗期即可提高GS2的活性,在72 h后更加促进GS2的活性[24]。也就是说,NO3-对GS2的活性起到促进作用。不结球白菜在用硝态氮处理后,随着时间的推移,BcGS1基因的表达下降也可能与其活性的大幅度提升有关,我们推测延长处理时间BcGS2基因的表达可能也会下降。
高等植物中,外源氮对氮素同化酶表达的影响因植物种类、组织器官、环境的差异以及氮源的不同而有别[25-26]。植物缺少氮素不是因为土壤中缺乏氮素,而是植物将无机态氮转化为有机态氮的能力小[27]。硝酸还原酶、亚硝酸还原酶、谷氨酰胺合成酶是植物氮代谢过程中的关键酶,这些酶基因的高效表达有利于植物对氮的高效利用,从而在低氮肥条件下促进植物的生长。
[1] ALLING M J,BOLAND G,WILLSON J H.Relation between acid proteinase activity and redistribution of nitrogen during grain development in wheat[J].Plant Physiol,1976,3:721-730.
[2] VERMA D P.S1 control of plant gene expression[M].Boca Raton:CRC Press,1993:443-458.
[3] 王月福,于振文,李尚霞,等.氮素营养水平对冬小麦氮代谢关键酶活性变化和籽粒蛋白质含量的影响[J].作物学报,2002,28(6):743-748.
[4] 李豪哲.大豆叶片硝酸还原酶活力的研究[J].植物生理学通讯,1986 (4):30-32.
[5] 柴小清,印莉萍,刘祥林,等.不同浓度的NO3
-和NH4+对小麦根谷氨酰胺合成酶及其相关酶影响[J].植物学报,1996 ,38 (10):803-808.
[6] 连兆煌,无土栽培原理与技术[M].北京:中国农业出版社,1994:50-59.
[7] 张瑞珍,张恩和,孙长占.不同基因型玉米品种氮素营养效率差异的研究[J].吉林农业大学学报,2003,25(2):183-186.
[8] MUNZAROVA E,LORENZEN B,BRIX H,et al.Effect of NH4+ /NO3
- availability on nitrate reductase activity and nitrogen accumulation in wetland helophytesPhragmites australisandGlyceria maxima[J].Environmental and Experimental Botany,2006,55:49-60.
[9] VINCENTZ M,MOUREAUX T,LEYDECKER M T.Regulation of nitrate and nitrite reductase expression inNicotiana plumbaginifolialeaves by nitrogen and carbon metabolites[J].Plant Journal,1993,3(2):315-324.
[10] DOMINIQUE L,PASCAL T,ALAIN G.Gene expression of the NO3-transporter NRTl.l and the nitrate reductase NIAl is repressed inArabidopsisroots by NO2-,the product of NO3-reduction[J].Plant Physiol,2003,132:958-967.
[11] ZOU D H.Effects in the economic brown of elevated atmospheric CO2on growth,photosynthesis and nitrogen metabolism seaweed[J].Aquaculture,2005,250:726-735.
[12] WANG R,GUEGLER K,LABRIE S T,et al.Genomic analysis of a nutrient response inArabidopsisreveals diverse expression patterns and novel metabolic and potential regulatory genes induced by nitrate[J].Plant Cell,2000,12(8):1491-1509.
[13] WILKINSON J Q,CRAWFORD N M.Identification and characterization of a chlorate resistant mutant ofArabidopsiswith mutations in bothNialandNia2nitrate reductase structural genes[J].Mol Gen Genet,1993,239:289-297.
[14] ANDREA M,CHRISTIANE B,DIGER H R.Negative regulation of nitrate reductase gene expression by glutamine or asparagine accumulating in leaves of sulfur-deprived tobacco [J].Planta,2000,211:587-595.
[15] CHEN B M,ZHAO H W,LI S X.Effects of nitrate supply on plant growth,nitrate accumulation,metabolic nitrate concentration and nitrate reductase activity in three leaf vegetables[J].Plant Sci,2004,167:635-643.
[16] CRAWFORD N M.Nitrate:nutrient and signal for plant growth[J].Plant Cel1,1995,7:859-868.
[17] MIYAZAKI J,JURICEK M,ANGELIS K,et al.Charaterization and sequence of a novel nitrate reductase from barley[J].Mol Gen Genet,1991,228:329-334.
[18] FRAISIER V,GOJON V,TILLARD P,et al.Constitutive expression of a putative high-affinity nitrate transporter inNicotiana plumbaginifolia:evidence for post-transcriptional regulation by a reduced nitrogen source[J].Plant Journal,2000,23:489-496.
[19] VIDMAR J J,ZHUO D G,SIDDIQI M Y,et al.Isolation and characterization of HvRNT2.3 and HvRNT2.4 cDNA encoding high affinity nitrate transporter from roots of barley [J].Plant Physiology,2000,122:783-792 .
[20] KRONZUCKER H J,GLASS A D M,SIDDIQI M Y.Inhibition of nitrate uptake by ammonium in barley:analysis of component fluxes[J].Plant Physiol,1999,120:283-292.
[21] BACK E,DUNNE W,SCHNEIIDERBAUER A.Isolation of spinach nitrite reductase gene promoter which confers nitrate reducbility onGUSgene expression in transgenic tobacco[J].Plant Mol Biol,1991,17:9-18.
[22] MIFLIN B J.Nitrite reduction in leaves:studies on isolated chloroplasts[J].Planta,1974,116:187-196.
[23] WEBER A,FLUGGE U I.Interaction of cytosolic and plastidic nitrogen metabolism in plants[J].J Exp Bot,2002,53(370):865-874.
[24] HAYAKAWA T,KAMACHI K.Response of glutamine synthetase and glutamate synthetase isoform to nitrogen sources in rice cell cultures[J].Plant Cell Physiol,1990,31:1071-1077.
[25] OLIVEIRA L C,CORUZZI G M.Carbon and Amino acids reciprocally modulate the expression of glutamine synthetase inArabidopsis[J].Plant Physiol,1999,121(1):301-309.
[26] SAMUELSON M E,CAMPBELL W H,LARASSON C M.The influence of cytokinins in nitrate regulation of nitrate reductase activity and expression in barley[J].Physiologia Plantarum,1995,93 :533-539.
[27] LAM H M,COSCHIAGNO K,CORUZZI G M.Use ofArabidopsismutants and genes to study amide amino acids biosynthesis[J].The Plant Cell,1995,7(7):887-898.
