灰树花漆酶的双水相萃取及酶学性质
2014-12-20虞凤慧徐泽平刘圣鹏冯文娟
虞凤慧 徐泽平,2 刘圣鹏 冯文娟
(1.黄河三角洲京博化工研究院有限公司,山东 滨 州 256500;2.滨州市环境微生物技术工程研究中心,山东 滨 州 256500)
双水相萃取(aqueous two-phase extraction,ATPS)是近年来发展起来的一种分离提取技术,广泛应用于蛋白质[1]、酶等生物活性物质的分离、提取和纯化。该技术具有操作条件温和、容易放大、可连续操作[2],且无有机溶剂残留等优点[3,4]。更重要的是双水相萃取避免了传统液—液萃取中生物活性物质与有机溶剂的直接接触,保护了其活性[5],有研究[6]表明聚合物对颗粒或生物分子的结构不但没有破坏作用,反而有稳定作用。ATPS极具大规模应用的潜力。
漆酶(laccase,EC1.10.3.2)是一种含铜的多酚氧化酶[7,8],具有独特的催化特性。在污水处理、食品加工、纸浆造纸、纺织等工业[9,10]以及有机合成等化学反应中具有巨大的应用前景,因此,随着对其研究的逐渐深入,已成为当今的热门研究课题之一[11]。漆酶广泛分布于植物、真菌、少数昆虫和细菌中[12,13]。在真菌中,担子菌是目前获得漆酶的主要来源。灰树花(Grifolafrondosa)属担子菌亚门、层菌纲、非褶菌目、多孔菌科、树花菌属[14],是一种药食两用珍稀菇类。灰树花能分泌多种具有生物活性的代谢产物[15],一直以来,对它的研究多集中于灰树花多糖,而对灰树花漆酶的研究尚不多见。目前,灰树花漆酶的生产技术极不成熟,产品鲜有报道,主要是因为其酶活力通常很低,更重要的是提取、分离、精制效率低、酶易失活,这些问题亟待解决。传统方法,如盐析、微滤、超滤、离子交换层析等方法纯化漆酶,一般回收率低。与传统方法相比,ATPS法简单易行,易于除去杂质,提高酶的纯度且回收率高,有较大的工业应用潜力[16]。本试验选择PEG6000/(NH4)2SO4双水相体系对灰树花漆酶进行萃取分离效果的研究,同时对纯化后的灰树花漆酶进行酶学性质的研究。为灰树花漆酶的大规模生产、分离提取及应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种
灰树花(Grifolafrondosa)GF-931菌株:本实验室保存。
1.1.2 培养基
种子培养基:土豆1%,麸皮2%,葡萄糖2%,玉米粉0.5%,蛋白胨 0.3%,酵母浸粉 0.15%,磷酸二 氢钾 0.05%,硫酸镁0.1%;
液体发酵培养基:土豆15%,可溶性淀粉1.5%,酵母浸粉0.3%,硫酸铵0.1%,磷酸二氢钾0.05%,硫酸镁0.1%,硫酸铜0.012%。
1.1.3 主要试剂
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):分析纯,美国Sigma公司;
聚乙二醇(PEG)6000:化学纯,天津市科密欧化学试剂有限公司;
硫酸铵:分析纯,天津市凯通化学试剂有限公司;
冰醋酸:分析纯,天津市科密欧化学试剂有限公司;醋酸钠:分析纯,天津市博迪化工股份有限公司。
1.1.4 仪器
低速大容量离心机:DL-5型,上海安亭科学仪器厂;
紫外可见分光光度计:UV-1700型,岛津(苏州)有限公司;
精密pH计:PHS-3C型,上海仪电科学仪器股份有限公司;
数显恒温水浴锅:HH-1型,江苏省金坛市荣华仪器制造有限公司;
电子天平:FA2004型,上海仪电科学仪器股份有限公司。
1.2 方法
1.2.1 灰树花漆酶粗酶液的制备
(1)种子培养:无菌条件下,取适量新鲜的PDA斜面保藏菌种接入种子培养基中,于28℃、200r/min条件下培养2 d,即为一级种子液。
无菌条件下,将适量一级种子液转接至种子培养基中,于28℃、200r/min条件下培养2d,即为二级种子液。
(2)液体发酵培养:无菌条件下,按10%的接种量,将二级种子液转接至发酵培养基中,于28℃、200r/min条件下培养8d,发酵液经4 000r/min离心10min,收集上清液,即为漆酶粗酶液,4℃保存备用。
1.2.2 双水相体系相图的绘制 精确配制40%(m/V)的(NH4)2SO4和80%PEG6000溶液。取一定量已配制好的PEG6000于一洁净试管中,加入0.5mL蒸馏水,缓慢滴加已配制好的(NH4)2SO4溶液,混匀,至试管内溶液开始出现混浊为止,记录加入(NH4)2SO4的体积和质量。然后计量加入适量蒸馏水,使体系澄清,继续向试管中滴加(NH4)2SO4溶液,使其再次达到混浊,如此反复操作。计算每次达到混浊时PEG6000和(NH4)2SO4在系统总量中的质量分数。以PEG6000的质量分数为纵坐标,(NH4)2SO4的质量分数为横坐标作图,即得到一条双节线[17]。
1.2.3 双水相萃取方法 根据双水相体系相图,选择可形成双水相的PEG6000与(NH4)2SO4的浓度。固定体系总质量为20g,向其中加入一定量的PEG6000、(NH4)2SO4溶液至所需质量分数,不足部分以蒸馏水补充,振荡混匀。然后向双水相体系中加入酶液至所需质量分数,振荡混匀2min。4 000r/min离心1 0min使快速分相。读取上、下相体积及测定酶活,按式(1)~(3)计算相体积比、酶分配系数和酶活收率。

式中:
R——相体积比;
V上——上相体积,mL;
V下——下相体积,mL。

式中:
K——酶分配系数;
U上——上相酶活,U/mL;
U下——下相酶活,U/mL。

式中:
Y——酶活收率,%;
R——相体积比;
K——酶分配系数。
1.2.4 双水相萃取条件的优化
(1)酶液添加量对漆酶萃取效应的影响:根据双水相体系相图,将质量分数为50%的PEG6000和质量分数为40%的(NH4)2SO4溶液配制成可形成双水相的浓度,按不同的添加量分别加入漆酶粗酶液,组成不同的双水相体系,进行酶液添加量对漆酶萃取效应影响的研究。
(2)PEG 6000质量分数对漆酶萃取效应的影响:以酶液的最佳添加量为基础,将质量分数为40%的(NH4)2SO4和质量分数为50%的PEG6000溶液配制成一系列含不同质量分数PEG的双水相体系,研究PEG6000质量分数对漆酶萃取效应的影响。
(3)(NH4)2SO4质量分数对漆酶萃取效应的影响:以酶液的最佳添加量、PEG6000最佳质量分数为基础,将质量分数为50%的PEG6000和质量分数为40%的(NH4)2SO4溶液形成一系列含不同质量分数(NH4)2SO4的双水相体系,研究(NH4)2SO4质量分数对漆酶萃取效应的影响。
(4)双水相体系pH对漆酶萃取效应的影响:以酶液的最佳添加量、PEG6000最佳质量分数、(NH4)2SO4最佳质量分数为基础,调节双水相体系pH 分别为3.5,4.5,5.0,5.5,6.0(自然),研究体系pH对漆酶萃取效应的影响。
(5)正交试验:根据单因素试验结果,选择影响漆酶萃取效应的主要因素,设计正交试验,确定最佳萃取条件。
1.2.5 漆酶酶活的测定 参照文献[18],修改如下:将漆酶酶液用0.05mol/L、pH 5的醋酸—醋酸钠缓冲液稀释至适当倍数,于30℃水浴锅中保温7min,取2.3mL稀释酶液于比色皿中,再加入0.7mL 1mM ABTS溶液,两者迅速混匀,启动反应。于420nm下测定反应液前2min内吸光值的变化△A,按式(4)计算酶活。酶活定义为每秒钟氧化1 nmol ABTS所需要的酶量为一个活力单位U。

式中:
XL——酶活,U/mL;
△A——2min内吸光度的变化;
V1——总反应体积,3mL;
ε——ABTS吸光系数,0.036mL/(nmol/cm);△T——反应时间,120s;
V2——酶液体积,2.3mL;
I——光程,1cm;
n——稀释倍数。
1.2.6 漆酶的酶学性质研究
(1)漆酶的最适反应温度:经双水相萃取纯化后,按照1.2.5方法测定纯化漆酶酶活。设定漆酶的不同反应温度为30,35,45,55,65,75,100 ℃,以 测 定 的 最 高 酶 活 力 作 为100%,计算其他不同温度下漆酶的相对酶活。
(2)漆酶的热稳定性:设定漆酶的保温温度分别为30,35,45,55,65,75,100℃,分别保温2h,按照1.2.5方法测定纯化漆酶剩余酶活力,以最高酶活力作为100%,计算不同温度下漆酶剩余酶活力的相对酶活。
(3)漆酶的最适反应pH:用0.05mol/L醋酸和醋酸钠溶液分别配制成pH 2.97,3.50,4.00,4.50,5.00,5.50,6.00,7.00的缓冲液,并以此不同pH梯度的缓冲液分别稀释漆酶酶液以及配制相应的1mM ABTS底物。在最适反应温度下,按照1.2.5方法测定纯化漆酶酶活,以最高酶活力作为100%,计算不同pH下漆酶的相对酶活。
(4)漆酶的pH稳定性:用0.05mol/L醋酸和醋酸钠溶液分别配制成 pH 2.97,3.50,4.00,4.50,5.00,5.50,6.00,7.00的缓冲液,并以此不同pH梯度的缓冲液分别稀释漆酶酶液以及配制相应的1mM ABTS底物。在最适反应温度下,分别保温2h,按照1.2.5方法测定纯化漆酶剩余酶活力,以最高酶活力作为100%,计算不同pH下漆酶剩余酶活力的相对酶活。
(5)金属离子对漆酶酶活性的影响:用0.05mol/L醋酸和醋酸钠溶液配制最适pH的缓冲液,加入不同的金属盐,配制成金属离子浓度为5mmol/L的缓冲液。在最适温度和最适pH条件下,按照1.2.5方法测定酶活,以不加入金属离子的酶活力作为100%,计算加入不同金属离子的漆酶相对酶活。
2 结果与分析
2.1 PEG6000/(NH4)2SO4体系的相图
由图1可知,此双节线图即为PEG6000/(NH4)2SO4双水相体系的相图。双节线上的点为临界区,线的下方为均相区,线的上方为两相区,即可形成双水相体系,其中T、B点连线称为系线,T为上相组成,B为下相组成,由此可得知形成双水相时PEG6000与(NH4)2SO4质量分数的具体配比关系,以此选择不同的萃取体系进行漆酶萃取效应的研究。
2.2 酶液添加量对漆酶萃取效应的影响

图1 PEG6000/(NH4)2SO4双水相体系相图Figure 1 The phase diagram of aqueous two-phase system PEG6000/(NH4)2SO4
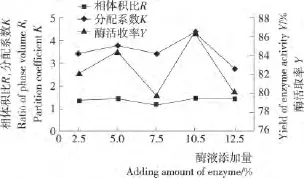
图2 酶液添加量对漆酶萃取效应的影响Figure 2 The effect of adding amount of enzyme on extraction of laccase with aqueous two-phase system
由图2可知,随着漆酶酶液添加量的增加,相体积比变化不明显,分配系数和酶活收率呈先增后减的趋势,当酶液添加量为10%时,分配系数和酶活收率最高,分别为4.4和86.4%,此时漆酶的萃取效果最好。因此,选择酶液的最佳添加量为10%。
2.3 PEG6000质量分数对漆酶萃取效应的影响
由图3可知,随着PEG6000质量分数的增加,相体积比先缓慢增加后趋于平缓,分配系数和酶活收率呈逐渐增大趋势。PEG6000质量分数为22%时,分配系数和酶活收率最高,分别为13.0和95.3%,即漆酶的萃取效果最好。已有研究[19]表明,当(NH4)2SO4质量分数一定时,随着 PEG 质量分数的增加,酶的分配系数增加,酶活收率也同时增加,增加PEG相的质量分数对分离是有利的。因此,选择PEG6000的最佳质量分数为22%。

图3 PEG6000质量分数对漆酶萃取效应的影响Figure 3 The effect of mass fraction of PEG6000on extraction of laccase with aqueous two-phase system
2.4 (NH4)2SO4质量分数对漆酶萃取效应的影响
由图4可知,随着(NH4)2SO4质量分数的增加,相体积比逐渐减小,后趋于平稳,分配系数逐渐增大,而酶活收率呈先减后增趋势,当(NH4)2SO4质量分数为17%时,酶分配系数和酶活收率最高,分别为5.4和85.5%。因此,选择(NH4)2SO4的最佳质量分数为17%。
2.5 pH对漆酶萃取效应的影响
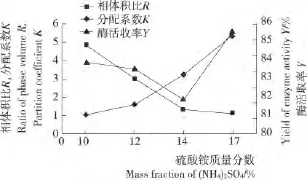
图4 (NH4)2SO4质量分数对漆酶萃取效应的影响Figure 4 The effect of mass fraction of(NH4)2SO4on extraction of laccase with aqueous two-phase system
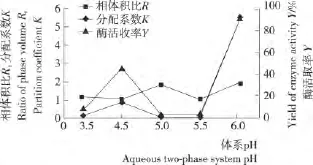
图5 pH对漆酶萃取效应的影响Figure 5 The effect of pH on extraction of laccase with aqueous two-phase system
由图5可知,当调节体系pH为3.5至5.5时,分配系数和酶活收率都很低,而体系pH为6.0(自然)时,分配系数和酶活收率明显增大,分别为5.5和91.1%,因此选择双水相体系最佳pH为自然,即不进行pH调节。
2.6 双水相萃取体系的正交优化
根据单因素试验结果,选择酶液添加量、PEG6000质量分数和(NH4)2SO4质量分数为三因素,按照表1设计L9(33)正交表,正交试验结果见表2。由表2可知,各因素对PEG6000/(NH4)2SO4体系萃取漆酶的影响主次关系为RA>RC>RB,即酶液添加量对萃取效率的影响最大,其次为(NH4)2SO4质量分数和PEG6000质量分数。另外,从极差来看,RD(空列)>RB,说明试验中有一定的误差,是否还有其他因素比PEG6000质量分数对漆酶萃取效果的影响大,有待进一步验证。最优组合为A1B3C2,即当酶液添加量为5%,PEG6000质量分数为25%,(NH4)2SO4质量分数为17%时,漆酶的萃取效果最佳,并在此最佳萃取条件下进行验证实验,得到漆酶的分配系数和酶活收率分别高达7.6和96.6%,说明正交试验优化出的最佳萃取条件较好。

表1 正交试验因素与水平Table 1 Factors and levels for orthogonal design/%
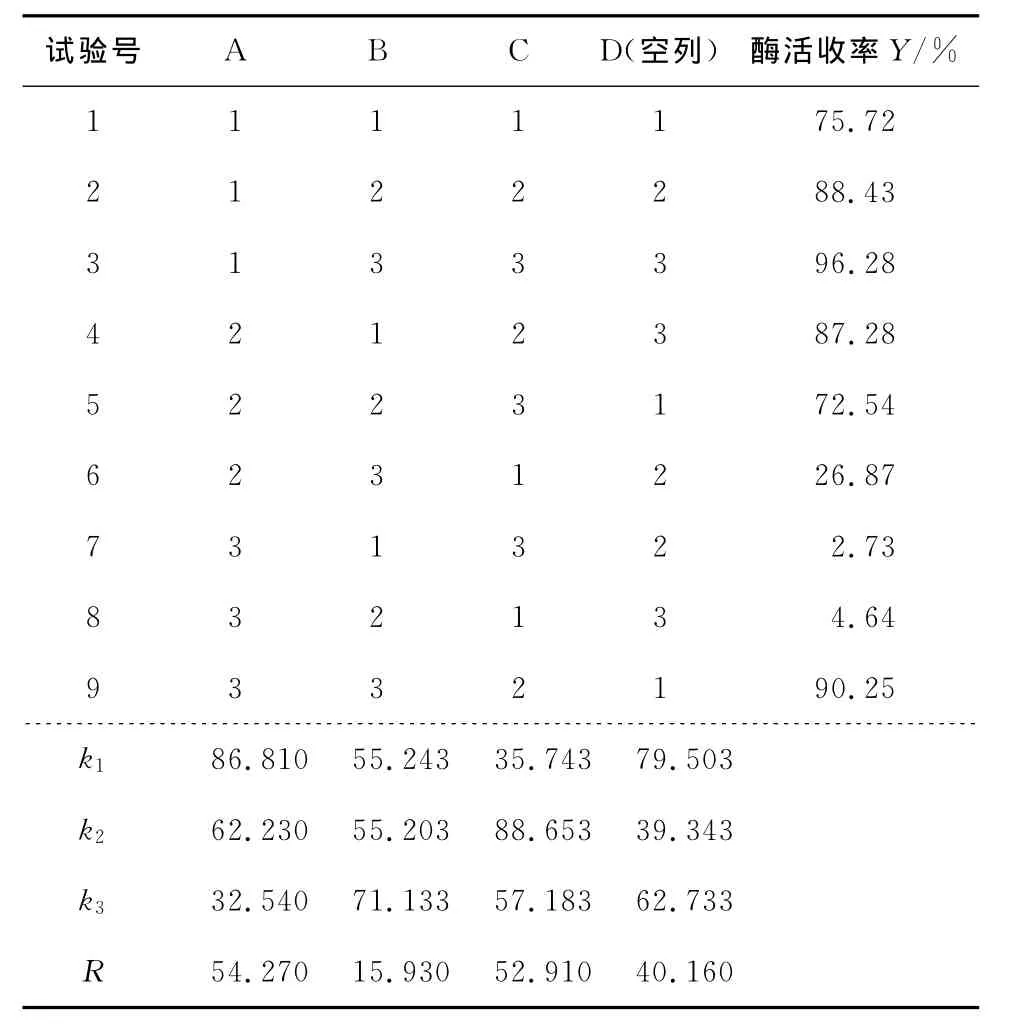
表2 正交试验结果Table 2 Results of orthogonal experimental design
2.7 漆酶的酶学性质研究
2.7.1 漆酶的最适反应温度 由图6可知,在45℃时纯化漆酶的酶活最高,之后酶活明显降低,至100℃时酶活几乎为0。因此,确定纯化漆酶的最适反应温度为45℃。
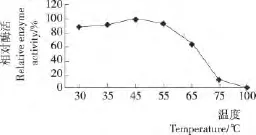
图6 漆酶的最适反应温度Figure 6 The optimal temperature of the purified laccase activity
2.7.2 漆酶的热稳定性 由图7可知,在30,35,45℃分别保温2h后,漆酶的剩余相对酶活分别为78.2%,86.7%,74.4%,稳定性较好,而在55℃保温2h后其相对酶活仍剩余65.3%,由此表明,纯化漆酶在30~55℃范围内具有一定的稳定性,其中在30~45℃范围内,热稳定性较好。
2.7.3 漆酶的最适反应pH 由图8可知,在最适反应温度45℃时,反应pH为2.97时漆酶的酶活最高,之后酶活迅速下降,pH为4时相对酶活仅为61.0%,由此确定,在测定条件下,漆酶的最适反应pH为2.97。

图7 漆酶的热稳定性Figure 7 The thermostability of the purified laccase activity
2.7.4 漆酶的pH稳定性 由图9可知,纯化漆酶在p H 3.5~5.0时稳定性较好,保温2h,剩余相对酶活均在72.7%~87.7%,在pH 5.5条件下保温2h,相对酶活仍为66.0%,之后酶活逐渐降低,pH 7时酶活几乎为0。由此可知,纯化漆酶在pH 3.5~5.0时稳定性最好。

图8 漆酶的最适反应pHFigure 8 The optimal pH of the purified laccase activity
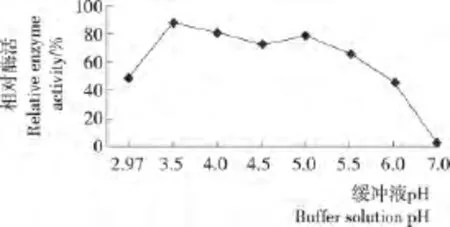
图9 漆酶的pH稳定性Figure 9 The purified laccase stability under different pH
2.7.5 金属离子对漆酶酶活性的影响 由图10可知,与对照相 比 (不 加 金 属 离 子),金 属 离 子 Cu2+、Zn2+、Mg2+、Mn2+、K+、Ca2+对漆酶酶活有较好的促进作用,其中 Cu2+和Mg2+促进作用最显著,其相对酶活分别达150.0%和148.0%。而Co2+、Fe2+、Na+则对漆酶酶活有很大的抑制作用,其中Fe2+抑制作用最明显,其相对酶活仅为2.0%。

图10 金属离子对漆酶酶活的影响Figure 10 The effects of metal ions on the laccase activity
3 讨论
本实验室通过灰树花GF-931菌株的液体发酵,灰树花漆酶的酶活力可达200~300U/mL,直接冷冻干燥酶活达3万U/g,采用ATPS法对其进行分离纯化,显著降低了酶损失的同时,更提高了其纯度,稳定了酶活性。
本试验采用PEG6000/(NH4)2SO4双水相体系对灰树花漆酶进行萃取效应的研究。通过单因素试验研究酶液添加量、PEG6000质量分数、(NH4)2SO4质量分数和体系pH对灰树花漆酶萃取效应的影响,通过正交试验进一步优化萃取条件。试验结果表明:在pH为6(自然)时,漆酶最佳萃取条件为酶液添加量5%,PEG6000质量分数25%,(NH4)2SO4质量分数17%,在此最佳萃取条件下进行验证实验,漆酶的分配系数和酶活收率分别高达7.6和96.6%。说明该技术能够用于灰树花漆酶的分离纯化。
对双水相萃取纯化的漆酶进行了酶学性质研究,由试验结果可知,纯化漆酶的最适反应温度为45℃,在30~45℃时热稳定性最好;最适反应pH为2.97,在pH 3.5~5.0时具有较好的稳定性。金属离子 Cu2+、Zn2+、Mg2+、Mn2+、K+、Ca2+对漆酶酶活有促进作用,其中Cu2+和Mg2+促进作用最强;而Co2+、Fe2+、Na+则抑制漆酶酶活,其中Fe2+的抑制作用最明显。
本试验利用ATPS法进行了灰树花漆酶的萃取,确定了最佳萃取条件,并进行了纯化漆酶的酶学性质研究,为漆酶的系统研究及工业化生产和应用提供了理论依据。
1 谢蓝华,杜冰,张嘉怡,等.双水相萃取技术在食品工业中的应用研究进展[J].食品与机械,2012,28(5):234~237.
2 周念波,周吉祥,涂绍勇,等.PEG-(NH4)2SO4双水相萃取法提取壳聚糖酶的研究[J].化学与生物工程,2010,27(1):49~51.
3 黄瑛,尹利,闫云君.双水相萃取法分离纯化洋葱假单胞菌G-63脂肪酶[J].现代化工,2007,27(2):300~302.
4 谭平华,林金清,肖春妹,等.双水相萃取技术研究进展及应用[J].化工生产与技术,2003,10(1):19~22.
5 杨辉,张娟,王旭.PEG/(NH4)2SO4双水相体系萃取果胶酶[J].食品科学,2007,28(6):124~125.
6 李伟,朱自强,梅乐和.双水相萃取技术在药物分离和提取中的应用[J].化工进展,1998,17(1):26~29.
7 陶君.灵芝产漆酶条件的优化与漆酶的纯化及部分性质研究[D].武汉:华中农业大学,2008.
8 Ivana Eichlerová,Jaroslavnajdr,Petr Baldrian.Laccase activity in soils:Considerations for the measurement of enzyme activity[J].Chemosphere,2012(2 012):1~2.
9 Daphne Vivienne Gnanasalomi V,J Joel Gnanadoss.Laccases from fungi and their applications:recent developments[J].Asian J.Exp.Biol.Sci.,2013,4(4):582~586.
10 刘家扬,蔡宇杰,廖祥儒,等.漆酶高产菌的筛选及产酶优化[J].食品与机械,2010,26(4):10~11.
11 Vernekar Madhavi,S S Lele.Laccase:properties and applications[J].Bioresources,2009,4(4):1 694~1 717.
12 赵晓燕,邢增涛,邵毅,等.灰树花漆酶酶学性质的初步研究[J].天然产物研究与开发,2012(24):824~827.
13 Diego Moldes,Mar′ia Fern′andez-Fern′andez,M′Angeles Sanrom′an.Role of laccase and low molecular weight metab olites from Trametes versicolor in dye decolorizat ion[J].The Scientific World Journal,2012(2 012):1~2.
14 李恒,孙明丽,李艳玲.泰山灰树花产海藻糖母种培养基的筛选[J].泰山医学院学报,2008,29(12):952~953.
15 Nona A Mikiashvili,Omoanghe S Isikhuemhen,Elijah I Ohimain.Lignin degradation,ligninolytic enzymes activities and exopolysaccharide production byGrifolafrondosastrains cultivated on oak sawdust[J].Brazilian Journal of Microbiology,2011,42(3):1 102~1 103.
16 闰云君,陈晖,杨江科,等.ATPS法分离纯化Aspergillussp.F044脂肪酶[J].华中科技大学学报(自然科学版),2005,33(10):92~95.
17 杨秋慧子,孙亚莉,张喜峰.双水相体系萃取分离熊猫豆蛋白质[J].食品工业科技,2013,34(9):250~251.
18 Niku-Paavola M-L,Karhunen E,Salola P,et al.Ligninolytic enzymes of the white-rot fungus Phlebia radiata[J].Biochem.J.,1988(254):877~884.
19 王雯娟.双水相萃取菠萝蛋白酶的研究[D].南宁:广西大学,2004.
