紫苏叶中总黄酮的超声波辅助提取工艺优化
2014-12-21陈洪彬郑金水蔡英卿张晨曦陈明贤泉州师范学院化学与生命科学学院福建泉州3600福建省泉州市农业科学研究所福建泉州36分子生物学与药物化学福建省高校重点实验室福建泉州3600
陈洪彬 郑金水 蔡英卿 张晨曦 陈明贤(.泉州师范学院化学与生命科学学院,福建 泉州 3600;.福建省泉州市农业科学研究所,福建 泉州 36;3.分子生物学与药物化学福建省高校重点实验室,福建 泉州 3600)
紫苏(Perilla frutescensL.)又名红苏、香苏、苏草、桂荏等,为唇形科(Lamiaceae)紫苏属(Perilla)下唯一种,是药食兼用的一年生草本植物,主产于东南亚以及中国的台湾、江西、湖南等省[1,2]。紫苏叶中富含紫苏醛、紫苏醇、左旋柠檬烯等挥发性油和迷迭香酸、咖啡酸、阿魏酸等酚酸类以及芹菜素、木犀草素等黄酮类物质,具有解热镇静、抗炎、抗过敏、抗氧化、抗肿瘤、降脂保肝、增强机体免疫能力等功效,也广泛用作烹饪风味调料[2-5]。国内外研究中有关总黄酮的提取 方 法 主 要 有 水 浴 浸 提[6]、微 波 辅 助[7,8]、超 声 波 辅助[9,10]、微波—超声波协同辅助[11]、超临界 CO2流体萃取[12]等,超声波辅助提取通过其机械效应、空化效应和热效应,增大介质分子的运动频率和速度,增强介质的穿透力,可有效增加总黄酮的提取率,降低成本[10]。目前,有关紫苏叶中的化学成分研究主要集中在其挥发性精油[1,5],对其黄酮类成分的研究较少且集中在抗氧化活性评价方面,对其提取工艺优化较少深入研究[7-9]。本研究拟以紫苏叶为试验材料,采用超声波辅助乙醇提取法提取总黄酮,通过单因素试验及响应面法优化紫苏叶中总黄酮的提取工艺,以期为紫苏叶的综合开发利用提供科学依据。
1 材料与方法
1.1 材料、仪器与试剂
材料:紫苏叶采自福建泉州市农科所园区,60℃烘干后粉碎至80目备用;
数显鼓风干燥箱:GZX-9240MBE型,上海博迅实业有限公司;
万能粉碎机:ZN-02型,北京兴时利合科技发展有限公司;
电子天平:BS124S型,北京赛多利斯仪器系统有限公司;
双频数控超声波清洗器:KQ-300VDE型,300W,昆山超声仪器有限公司;
冷冻高速离心机:TGL-16G型,上海安亭科学仪器厂;
可见分光光度计:V-1100型,上海美谱达仪器有限公司;
芦丁标准品:生物级,上海金穗生物科技有限公司;
亚硝酸钠、硝酸铝、无水乙醇、氢氧化钠等:分析纯,国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 工艺流程
紫苏叶→60℃恒温干燥→粉碎、过80目筛→超声波辅助提取→离心→定容→检测
1.2.2 标准曲线制作 参考王艳丽等[11]的方法,以芦丁为标品,采用NaNO2—Al(NO3)3显色法制作标准曲线,得到芦丁标准曲线回归方程为:y= 0.886x+ 0.007(R2= 0.995),其中y为黄酮溶度(mg/mL),x为吸光值。
1.2.3 总黄酮含量的测定 参考王艳丽等[11]的方法,采用NaNO2—Al(NO3)3显色法测定提取液中总黄酮的含量,并根据标准曲线计算黄酮浓度及提取率。
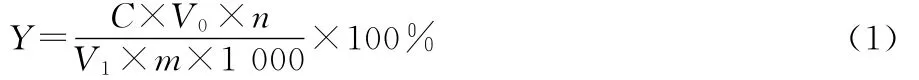
式中:
Y——紫苏叶总黄酮提取率,%;
C——测定样液黄酮浓度,mg/mL;
V0——提取液总体积,mL;
n——稀释倍数;
V1——测定吸取样液体积,mL;
m——称取紫苏叶干粉末质量,g。
1.2.4 单因素试验设计
(1)液料比对总黄酮提取率的影响:在超声时间3 0min,超声功率300W,乙醇浓度60%,提取温度60℃下,液料比分别为10∶1,20∶1,3 0∶1,40∶1,50∶1,60∶1(V∶m),考察总黄酮的提取率。
(2)超声时间对总黄酮提取率的影响:在超声功率3 00W,乙醇浓度60%,提取温度60℃,液料比20∶1(V∶m)下,超声时间分别为10,20,30,40,50min,考察总黄酮的提取率。
(3)乙醇浓度对总黄酮提取率的影响:在超声时间3 0min,超声功率300W,提取温度60℃,液料比20∶1(V∶m)下,乙醇浓度分别为20%,40%,60%,80%,100%,考察总黄酮的提取率。
(4)提取温度对总黄酮提取率的影响:在超声时间3 0min,超声功率300W,乙醇浓度60%,液料比20∶1(V∶m)下,提取温度分别为30,40,50,60,70℃,考察总黄酮的提取率。
1.2.5 提取工艺的响应面优化 在单因素试验结果的基础上,根据Box-Benhnken中心组合设计原理,以紫苏叶总黄酮提取率为响应值,选取液料比、超声时间、乙醇浓度、提取温度4个影响因素,利用Design-Expert 8.05软件设计四因素三水平响应面试验。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 液料比对紫苏叶中总黄酮提取率的影响 由图1(a)可知:随着液料比从10∶1(V∶m)到20∶1(V∶m),总黄酮提取率逐渐增加,在液料比为20∶1(V∶m)时,紫苏叶总黄酮提取率最高;当液料比超过20∶1(V∶m)后,总黄酮提取率逐渐下降。这是因为:液料比较低时,紫苏叶中总黄酮的浸出率降低;而液料比较高时,浸提液中总黄酮的浓度低,大大降低了后续浓缩的效率。故确定提取过程最佳液料比为2 0∶1(V∶m)。
2.1.2 超声时间对紫苏叶中总黄酮提取率的影响 由图1(b)可知:随着超声时间的增加,紫苏叶中总黄酮提取率逐渐增加,超声时间40min后增加幅度减少。虽然超声浸提时间越长,总黄酮提取率越高,但也会增加其他高分子杂质的浸出,不利于后续对紫苏叶黄酮类物质的分离。故确定提取过程最佳超声时间为30min。
2.1.3 乙醇浓度对紫苏叶中总黄酮提取率的影响 由图1(c)可知:随着乙醇浓度从20%到40%,紫苏叶总黄酮提取率增加,在乙醇浓度为40%时,紫苏叶中总黄酮提取率最高。当乙醇浓度超过40%后,总黄酮提取率逐渐下降。这是因为:紫苏叶中黄酮类物质以木犀草素为主,且多与糖苷结合在一起,水溶性相比其他游离黄酮高。同时,过高的乙醇浓度会增加紫苏叶中叶绿素等脂溶性色素的浸出,干扰因素增加,不利于后续对紫苏叶黄酮类物质的进一步分离。故确定提取过程最佳乙醇浓度为40%。
2.1.4 提取温度对紫苏叶中总黄酮提取率的影响 由图1(d)可知:随着提取温度的提高,紫苏叶总黄酮提取率逐渐提高,在提取温度为50℃时,紫苏叶总黄酮提取率最高,之后有所下降。这是因为:过高的温度会使提取溶剂中的乙醇浓度降低,减少紫苏叶中黄酮类物质的浸出,也会破坏黄酮的结构。故确定最佳提取温度为50℃。
2.2 响应面法优化结果与分析
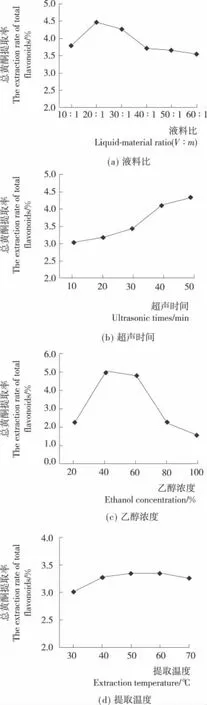
图1 液料比、超声时间、乙醇浓度和提取温度对紫苏叶总黄酮提取率的影响Figure 1 Effects ofliquid-material ratio,ultrasonic times,ethanol concentration,extraction temperature on the extraction rate of total flavonoids from Perilla frutescens leaves
2.2.1 响应面试验结果 根据单因素试验结果,分别选取液料比、超声时间、乙醇浓度、提取温度4个因素,每个因素3个水平,以总黄酮提取率作为响应面优化试验设计的响应值(表1)。响应面优化试验结果见表2。
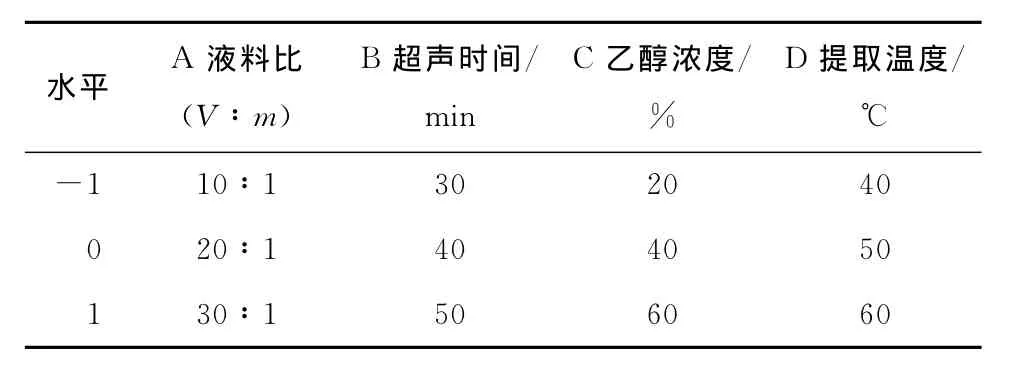
表1 因素和水平表Table 1 Factors and levels in response surface design
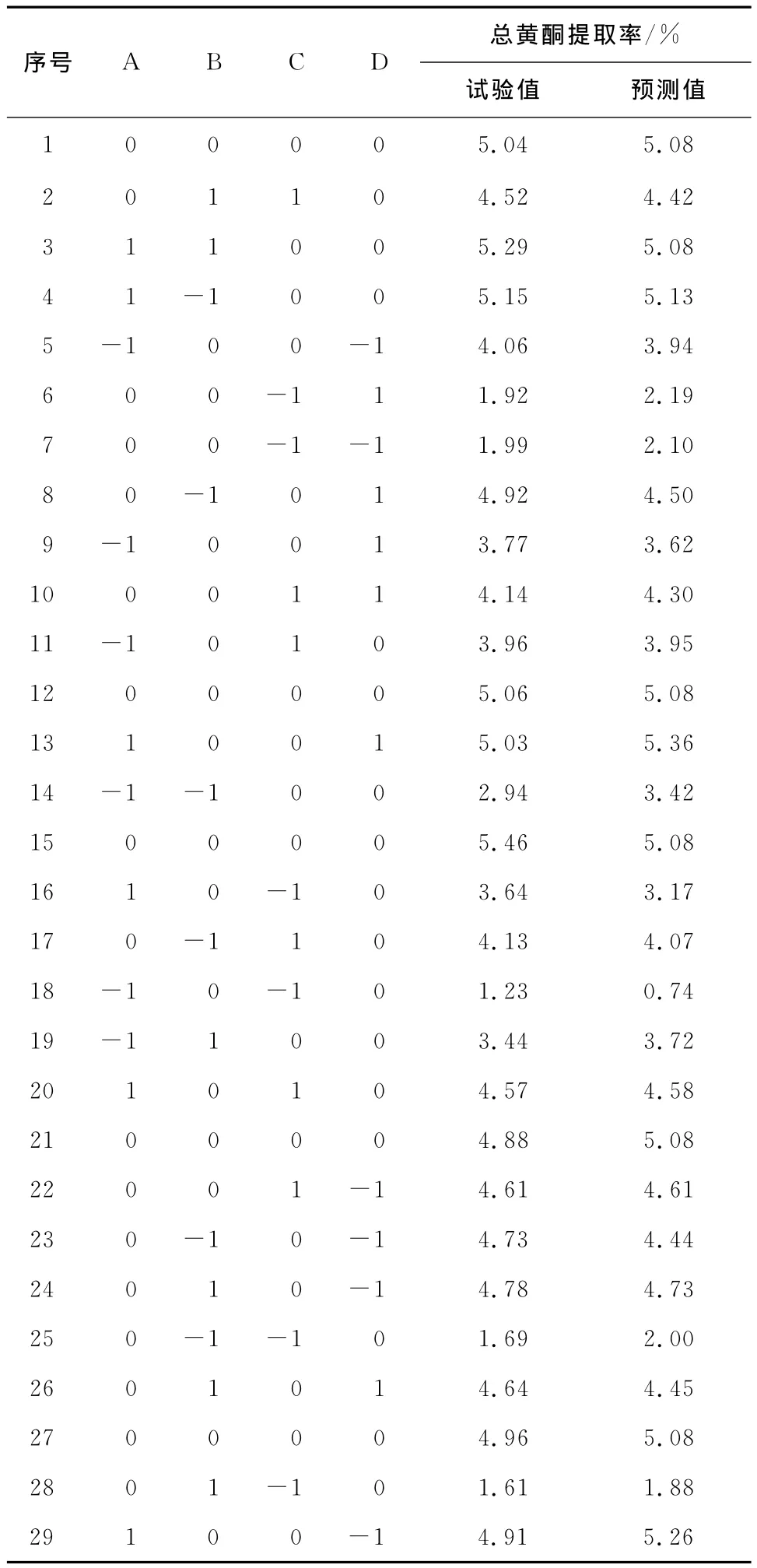
表2 紫苏叶中总黄酮提取响应面试验结果Table 2 Response surface design arrangement and experimental results
利用Design-Expert 8.05软件对响应面试验结果(表2)进行分析,得到以紫苏叶总黄酮提取率(Y)为响应值的回归方程:
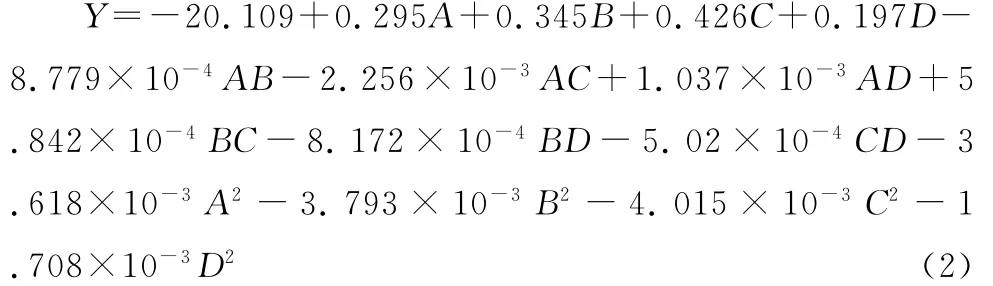
对回归方程进行方差分析,检验回归方程的有效性及各因素对紫苏叶总黄酮提取率的影响程度,结果见表3。由表3可知,回归模型P<0.0001,说明回归模型达到极显著水平;失拟项P=0.126 3>0.05,不显著,说明该模型合适;信噪比(Adeq Precision)=17.59>4,说明模型与试验值拟合度很好;回归方程的复相关系数R2=0.956 4,校正决定系数=0.912 9,说明该方程拟合度较高,可利用该模型对紫苏叶总黄酮的提取率进行分析和预测。进一步分析可知,A、C及C2项对紫苏叶总黄酮提取率的影响极显著(P<0.01),A2、B2及AC项对紫苏叶总黄酮提取率的影响显著(P<0.05),其他项对紫苏叶总黄酮提取率的影响不显著(P>0.05)。在所选的因素水平范围内,各因素对紫苏叶总黄酮提取率的影响大小为:C>A>B>D,即:乙醇浓度>液料比>超声时间>提取温度。
表3 方差分析Table 3 ANOVA of the constructed regression model
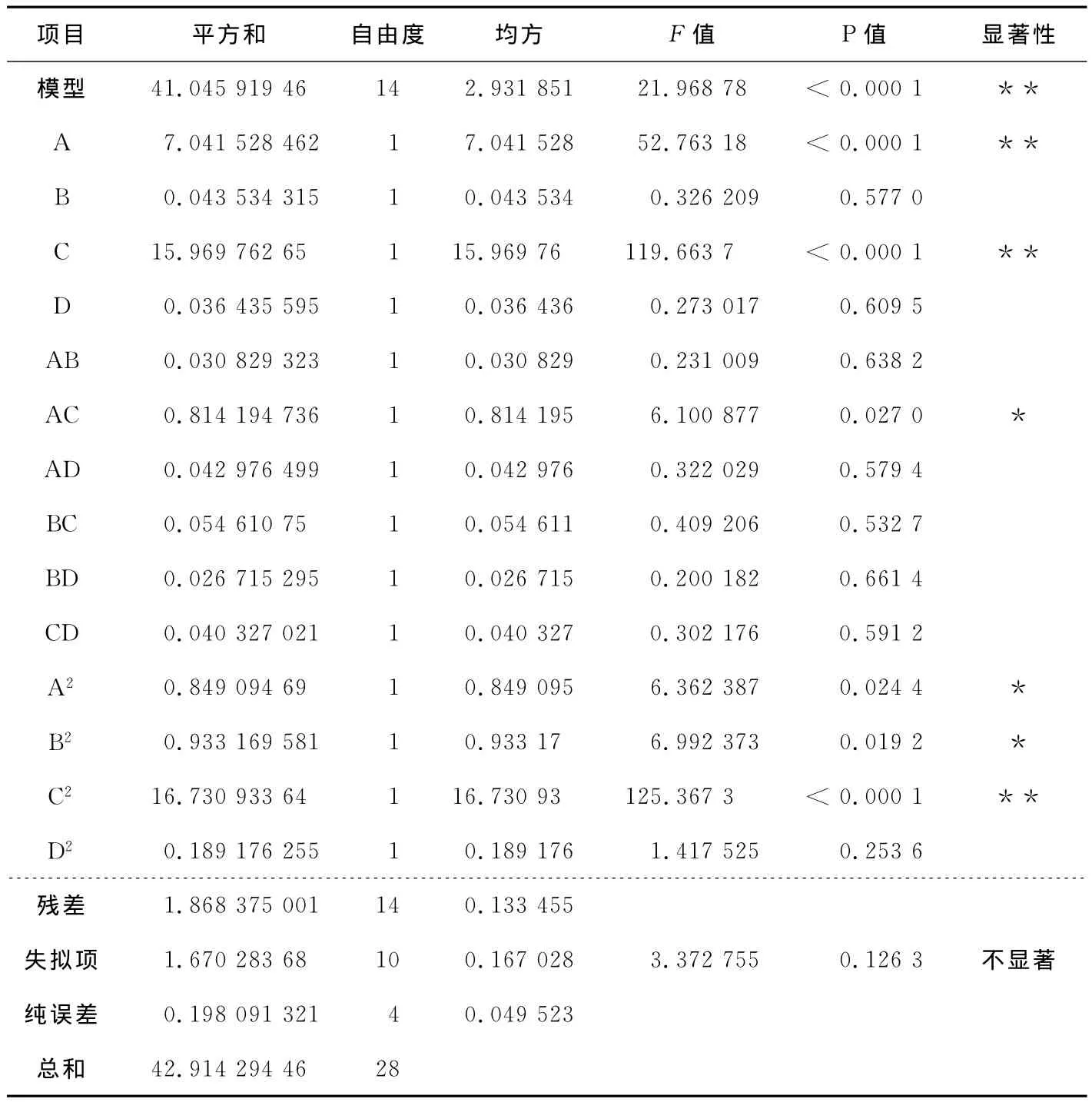
表3 方差分析Table 3 ANOVA of the constructed regression model
*表示差异显著,P<0.05;**表示极差异显著,P<0.01。R2=0.956 4,=0.912 9,Adeq Precision=17.59。
项目 平方和 自由度 均方 F值 P值 显著性模型 41.045 919 46 14 2.931 851 21.968 78 <0.000 1 1.868 375 001 14 0.133 455失拟项 1.670 283 68 10 0.167 028 3.372 755 0.126 3 不显著纯误差 0.198 091 321 4 0.049 523总和**A 7.041 528 462 1 7.041 528 52.763 18 <0.000 1 **B 0.043 534 315 1 0.043 534 0.326 209 0.577 0 C 15.969 762 65 1 15.969 76 119.663 7 <0.000 1 **D 0.036 435 595 1 0.036 436 0.273 017 0.609 5 AB 0.030 829 323 1 0.030 829 0.231 009 0.638 2 AC 0.814 194 736 1 0.814 195 6.100 877 0.027 0 *AD 0.042 976 499 1 0.042 976 0.322 029 0.579 4 BC 0.054 610 75 1 0.054 611 0.409 206 0.532 7 BD 0.026 715 295 1 0.026 715 0.200 182 0.661 4 CD 0.040 327 021 1 0.040 327 0.302 176 0.591 2 A2 0.849 094 69 1 0.849 095 6.362 387 0.024 4 *B2 0.933 169 581 1 0.933 17 6.992 373 0.019 2 *C2 16.730 933 64 1 16.730 93 125.367 3 <0.000 1 **D2 0.189 176 255 1 0.189 176 1.417 525 0.253 6残差42.914 294 46 28
2.2.2 响应面试验因素的相互影响 根据回归模型方差分析(表3)可知,液料比和乙醇浓度的交互项对紫苏叶总黄酮提取率影响显著,将超声时间和提取温度中的两个因素固定在零水平,得到液料比和乙醇浓度两个因素对紫苏叶总黄酮提取率交互影响的响应曲面图(图2)。由图2可知:液料比和乙醇浓度之间的等高线形状呈椭圆形,响应曲面坡度非常陡峭,说明AC之间的交互作用强,对紫苏叶中总黄酮提取率的影响大,达到显著水平(P<0.05)。
2.2.3 最佳工艺参数及验证实验 进一步分析回归方程,得到响应面法优化紫苏叶中总黄酮超声辅助提取的最佳工艺条件为:液料比29.24∶1(V∶m)、超声时间40.02min、乙醇浓度44.57%、提取温度50.51℃,在此条件下总黄酮提取率的理论值为5.56%。为进一步验证该模型的可靠性,根据实际可操作情况,采用修正的最佳提取工艺条件:液料比2 9∶1(V∶m)、超声时间40min、乙醇浓度45%、提取温度51℃,对超声波辅助乙醇提取紫苏叶中总黄酮工艺进行验证性实验(n=3),得到紫苏叶中总黄酮实际提取率的平均值为5.41%,与理论预测值5.56%误差在5%以内,说明该回归模型可靠,具有一定的实用价值。
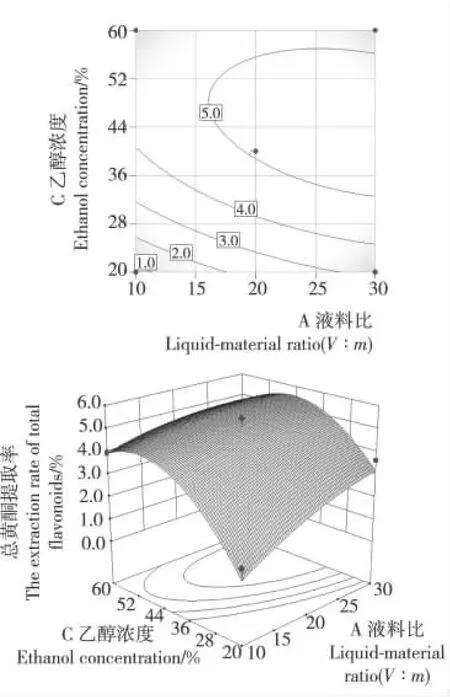
图2 液料比和乙醇浓度两因素交互作用对紫苏叶中总黄酮提取率影响的等高线和响应面图Figure 2 Response surface plots and contour of liquidmaterial ratio and ethanol concentration interactive effects on the extraction rate of total flavonoids from Perilla frutescens leaves
3 结论
本研究通过单因素和响应面优化设计试验,对超声波辅助提取紫苏叶中总黄酮的工艺进行优化、修正和验证,得到紫苏叶中总黄酮提取的最佳工艺条件:液料比29∶1(V∶m)、超声时间40min(超声功率300W)、乙醇浓度45%、提取温度51℃,在此条件下,总黄酮实际提取率达5.41%,说明试验采用响应面分析法优化紫苏叶中总黄酮的提取具有实际可行性,为紫苏叶的综合开发利用,降低提取成本、减少能耗和工业化生产作业合理化提供有价值的参考依据。紫苏叶中总黄酮的提取效果可能还与紫苏叶的采收期、粉碎粒径大小及采后存放环境等有关,对此,还需深入研究。
1 谭美莲,严明芳,汪磊,等.国内外紫苏研究进展概述[J].中国油料作物学报,2012,34(2):225~231.
2 张洪,黄建韶,赵东海.紫苏营养成分的研究[J].食品与机械,2006,22(2):41~43.
3 Lin E S,Chou H J,Kuo P L,et al.Antioxidant and antiproliferative activities of methanolic extracts ofPerilla frutescen[ J].Journal of Medicinal Plants Research,2010,4(6):477~483.
4 Feng L J,Yu C H,Ying K J,et al.Hypolipidemic and antioxidant effects of total flavonoids ofPerilla frutescensleaves in hyperlipidemia rats induced by high-fat diet[J].Food Research International,2011,44(1):404~409.
5 苑玉莉.紫苏中天然活性成分的提取及综合应用[D].上海:华东理工大学,2013.
6 甘正伟,陈学泽.香薷总黄酮化合物提取工艺研究[J].食品与机械,2012,28(2):135~138.
7 Shao P,He J,Sun P,et al.Analysis of conditions for microwave-assisted extraction of total water-soluble flavonoids fromPerilla Frutescensleaves[J].Journal of Food Science and Technology,2012,49(1):66~73.
8 应艳杰,洪台,何佳杰,等.神经网络优化紫苏叶黄酮微波提取及抗氧化活性比较研究[J].中国食品学报,2011,11(3):36~42.
9 刘宁,仇农学,田玉霞.超声辅助提取紫苏叶黄酮及其清除自由基作用研究[J].西北林学院学报,2008,23(1):158~161.
10 王艳丽,何煜波,曹晓宁,等.辣椒叶中总黄酮提取工艺的优化[J].食品与机械,2013,29(3):138~140.
11 刘全德,唐仕荣,宋慧,等.超声波—微波协同萃取芹菜黄酮的工艺研究[J].食品与机械,2010,26(5):134~136.
12 汤芬,傅亚平,邓放明.超临界CO2流体萃取荷叶总黄酮的工艺优化[J].食品与机械,2013,29(4):149~152.
