脯氨酸催化柚皮苷合成新橙皮苷工艺研究
2014-12-20黄清东李仲辉
杜 琳 黄清东 李仲辉
(1.成都师范学院化学与生命科学学院,四川 成都 610300;2.四川大学华西药学院,四川 成都 610300)
新橙皮苷属于黄酮类化合物中的二氢黄酮类化合物,其结构式如图1所示。它是制备新型甜味剂——新橙皮苷二氢查尔酮的重要原料。新橙皮苷二氢查尔酮的甜味相当于蔗糖的1 500~1 800倍[1],适口性好,同时具有良好的屏蔽苦味作用,用于苦味药片(或液体制剂)中,以此矫正化学药的强烈苦味[2]。同时,它对人体安全,至今未见有任何副作用的报道。鉴于此,市场对新橙皮苷二氢查尔酮的需求量逐年增加,作为其主要原料的新橙皮苷也出现了供不应求的局面。
新橙皮苷主要存在于橘科植物干燥果皮中,可以通过对这些植物提取得到新橙皮苷。目前通过植物提取的方式生产新橙皮苷远远不能满足市场对新橙皮苷的需求[3],市场上普遍采用半合成的方法。这些方法通常是先从植物中提取结构类似的柚皮苷[4],然后通过水解、缩合的化学反应合成生产新橙皮苷。以往的半合成方法有[5-7]:① 将柚皮苷直接与大大过量的异香兰素(过量12倍)在碱性水溶液或者醇溶液中反应后,酸化得到新橙皮苷;② 将柚皮苷在碱性水溶液中水解后得到根皮乙酰苯-4′-β-新橙皮糖苷,再与大大过量异香兰素在碱性水溶液或醇溶液中反应后酸化得到新橙皮苷;③ 用根皮乙酰苯-4′-β-新橙皮糖苷与异香兰素按1∶1的摩尔比在无水乙醇中氩气保护下,以1∶1四氢吡咯和乙酸为催化剂反应12h可合成了新橙皮苷,该方法目前被公认为最可行的工业生产方法[8]。但这些方法都存在收率低,需要大量原料异香兰素,工艺不稳定对人体伤害大等问题。因此有必要寻找合成生产新橙皮苷的新方法。
本研究拟在专利方法[7]的基础上,采用脯氨酸为催化剂替代四氢吡咯和乙酸,开发出一条由柚皮苷合成新橙皮苷的全新生产工艺。

图1 新橙皮苷的结构式Figure 1 Chemical structure of noehesperidin
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
柚皮苷、异香兰素:成都华康生物工程有限公司;
脯氨酸:四川大学化学学院提供;
氢氧化钠、乙醇:分析纯,成都金山化学试剂有限公司。
1.1.2 主要仪器设备
恒温磁力搅拌器:81-2型,上海司乐仪器有限公司;
鼓风干燥箱:DGX-8243B型,上海福玛实验设备有限公司;
高效液相色谱仪器:Agilengt G1314A型,安捷伦科技有限公司。
1.2 方法
1.2.1 新橙皮苷的合成工艺 以柚皮苷(1)为起始物料,经过碱性水解得到根皮乙酰苯-4′-β-新橙皮糖苷(2),根皮乙酰苯-4′-β-新橙皮糖苷(2)在脯氨酸的催化下与异香兰素反应高产率的得到高纯度的新橙皮苷。工艺路线如图2所示。

图2 新橙皮苷的合成路线Figure 2 Synthetic routes of noehesperidin
1.2.2 根皮乙酰苯-4′-β-新橙皮糖苷(2)的合成工艺 将6 0.0g氢氧化钠加入三口反应瓶中,加入500mL自来水,搅拌溶解,然后将45.0g柚皮苷在搅拌条件下缓慢加入该碱性溶液中,搅拌完全溶解后,开始加热升温至100℃回流,从开始回流计时,回流搅拌反应1.5h后停止加热,冷却至3 0℃以下,缓慢加入浓盐酸中和至pH值6.5左右,析出黄色固体。再次加热升温至70℃以上使固体全部溶解后,停止加热,自然冷却,静置共2h后布氏漏斗过滤,抽干后6 0℃真空干燥即得到25.5g黄色根皮乙酰苯-4′-β-新橙皮糖苷,收率68.1%。
1.2.3 新橙皮苷(4)的合成工艺 将根皮乙酰苯-4′-β-新橙皮糖苷(20.0g,41.9mmol)加入三口反应瓶中,加入 1 20mL无水乙醇中,搅拌溶解后,再分别加入脯氨酸(4.8g,4 1.9mmol)和异香兰素(6.9g,46.1mmol),90℃加热回流反应,从开始回流计时,回流搅拌反应1.5h后停止加热,冷却至30℃以下,布氏漏斗过滤,用大量水洗涤至固体无色为止,6 0℃真空干燥即得到24.2g浅黄色粉末状固体物质新橙皮苷,收率为96%,产品经液相色谱测定纯度为96.5%。相对保留时间与对照品一致。
2 结果与分析
2.1 根皮乙酰苯-4′-β-新橙皮糖苷(2)的合成
根皮乙酰苯-4′-β-新橙皮糖苷(2)的合成方法参照文献[9]。首先是柚皮苷在碱性水溶液中水解得到根皮乙酰苯-4′-β-新橙皮糖苷的酚钠盐,加盐酸中和后析出固体即得到根皮乙酰苯-4′-β-新橙皮糖苷(2)。该步反应经多批次合成验证,证明该步中间体的合成操作简单,工艺稳定。但文献[9]报道的路线存在加酸中和后过滤困难的问题,本试验通过在加盐酸中和得到固体后再次升温使固体溶解,然后缓慢冷却析晶的方法解决了该问题,得到了颗粒较大、容易过滤的中间体根皮乙酰苯-4′-β-新橙皮糖苷(2)。
2.2 新橙皮苷(4)的合成
专利US3947405[7]中的反应机理表明,新橙皮苷的合成反应中起催化作用的是四氢吡咯上的氮原子和乙酸的羧基,可以推测分子结构上含有胺和羧基的化合物可能可以取代四氢吡咯和乙酸,从而起到同样的催化作用。为了证实该推测,本研究保持乙酸不变,分别用乙胺、二乙胺和三乙胺取代四氢吡咯进行了试验,结果发现,仅有二乙胺与乙酸作为催化剂时具有较好的催化效果。这可能是因为二乙胺是一种二级胺,具有适合于该反应的碱性,因此推断催化该反应的氮原子需要使用二级胺。
另外,为了考察羧基的影响,本研究保持四氢吡咯不变,分别采用甲酸、丙酸、丁酸、辛酸和苯甲酸取代乙酸进行了试验探索,结果发现,用脂肪酸替代乙酸后,反应虽能进行,但原料转化率较低,用芳香酸苯甲酸取代乙酸后不发生反应,这可能是因为与四氢吡咯(含二级胺)协调催化该反应时,羧酸需要与四氢吡咯有合适的空间匹配。基于以上试验和猜测,选择分子结构上同时含有二级胺和羧酸的脯氨酸作为催化剂,得到了非常好的试验结果(原料转化率为100%,产品纯度为95%以上)。这可能是因为脯氨酸为固体,不会像四氢吡咯和乙酸一样在反应过程中会挥发损失,同时由于氮原子和羧基处于同一个分子式,也保证了氮原子与羧基的摩尔比恒定为1∶1,同时脯氨酸分子上氮原子与羧基的位置恰当,有空间协调作用增强脯氨酸的催化能力。为了证实氮原子与羧基的协调作用,采用脯氨酸上的羧基被甲酯化的脯氨酸甲酯,以及脯氨酸上的二级氮原子被乙酰化的乙酰化脯氨酸作为催化剂进行试验,结果发现两者都无法催化反应的进行,进一步证实了脯氨酸结构上氮原子和羧基的协调作用。试验结果见表1。
值得一提的是,脯氨酸为固体催化剂,在生产过程中不会挥发损失,因此使用该催化剂生产操作简单,更适用于工业化大生产。另外,脯氨酸不会像四氢吡咯和乙酸那样具有刺激性气味,减少了生产过程中试剂对工人的伤害。
表1 含氮试剂和含羧基试剂的选择Table 1 Results of using different reagent as catalysts

表1 含氮试剂和含羧基试剂的选择Table 1 Results of using different reagent as catalysts
以上筛选试验根皮乙酰苯-4′-β-新橙皮糖苷∶羧基∶异香兰素=1∶0.5∶1.1(mol∶mol∶mol),反应溶剂为无水乙醇(即99%的乙醇),反应温度为90℃,反应时间为12h。
含氮试剂含羧基试剂 催化结果 说明 乙胺 乙酸 不反应 一级胺取代四氢吡咯二乙胺 乙酸 反应较好 二级胺取代四氢吡咯三乙胺 乙酸 不反应 三级胺取代四氢吡咯四氢吡咯 甲酸 反应,但转化率低 甲酸取代乙酸四氢吡咯 丙酸 反应,但转化率低 丙酸取代乙酸四氢吡咯 丁酸 反应,但转化率低 丁酸取代乙酸四氢吡咯 辛酸 反应,但转化率低 辛酸取代乙酸四氢吡咯 苯甲酸 仅有少量反应 苯甲酸取代乙酸脯氨酸 反应较好,转化率非常高脯氨酸代替四氢吡咯和乙酸脯氨酸甲酯 不反应 脯氨酸甲酯代替四氢吡咯和乙酸吡咯和乙酸乙酰化脯氨酸 不反应 乙酰化脯氨酸代替四氢
2.2.1 脯氨酸用量的影响 保持根皮乙酰苯-4′-β-新橙皮糖苷∶异香兰素的摩尔比为1∶1,反应溶剂为无水乙醇(即99%的乙醇),反应温度为90℃,反应时间为12h,改变根皮乙酰苯-4′-β-新橙皮糖苷与脯氨酸的摩尔比分别为1∶0.3,1∶0.5,1∶0.8,1∶1,1∶1.2,1∶1.5进行研究,结果发现根皮乙酰苯-4′-β-新橙皮糖苷与脯氨酸的摩尔比需要大于等于1∶1时,反应才会得到较好的收率和产品纯度。为了节约催化剂用量,降低生产成本,将催化剂脯氨酸用量固定为根皮乙酰苯-4′-β-新橙皮糖苷与脯氨酸的摩尔比为1∶1。试验结果见表2。
表2 催化剂脯氨酸的量优化试验及结果Table 2 Optimization of catalyst amounts
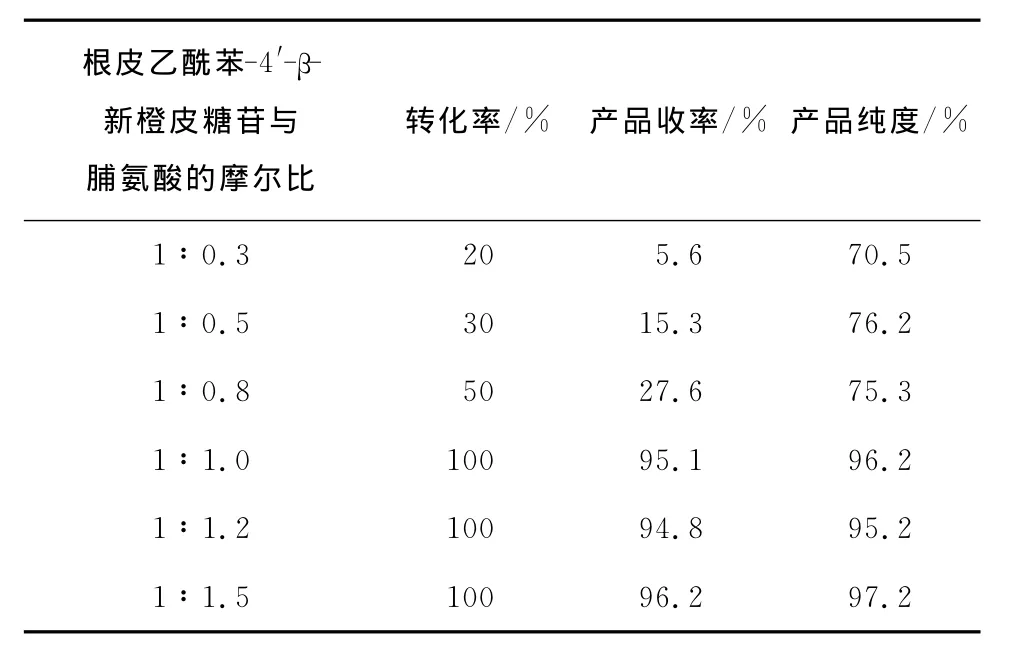
表2 催化剂脯氨酸的量优化试验及结果Table 2 Optimization of catalyst amounts
转化率采用TLC的方法监控。
根皮乙酰苯-4′-β-新橙皮糖苷与脯氨酸的摩尔比转化率/% 产品收率/% 产品纯度/%1∶0.3 20 5.6 70.5 1∶0.5 30 15.3 76.2 1∶0.8 50 27.6 75.3 1∶1.0 100 95.1 96.2 1∶1.2 100 94.8 95.2 1∶1.5 100 96.2 97.2
2.2.2 反应时间的影响 保持根皮乙酰苯-4′-β-新橙皮糖苷∶脯氨酸∶异香兰素的摩尔比为1∶1∶1.1,反应溶剂为无水乙醇(即99%的乙醇),反应温度为90℃,改变反应时间分别为0.5,1,3,3.5,8,12h进行试验,结果通过 TLC检查发现回流反应0.5h反应就进行了约80%,反应1h原料转化完全,为了让原料彻底反应,选择1.5h作为反应完成的时间。试验结果见表3。
表3 反应时间对反应的影响Table 3 Effect of reaction time on the results

表3 反应时间对反应的影响Table 3 Effect of reaction time on the results
转化率通过TLC进行监控。
反应时间/h 转化率/% 产品收率/% 产品纯度/%0.5 80 5.6 80.5 1.0 100 92.3 96.2 3.0 100 95.3 95.3 3.5 100 96.1 96.4 8.0 100 92.1 95.6 12.0 100 95.5 96.8
3 结论
本研究在传统工艺的基础上,开发了一种以脯氨酸为催化剂合成新橙皮苷的方法。
(1)该方法的最佳反应条件为:根皮乙酰苯-4′-β-新橙皮糖苷∶脯氨酸∶异香兰素的摩尔比为1∶1∶1.1,反应溶剂为无水乙醇(即99%的乙醇),反应温度为90℃,反应时间为1.5h。
(2)该方法与原有合成方法相比收率高,产品质量好(收率达95%以上,新橙皮苷成品纯度达96%以上,原工艺收率仅为60%,纯度仅为86%[5]);所采用的催化剂脯氨酸为固体催化剂,在生产过程中不会挥发损失,因此生产操作简单,更适用于工业化大生产。
1 苏东林,单杨.柑橘果皮中功能性成分的作用概述[J].现代食品科技,2006,22(2):260~262
2 温辉梁,欧阳振宇,胡晓波,等.新橙皮苷二氢查尔酮的研究进展[J].中国调味品,2008,10(10):70~73
3 王黄儒,尹硕聪,吴凤兰,等.新型甜味剂[J].食品与发酵工业,1980,14(1):38~52
4 谢志刚,刘成伦.柑桔皮的综合利用新进展[J].食品与机械,2005,22(15):19~22.
5 Bruno Gentili,Horowitz Robert M.Conversion of naringin to neohesperidin and neohesperidin dihydrochalcone:US,3375242[P].1968—03—26.
6 Inglett George Everett,Krbechek Leroy O.2',4',6',3-tetrahydroxy-4-n-propoxydihydrochalcone 4 '-beta-neohesperidoside and edible compositions containing same:US,3522236[P].1970—07—28.
7 George H Robertson,J Peter Clark,Robert Lundin.Dihydrochalcone sweeteners:preparation of neohesperidin dihydrochalcone.[J].Ind.Eng.Chem.Prod.Res.Dev.,1974,13(2):125~129.
8 Jost Wild,Ulrich Huber.Process for making neohesperidine dihydrochalcone:US,3947405[P].1976—03—30.
9 George H Robertson,J Peter Clark,Robert Lundin.Dihydrochalcone sweeteners:preparation of neohesperidin dihydrochalcone[J].Ind.Eng.Chem.,Prod.Res.Develop.,1974,13(2):1 23~125.
