周围神经损伤后局部应用神经生长因子对骨折早期愈合的影响
2014-12-18李东海周安宁
李东海 周安宁
山东海阳市中医医院 海阳 265100
周围神经损伤发生后,骨修复程度会受到大幅度破坏,对骨折修复质量会产生不利影响[1-2],因此,本文分析了周围神经损伤后局部应用神经生长因子对骨折早期愈合的影响,现报道如下。
1 材料和方法
1.1 材料选取 以我市动物实验中心提供的60只健康雄性大鼠为研究对象,体质量(236.5±21.8)g,将60只大鼠随机分成盐水组、神经损伤盐水组、NGF组、神经损伤NGF组,每组各15只,每组30肢体实施试验,所有大鼠均建立胫骨骨折研究模型。盐水组对胫骨骨折大鼠实施盐水注射;神经损伤盐水组再建立神经损伤模型,且实施盐水注射;NGF组损伤模型与盐水组无异,而此组采取NGF注射;神经损伤NGF组模型与神经损伤盐水组模型建立方法一致,该组实施NGF注射。
1.2 模型建立方法 模型建立分胫骨骨折、神经损伤、神经损伤合并胫骨骨折及给药处理,胫骨骨折方面予以氯胺酮将大鼠麻醉,以仰卧位对大鼠双胫骨中点处周径测量,消毒后对大鼠胫骨上段前侧执行楔形开槽,槽深3mm,宽2mm,而后与大鼠腹股沟韧带水平切除股神经,切除10mm左右,对侧行切口暴露,不切除大鼠神经,同法开槽。在神经损伤方面大鼠取仰卧位,股外两侧斜行切口,股神经切除侧行坐骨神经切除10mm,对侧行切口暴露。给药方面,注射盐水的2组给予每肢体0.1mL/d的生理盐水注射,行双侧腓肠肌肌注,需NGF注射的2组,给予每肢体0.1mL/d肌注NGF。
1.3 统计学处理 运用SPSS 19.0软件处理,计量资料以(±s)表示,行t检验,P<0.05为差异有统计学意义。
2 结果
术后2周各组骨痂均有生长,术后4周神经损伤盐水组骨痂生长显著高于其他3组(P<0.05)(表1),而神经损伤盐水组缺损侧骨皮质菲薄且周围骨质密度低,有单边丘状隆起骨痂。其次,NGF组比盐水组骨皮质厚,且骨小梁重建效果较好。此外NGF及神经损伤NGF组周径均有显著增加(P<0.05)。由表2可见,NGF组矿化骨小梁宽度显著高于盐水组(P<0.05)。NGF组大鼠软骨及骨小梁形成,且骨小梁排列规则,矿化骨小梁更为宽厚,密度更高,骨折损伤部位骨小梁开始逐渐有合并现象,小梁间较大空隙由新骨充满,胶原纤维由不规则逐渐转变为层状、规则排列,大鼠周围神经损伤侧各组矿化骨小梁宽度较2周时有明显增加(P<0.05)。其次,神经损伤NGF组与神经损伤盐水组对比,神经损伤NGF组可以发现有骨性骨痂、软骨形成,骨小梁虽存有紊乱情况,但比神经损伤盐水组更规则,矿化骨小梁宽度显著低于NGF组、盐水组(P<0.05)。
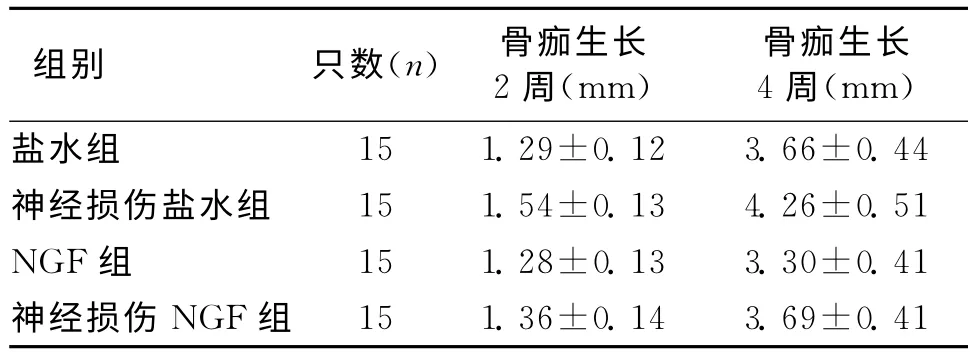
表1 骨痂生长各组比较

表2 各组术后4周骨组织形态学指标比较
3 讨论
从骨折周围肌肉软组织来看,其对骨折端血供、代谢有重要意义,当机体出现神经损伤后会发生骨骼肌缺失神经营养作用,肌细胞不能维持常规形态,从而出现废用萎缩现象。据相关报道[3-4],以胫骨骨折大鼠为试验模型,失去神经支配的胫骨骨折大鼠会于术后形成较大面积骨痂,但是骨痂生长5周后,其生物力学强度只达到健康情况下的20%,而有神经支配的胫骨骨折组在骨痂生长5周后,虽骨痂较小,但生物力学强度可以恢复到健康程度的50%。从本文研究来看,4周后大鼠神经损伤盐水组骨痂量显著高于其他组,而该组有单边丘状隆起骨痂,骨折四周的骨质疏松且骨皮质薄,与文献报道观点类似。
从骨计量学来看,其可以对骨折愈合的细胞数量、形态、活血程度等进行有效反映,同时能对骨重建、骨吸收及形成快慢进行有效反映,可以作为骨折愈合观察的有效措施。在术后4周时,本研究中大鼠周围神经损伤侧矿化骨小梁宽度较2周时有明显增加,当却完全达不到正常标准。破骨细胞、破骨细胞吸收表明有降低,当降低的程度不大,降低后的值仍高于正常范围,成骨细胞在神经损伤盐水组及神经损伤NGF组中对比差异不显著,表明成骨在继续,而框化骨小梁形成速度、骨痂成熟速度有所变慢,从此些方面可以看出在骨折早期愈合过程中,周围神经对破骨细胞有显著的抑制效果,而对于成骨细胞活性的相关影响并不明显,从而达到促进成骨的作用。在骨折愈合中期,周围神经对破骨细胞抑制作用会发生减低,骨吸收、骨形成均趋于平衡,促进骨痂正常成熟。
总之,神经生长因子在骨骼肌中表达[5~6],可促进运动神经元对神经营养物质的合成[7],且可促进骨骼肌钙泵活性恢复,将NGF注射到大鼠后,NGF可造成大鼠神经功能改变,局部或全身用药均可对损伤部位起到作用,本文研究中NGF及神经损伤NGF组周径均有显著增加,也可从一定程度说明NGF可促进肌肉及骨的修复。
[1]粟谋,徐威(综述),蒋林彬,等.影响神经生长因子表达因素的研究进展[J].重庆医学,2014,5(6):735-737.
[2]陈小波,唐卫东.鼠神经生长因子穴位注射治疗腓总神经损伤的疗效分析[J].中国医疗前沿,2013,6(21):39-40.
[3]高旭鹏,林师佈.免疫抑制剂联合神经生长因子促周围神经损伤修复研究[J].中国医学前沿杂志(电子版),2014,8(6):21-25.
[4]刘振刚,刘宇鹏,李放,等.神经生长因子在骨折愈合中的作用[J].中国医药指南,2013,7(11):491.
[5]Spinnler K,Frohlich T,Arnold GJ,et al.Human tryptase cleaves pro-nerve growth factor(pro-NGF):hints of local,mast cell-dependent regulation of NGF/pro-NGF action[J].The Journal of Biological Chemistry,2011,286(36):31 707-31 713.
[6]DiLiddo R,Grandi C,Venturini M,et al.Recombinant human TAT-OP1to enhance NGF neurogenic potential:Preliminary studies on PC12cells[J].Protein engineering design & amp,selection,2010,23(12):889-897.
[7]Mimura J,Kosaka K,Maruyama A,et al.Nrf2regulates NGF mRNA induction by carnosic acid in T98Gglioblastoma cells and normal human astrocytes[J].The Journal of Biochemistry,2011,150(2):209-217.
