多羟基对苯二甲酸合成工艺研究
2014-12-173胡启山
王 坤,吴 狄,3胡启山,唐 婧,邓 祥,3
(1.四川文理学院 化学化工学院,四川 达州635000;2.四川文理学院 四川革命老区发展研究中心,四川 达州635000;3.“特色植物开发研究”四川省高校重点实验室,四川 达州635000)
0 引言
多羟基对苯二甲酸类化合物是非常重要的有机中间体,广泛应用于药物和功能材料的合成,特别是高分子改性材料方面,可以利用分子中的羟基构成的氢键来改善一些性能.多羟基对苯二甲酸类化合物兼具有类水杨酸类物质的性质,其潜在的性能备受关注.多羟基对苯二甲酸类化合物主要包括2,3-二羟基对苯二甲酸(2,3-DHTA),2,5- 二羟基对苯二甲酸(2,5-DHTA),2,6-二羟基对苯二甲酸(2,6-DHTA),2,3,5-三羟基对苯二甲酸,2,3,5,6-四羟基对苯二甲酸5种,除了2,3,5-三羟基对苯二甲酸,2,3,5,6-四羟基对苯二甲酸这两种化合物研究报告比较少以外,[1]其余三种化合物在功能材料上的应用研究报道比较多.[2-4]
目前这几种化合物工业化较少,多以试剂级供应.随着材料和制药的发展,该类化合物有工业化的发展需要,所以探寻一条适合于工业化的合成工艺条件是比较有实用价值的.
该类化合物的合成按照原料不同大致分为三类:[1](1)2008年黄玉东等人[5]以环己二酮二甲酸二甲酯为原料制备2,5-DHTA,纯度大于99%,收率为90%,该文献提及该法可用于2,6-DHTA的制备,但未提及具体条件和数据,该法虽然收率和纯度较高,但是工业化仍有一定的困难,如原料来源比较困难,强酸,强碱对反应仪器有所限制;(2)以对苯二甲酸及其衍生物为原料,合成路线比较多,有生物发酵法、羟基自由基加成重排法、氨基对苯二甲酸重氮化水解法、卤代物水解法等.合成路线多但是工业化均有一定的难度,如生物发酵法容易造成二次污染,羟基自由基加成重排法反应设备较复杂,氨基对苯二甲酸重氮化水解法路线长,条件苛刻,卤代物水解法精制后处理比较麻烦;(3)以苯酚及其衍生物为原料,合成方法有水解开环法、氧化脱保护法、Kolbe-Schmitt法等.[1]水解开环法原料利用率低,经济效益低,氧化脱保护法路线长,环境污染严重工业化困难,Kolbe-Schmitt法合成路线简短,[6]条件加以优化可以实现工业化.
本文研究了常压Kolbe-Schmitt法合成多羟基对苯二甲酸类化合物,主要探讨2,6-DHTA的合成条件,希望为该类化合物的工业化贡献微薄之力.
1 实验部分
1.1 试剂
3,5-二羟基苯甲酸;甲酸;活性炭;亚硫酸钠;碳酸钾;盐酸;甲醇;均为AR,二氧化碳为高纯.
1.2 实验方法
在250mL的四口烧瓶中加入碳酸钾,水,加热搅拌均匀,滴加甲酸.反应2小时后,蒸出水,再向里面加入3,5-二羟基苯甲酸,碳酸钾,通入二氧化碳,在一定温度下反应4-5小时.待冷却后,用亚硫酸钠的热水溶液溶解反应物,用活性炭脱色,调节pH值,用酸碱中和精制,酸洗得到浅黄色的2,6-DHTA.原料改为对苯二酚,可以合成2,5-DHTA.
1.3 产品分析
用熔点仪测定产品熔点;用红外光谱和核磁共振测定并表征产品结构;[7]用高效液相色谱测定产品纯度.
2 结果与讨论
2.1 2,6-DHTA 的合成工艺探讨
2.1.1 实验原理
其反应过程如下
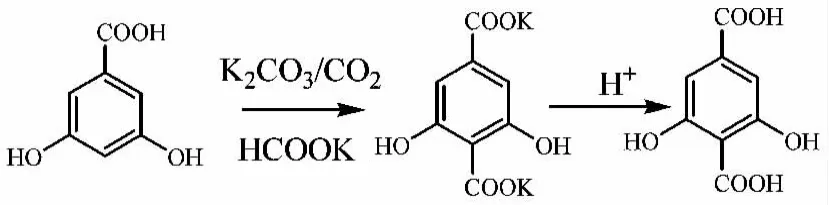
2.1.2 反应溶剂的选择
溶剂对反应有着极其重要的溶剂效应,[8]虽然溶剂一般不直接参与反应,但也会影响到反应热力学和动力学,可改变反应速率和反应机理,所以根据以甘油为溶剂羧化[9]和以甲酸钾溶剂制备2,5-DHTA的现有文献.本文设计了以甲酸钾和甘油为溶剂制备2,6-DHTA的路线,考察溶剂种类对反应的影响,实验结果见表1.

表1 溶剂种类对反应的影响
注:投料比和后处理都完全一致
从表1可以看出,虽然甘油为溶剂的纯度略高于以甲酸钾为溶剂的纯度,但以甲酸钾为溶剂的收率明显高于以甘油为溶剂的收率,使用甲酸钾为溶剂可以考虑溶剂的回收利用,[10]而有机溶剂的使用增加了生产成本.综合考虑,以甲酸钾为溶剂制备2,6-DHTA更具优势,因此在后续实验中,都选择了以甲酸钾为溶剂制备2,6-DHTA.
2.1.3 反应温度对产物的影响
虽然根据反应速率方程v=Ae-Ea/RTCAaCBb,可知温度对反应速率具有重要影响,通常采用提高温度的方法来提高反应速率.本反应的副产物推测是几个2,6-DHTA和3,5-二羟基苯甲酸的聚合物,反应温度升高,副产物会逐渐代替主产物.以甲酸钾为溶剂考察温度对实验的影响,结果见表2.
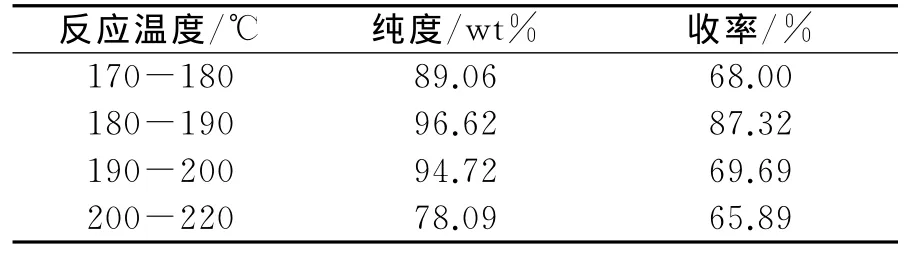
表2 温度对反应的影响
据表2可以看出180~190℃为较佳反应温度.反应温度低时反应不完全,产物的熔点为300℃,固化速度较快.温度较高时,可能是体系内发生分子间聚合反应等副反应.所以较佳的反应温度为180~190℃.
2.1.4 3,5-二羟基苯甲酸与甲酸钾的质量配比对反应的影响
3,5-二羟基苯甲酸与甲酸钾的质量配比对反应的影响,结果见表3.

表3 3,5-二羟基苯甲酸与甲酸钾的质量配比对反应的影响
从表3可以看出,3,5-二羟基苯甲酸与甲酸钾的质量配比为1:5.46时,收率高,为较佳比例.
2.1.5 反应时间对反应的影响
在上述确立的较优条件即3,5-二羟基苯甲酸与甲酸钾的质量配比为1:5.46,反应温度为180~190℃的条件下,来考察反应时间对羧化反应的影响,结果见表4.

表4 反应时间对反应的影响
注:物料配比相同 m(3,5-二羟基苯甲酸):m(HCOOK)=1:5.46,无溶剂状态下,反应温度为180~190℃.
由于此反应为非均相反应,反应时间较短时,反应进行得不充分,原料未完全转化为产物,收率较低;而反应时间较长时,对纯度影响不大,但收率反而下降,所以反应并不是反应时间越长越好.由表4可以看出反应时间为4h时较佳.
2.2 2,5-DHTA的合成工艺探讨
此法也适用于2,5-DHTA的制备,但具体的工艺条件有待于进一步探讨.
3 结论
(1)常压Kolbe-Schmitt法制备多羟基对苯二甲酸类化合物,比高压法更安全简单,更适合工业化.
(2)2,6-DHTA 的合成较佳的工艺条件是以甲酸钾为溶剂,m(3,5-二羟基苯甲酸):m(HCOOK)=1:5.46在180-190℃下反应4小时,HPLC纯度为99.62% ,收率87.32%.
(3)此法也适合于2,5-DHTA的制备.
[1]张建庭,王 坤,赵德明,等.多羟基对苯二甲酸类化合物的合成与应用研究进展[J].应用化学,2010(11):1241-1250.
[2]Tang Y H,Tsai M H,Wu C C,etc.Elecronic properties of heterocyclic aromatic hydroxyl rigid-rod polymers[J].Polymer,2004(2):459.
[3]Sikkema D J.Design,synthesis and properties of a novel rigid rod polymer,PIPD or ‘M5’:high modulus and tenacity fibers with substantial compressive strength[J].Polymer,1998(24):5981.
[4]Sikkema D J,Rodini D J,Dindi H,etc.WO2006105076[P].2006.
[5]孙 硕,黄玉东,林 宏,等.2,5-二羟基对苯二甲酸的合成研究[J].化学与黏合,2007(6):413-415.
[6]张曼玲,李春萍.常压羧化法制备2,6-二羟基苯甲酸[J].天然气化工,2007(6):46-49.
[7]王 坤,吴 狄,邓 祥.2,6-二羟基对苯二甲酸的合成及表征[J].四川文理学院学报,2012(2):57-60.
[8]陈荣业.有机合成工艺优化[M].北京:化学工业出版社,2006:175-179.
[9]By J.S.Gray,G.C.J.Martin,W.Rigby.Aurofusarin[J].J.Chem.Soc,1967(21):2580-2587.
[10]王 坤,王建超,吴 狄.Kolbe-Schmitt制备多羟基对苯二甲酸类化合物中甲酸钾的回收利用研究[J].绿色科技,2012(5):169-171.
