川佛手中总黄酮的超声波提取工艺优化
2014-12-17黄小梅
邓 祥,黄小梅,吴 狄
(1.四川文理学院 化学化工学院,四川 达州635000;2.“特色植物开发研究”四川省高校重点实验室,四川 达州635000)
0 引言
佛手(Bergamot)为芸香科植物佛手的干燥果实.又名佛手柑、佛手香橼、密筒柑、福寿柑、密罗柑、五指柑等,[1]为枸橼的变种.其味辛、苦、甘,性温,入肝、脾、胃三经,有理气化痰、止呕消胀、舒肝健脾、和止胃痛之功效,用于治疗肝郁气滞、脾胃气滞、胸胁胀痛、食少呕吐、胃脘痞满等症,[2-3]其主要化学成分为黄酮、挥发油和糖类物质.[4]大量研究表明:佛手具有降血糖、降血脂、抗氧化和抗肿瘤等多种药理活性,其有效成分除与其所含的多糖类物质有关外,还可能与黄酮类化合物有关.[5-8]因此,研究佛手中黄酮类物质对于提高佛手的经济价值具有十分重要的意义.[9]
目前,黄酮的提取方法主要有超临界流体萃取、溶剂浸提、树脂吸附分离、微波浸提和离子沉淀等方法.超声波提取法作为一种高效节能的提取技术,是近年来中药材提取研究的热点,有着良好的应用前景.本文采用超声波提取方法,利用单因素实验和正交实验对川佛手中的总黄酮进行了研究,确定了川佛手中总黄酮的最佳提取方法和工艺参数,为川佛手中总黄酮的提取提供技术参考.
1 仪器、试剂和样品
1.1 主要仪器设备
BILON-2008型超声波萃取仪(天津比朗实验仪器制造有限公司);UV-2550型紫外可见分光光度计(日本岛津);GT10-2型离心机(北京时代北利离心机有限公司);TG328A型电子天平(上海精密仪器有限公司);60目的筛子.
1.2 主要材料和试剂
芦丁标准品(上海试剂);川佛手(四川达州产);氢氧化钠、硝酸铝、亚硝酸钠和无水乙醇等均为分析纯;实验用水均为二次蒸馏水.
2 方法与实验
2.1 方法学考察
2.1.1 标准曲线的绘制[10-12]
准确称取20.0mg芦丁标准品,用适量体积分数为50%的乙醇溶解完全,并在100mL的容量瓶中定容,作为储备液.从储备液中分别移取0 mL、1mL、2mL、4mL、6mL、8mL、10mL 于 7个25mL容量瓶中,分别依次加入50%乙醇溶液至容量瓶的一半,加入质量分数为5%的NaNO2溶液1.0mL,混合均匀后放置5min,加入质量分数为10%的 Al(NO3)3溶液1.0mL,均匀混合后放置5min,加入1mol·L-1的氢氧化钠溶液5mL,混匀,最后用50%的乙醇定容至刻度,摇匀,放置10min.以第1瓶作对照,在510nm最大吸收波长处测定吸光度,绘制标准曲线,如图1.
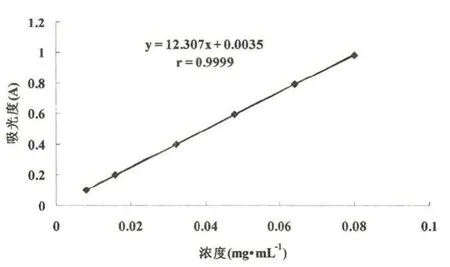
图1 总黄酮含量测定标准曲线
2.1.2 精密度测定实验
精确称取川佛手粉末0.5g,按2.2项方法操作,取不同时间点,重复测定5次,其吸光度分别为1.672,1.670,1.673,1.677,1.674,RSD 为0.15%.
2.1.3 重复性测定实验
精确称取川佛手粉末5份,各0.5g,按2.2项方法操作,其吸光度分别为1.642,1.635,1.647,1.629,1.622,RSD为0.61%.
2.1.4 加样回收率实验
精确称取已知含量的川佛手粉末5份,各0.5g,加入不同量的芦丁对照品,按2.2项方法操作测定加样回收率,依法重复测定3次,平均回收率为97.92%,RSD为1.36%.
2.2 样品中总黄酮的提取及测定
将干燥好的川佛手片用粉碎机粉碎,过60目筛,备用.精确称取0.5g川佛手粉末于离心管中,加入适量体积分数为50%的乙醇,用超声波萃取仪进行超声提取后,离心,将上层清液收集于25mL容量瓶中,重复提取2~3次,用50%乙醇定容,再准确移取定容后的提取液5mL于25mL容量瓶中,按2.1.1的方法处理,测定吸光度,得到提取液浓度,按下式计算其提取效率[13].

其中:C—提取液中的总黄酮浓度(g·L-1)
V—提取液的体积(L)
M—川佛手的质量(g)
3 结果与讨论
3.1 单因素实验
3.1.1 乙醇体积分数选择
在10mL溶液、超声温度50℃和超声功率1000W的条件下超声1.0h,分别讨论乙醇体积分数为30、40、50、60、70、80%的情况下对总黄酮提取率的影响,如图2所示.
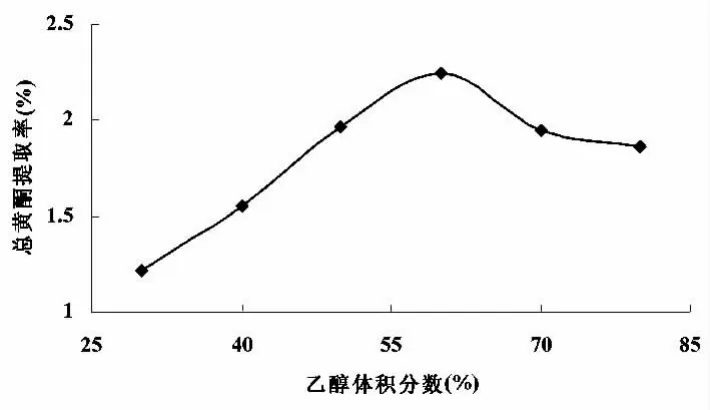
图2 乙醇体积分数选择
由图可知,乙醇体积分数在60%之前,总黄酮的提取率随乙醇体积分数的增大而呈现上升趋势,之后随着乙醇体积分数的增大而呈现缓和的下降趋势.根据相似相容原理,这可能是由于乙醇体积分数增大,醇溶性物质大量溶出,相互竞争,反而限制了某些黄酮类物质的溶出,导致了总黄酮的溶解度降低.因此最佳的乙醇体积分数为60%,最大提取率为2.25%.
3.1.2 料液比选择
在乙醇体积分数为60%、超声温度50℃和超声功率1000W条件下超声1.0h,分别讨论在料液比为1∶10、1∶12、1∶14、1∶16、1∶18、1∶20、1∶22g·mL-1情况下对黄酮提取率的影响,如图3所示.
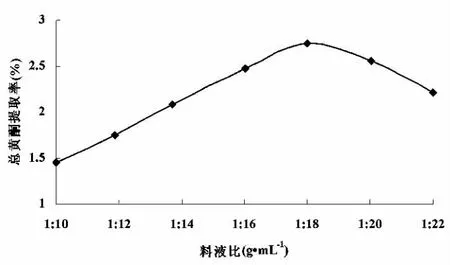
图3 液料比选择
料液比较小时,总黄酮提取率较低;随着料液比的不断增大,总黄酮的提取越来越充分,提取率不断增加,但料液比过大,其它组分溶解形成相互竞争反而不利于总黄酮的浸出.从图3可知当料液比为1:18(g·mL-1)时提取效果最好,总黄酮最大提取率为2.75%.
3.1.3 超声温度选择
在乙醇体积分数为60%、料液比为1∶18g·mL-1和超声功率1000W的条件下超声1.0h,分别讨论在超声温度为25、35、45、55、65、75℃情况下对黄酮提取率的影响,如图4所示.
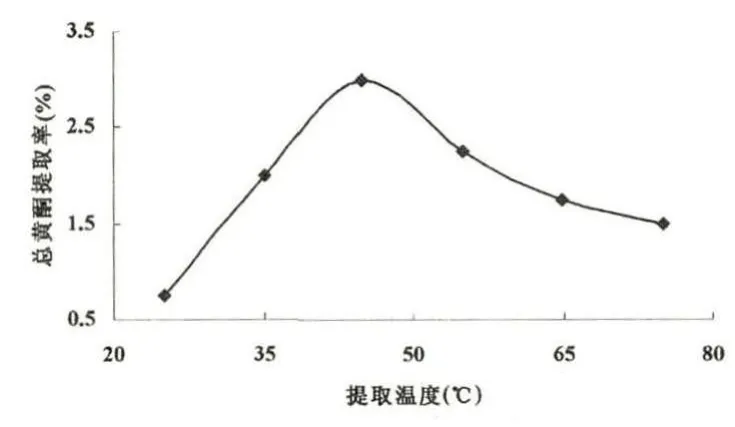
图4 超声温度选择
从图中可以看出,温度在45℃之前,总黄酮的提取率随着温度的升高而增大,之后随着温度的升高而减小.究其原因是:超声温度过低,总黄酮不易浸出,提取率较低;温度较高,分子的热运动加剧,有利于总黄酮的浸出,提取率较高;温度过高,黄酮不稳定,导致黄酮部分分解,提取率反而降低.因此最佳的超声温度为45℃,提取率最大值为3.00%.
3.1.4 超声时间选择
在乙醇体积分数为60%、料液比为1∶18g·mL-1、超声温度45℃和超声功率1000W的条件下,分别讨论在提取时间为:0.5、1.0、1.5、2.0、2.5、3.0h情况下对总黄酮提取率的影响,如图5所示.

图5 超声时间选择
由上图可知,随着超声时间的延长,总黄酮的提取率不断增大,1.5h时达最大值,之后,增加趋势变缓,甚至略有下降.这可能是因为超声时间太长,被提取出来的其它组分抑制部分黄酮的浸出,导致总黄酮提取率降低.所以最佳超声时间选1.5h,提取率最大值为3.75%.
3.1.5 超声功率选择
在乙醇体积分数为60%、料液比为1∶18g·mL-1、超声温度45℃条件下超声1.5h,分别讨论在提取功率为:300、500、700、900、1100、1300W情况下对总黄酮提取率的影响,如图6所示.
由上图可知,总黄酮的提取率随着超声功率的增加而不断增加,当超声功率超过900W时,总黄酮的提取率趋于稳定.因此选取900W为最佳超声功率,其最大提取率为3.78%.
3.2 正交实验
根据单因素实验结果,固定900W超声功率不变,对乙醇体积分数(A)、超声温度(B)、料液比(C)和超声时间(D)四个因素进行 L9(34)正交实验,考察川佛手中总黄酮的提取率.其实验结果如表1和表2所示.

表1 正交实验因素水平表

表2 L9(34)正交实验结果表
由以上实验数据和极差R1>R2>R3>R4分析可知:川佛手总黄酮提取工艺中,各因素影响的主次顺序为A>B>C>D,即乙醇体积分数、超声温度、料液比,其次是超声时间,可见,影响总黄酮提取率的主要因素是乙醇的体积分数.通过正交实验得到的最佳提取工艺为A2B2C3D1,即乙醇体积分数为60%,超声温度为45℃,料液比为1:20(g·mL-1),超声时间为1.0h,总黄酮的提取率为4.160%.
4 结论
溶液为溶剂,采用在超声波条件下进行浸提,研究了乙醇体积分数、超声温度、料液比、超声时间和超声功率等因素对总黄酮提取率的影响,并采用正交实验对提取工艺进行优化,确定了川佛手中总黄酮的最佳提取方法和工艺参数:乙醇体积分数为60%,超声温度为45℃,料液比为1:20(g·mL-1),超声时间为1.0h,超声功率为900 W,总黄酮的提取率可达4.16%.
本文以川产道地中药材佛手为原料和乙醇水
[1]江苏新医学院.中药大辞典:上[M].上海:上海人民出版社,1986:1141.
[2]国家药典委员会.中华人民共和国药典:第1部[M].北京:化学工业出版社,2005:124.
[3]姜立春,黄成思,杨 澈,等.川佛手总黄酮提取及抗氧化性研究[J].江苏农业科学,2010(3):340-342.
[4]袁旭江,林 励.中药佛手不同品种间的研究及其存在问题[J].广州中医药大学学报,2002(1):73-76.
[5]O.Benavente-Garcia,J.Castillo.Update on Uses and Propertise of Citrus Flavonoids:New Findings in Anticancer,Cardiovascular,and Anti-inflammatory Activity[J].Journal of Agricultural and Food chemistry,2008(56):6185-6205.
[6]Mandalari G,Bennett R N,Bisignano G,et al.Antimicrobial activity of flavonoids extracted from Bergamot(Citrus bergamia Risso)peel,a byproduct of the essential oil industry[J].Journal of Applied Microbiology,2007(6):2056-2064.
[7]Giuseppina Mandalari,Richard N.Bennett,Andrew R.Kirby,et al.Enzymatic hydrolysis of Flavonoids and Pectic Oligosaccharides from Bergamot(Citrus bergamia Risso)peel[J].Journal of Agricultural and Food chemistry,2006(54):8307-8313.
[8]章 斌,侯小桢,饶 强.响应面优化佛手总黄酮超声提取及抗氧化研究[J].食品研究与开发,2012(2):27-31.
[9]章 斌,侯小桢.复合酶法提取广佛手总黄酮的工艺[J].食品研究与开发,2010(10):188-191.
[10]刘增根,党 军,江 磊,等.柴达木枸杞叶有效成分高压均质提取及纯化[J].精细化工,2011(4):350-354.
[11]李攀登,李金玲,王宏伟,等.鸡树条荚蒾化学成分测定分析[J].人参研究,2009(2):16-19.
[12]罗伟强.四种提取柑皮中黄酮化合物的方法比较[J].甘肃化工,2003(1):25-26.
