人参寡糖粗提物对巨噬细胞的免疫调节作用
2014-12-16张晓瑜李波焦丽丽
张晓瑜 李波 焦丽丽
(长春中医药大学人参科学人参研究院 吉林长春 130117)
人参是五加科植物人参(Panax ginseng C.A.Meyer)的干燥根,自古以来被认为是医食同补的尚佳药用植物,具有大补元气,固脱生津,安神的作用。人参含有多种药效成分,已被证明的药物活性成分有皂甙、多糖、多肽、黄酮、挥发油等[1]。另外有大量研究表明人参水提物具有良好的免疫调节活性,能诱导淋巴细胞增殖及T淋巴细胞活性[2]。人参水提物中除含有多糖、皂苷、蛋白质外,还有一定量的人参寡糖。
寡糖一般是指由2-10个单糖分子通过糖苷键连接而成的化合物,在生命体内,主要以糖蛋白、糖脂和糖肽等形式参与生命活动的,在发挥生物学功能的过程中起决定作用。随着对天然寡糖研究的日益深入,它的独特性也逐渐展现在人们面前。天然寡糖不仅具有抗炎症、抗凝血、增强造血功能、抗病毒、免疫调节等生物活性,而且安全无毒[3-7]。迄今,对于人参寡糖的研究鲜少有报道,尤其是人参寡糖在免疫调节及抗肿瘤方面的作用及实验研究尚未见报道。因此,我们从人参中提取了人参寡糖,并对其抗肿瘤作用及免疫调节作用进行了研究,发现人参寡糖对淋巴细胞和巨噬细胞均可产生一定的影响,本文仅针对人参寡糖对巨噬细胞的激活作用进行探讨。
1 材料与方法
1.1 样品、试剂及仪器
5年生人参(Panax ginseng C.A.Meyer)购进于吉林省白山市抚松县;1640培养基为Gibco公司产品;新生牛血清为杭州四季青产品;脂多糖(LPS);二甲基亚砜(DMSO)、3-4,5-二甲基噻唑-2-2,5-二苯基四氮唑溴盐(MTT)均为Sigma公司产品;Griess试剂盒和iNOS测定试剂盒购自南京建成生物工程研究所;活性氧检测试剂盒购买于碧云天生物技术研究所;ICR雄性小鼠(20.0±2.0g)购买于吉林大学;其余药品均为国产分析纯。
二氧化碳培养箱,日本三洋电子公司;离心机,Sigma公司;酶标仪瑞士TECAN公司。
1.2 CGOS提取方法
前期试验运用正交试验法确定人参寡糖粗提物的最佳提取条件为:料液比1:10,提取温度70°C,提取次数3次,提取时间90min。方法:精确称取人参粉末10g,加蒸馏水100ml,70°C提取90min,冷却至室温,离心,上清液储存于(4℃),残渣重复上述操作,合并上清液,旋蒸至50ml,冻干,即得粗寡糖。
1.3 CGOS对巨噬细胞的激活作用
1.3.1 巨噬细胞制备
用4%可溶性淀粉(2ml)连续腹腔注射ICR雄鼠3天,第4天将小鼠脱颈处死并用75%的乙醇浸泡10-15min,用预温的1640无血清培养基(10ml)清洗小鼠腹腔,反复吹打,收集腹腔液,离心(1500r/min,5min),弃上清后用RPMI-1640培养基重新悬浮巨噬细胞。将细胞调至5×106/ml加至96孔板中,每孔100μl,置37℃,5% CO2培养箱培养3h,用37℃预温的PBS(0.01M,pH 7.4)清洗培养板2-3次,去除未贴壁细胞,即为纯化的巨噬细胞。
1.3.2 巨噬细胞吞噬活性检测
巨噬细胞吞噬中性红:按“1.3.1”的方法将巨噬细胞纯化,将CGOS 1μg/ml、10μg/ml、50μg/ml、100μg/ml和200μg/ml,分别加入96孔板中(100μl/孔),分别继续培养24h,弃去上清,加入质量浓度为0.075% 中性红溶液(100μl/孔),继续培养1h,弃上清,用PBS(0.01M,pH 7.4)清洗96孔板2~3遍,加细胞裂解液(乙醇:乙酸=1:1,v/v)100μl孵育24h。用酶标仪检测,波长为540nm,LPS(20 μg/ml)为阳性对照,每组重复5个复孔。
1.3.3 巨噬细胞中NO含量检测
由于NO在细胞外不稳定,直接检测很难,现有的检测方法是使用Griess试剂检测培养基上清中亚硝酸盐的浓度,以间接地反应巨噬细胞产生的NO的水平。此方法使用NaNO2作标准品绘制标准曲线。
按照上述方法制备巨噬细胞,加入待测样品(1-200μg/ml),LPS(20μg/ml)为阳性对照,分别培养24h,用Griess试剂盒检测上清中NO2-的含量,并根据所绘制的NaNO2溶液标准曲线计算NO的产量。
1.3.4 诱导型一氧化氮合酶(iNOS)的检测
纯化后的巨噬细胞用不同浓度的待测样品刺激,取细胞培养基上清100μl,通过比色法测iNOS的酶活力,按照试剂盒说明进行操作,每个浓度5个复孔,并根据公式计算酶活力。
一个酶活力单位定义:=(iNOS检测管OD值-iNOS空白管OD值/呈色物纳摩尔消光系数)×(反应液总体积/取样量)×(1/比色光径×反应时间)÷1000
1.3.5 TNF-α的诱生和检测
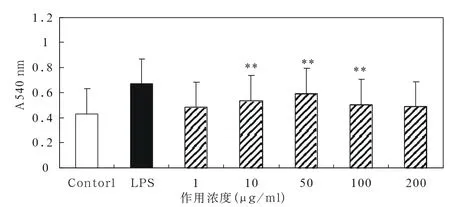
图1 CGOS 对小鼠腹腔巨噬细胞吞噬中性红的影响Fig 1 Effect of the oilgosaccharide CGOS on phagocytosis of macrophages

图2 CGOS对小鼠巨噬细胞分泌NO产量的影响Fig 2 Effect of the oilgosaccharide CGOS on NO secretion of macrophages
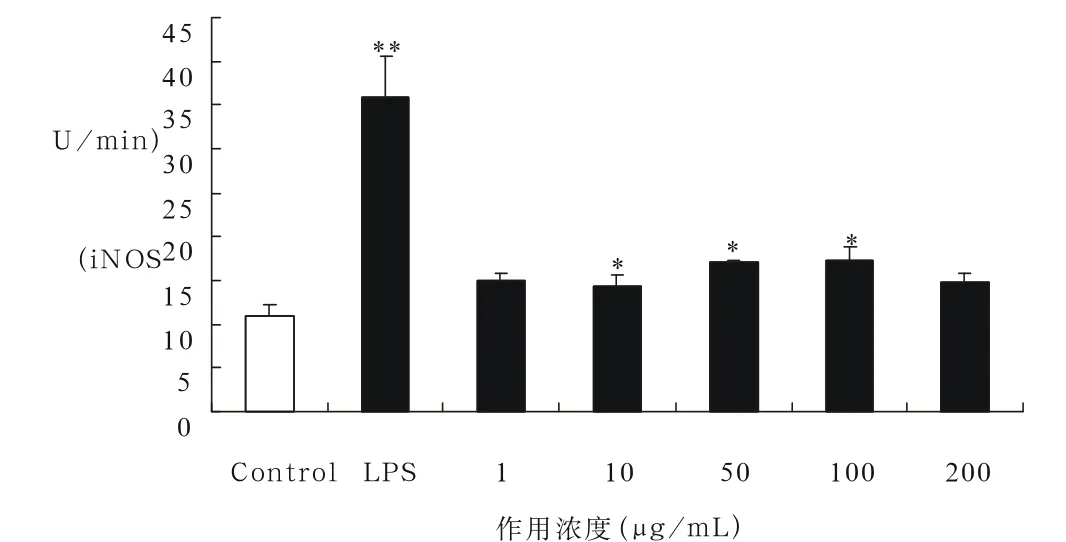
图3 CGOS对iNOS酶活力的影响Fig 3 Effect of CGOS on iNOS activity

图4 CGOS对巨噬细胞分泌TNF-α的影响Fig.4 Effect of CGOS on TNF-α production secreted by macrophages
小鼠腹腔巨噬细胞的制备按照上述同样方式进行制备,用1-200μg/ml的人参寡糖粗提37℃培养24h,收集上清用于TNF-α的活性的测定。培养液上清中的TNF-α按照Ferrari等人报道的方法进行测定,靶细胞为L929细胞,以其对L929细胞的细胞毒性表示TNF-α的活性。
2 结果
2.1 CGOS对巨噬细胞吞噬中性红的影响
为了观察人参寡糖CGOS体外对腹腔巨噬细胞的激活作用,首先检测了CGOS对巨噬细胞吞噬功能的影响。结果如图1所示,CGOS在10-100μg/ml能够增强巨噬细胞的吞噬功能(P<0.01),并且,该作用呈现良好的剂量依赖关系,当作用浓度为50μg/mL时作用最明显。
2.2 巨噬细胞中NO含量与iNOS活性检测
如图2,小鼠腹腔巨噬细胞经CGOS刺激后,NO的产量明显增加,并且在10-100μg/ml范围内,随着作用浓度的增加,巨噬细胞分泌NO的产量也逐渐增加,当作用浓度为100μg/ml时,NO的分泌水平最高。
上述结果表明CGOS与巨噬细胞共同培养后,巨噬细胞分泌NO的能力增强,为了检测NO产量的增加是否与iNOS的增量调节有关,我们检测了CGOS刺激后,iNOS酶活力的变化。结果表明,CGOS刺激后,巨噬细胞的iNOS的酶活力也相应增加(图3),并且当浓度为100μg/ml时,iNOS酶活力最强。由此可见,CGOS作用后,巨噬细胞中iNOS的酶活力增强,从而导致NO产量的增加。
2.3 TNF-α的诱生和检测
为了进一步检测CGOS对巨噬细胞的激活作用,我们也检测了CGOS刺激后,巨噬细胞分泌TNF-α水平的变化。结果如图4所示,用CGOS(1-200μg/ml)作用的巨噬细胞培养液上清处理L929细胞后,其细胞活力明显下降,最高抑制率达40.45%。该结果表明CGOS能刺激巨噬细胞分泌TNF-α,从而导致其杀伤L929细胞。
3 讨论
巨噬细胞对于保持机体自身稳定是必不可少的,并且在宿主防御系统中占据首要及中枢地位。首先,巨噬细胞通过非特异性吞噬作用杀伤微生物感染细胞和肿瘤细胞。除此以外,巨噬细胞还可以起到呈递抗原的作用,或释放一些细胞毒性因子(IL-1,TNF-α等)、活性氧(ROS)如O-2,H2O2及NO而显示直接的细胞毒性。其中,NO是杀伤肿瘤细胞和病原微生物的主要物质。在免疫系统中,由巨噬细胞合成的大量NO具有细胞毒作用,可杀伤微生物(包括细菌、病毒、真菌)、寄生虫和肿瘤细胞等[13-14]。一氧化氮合酶(NOS)是NO合成过程中的关键酶。目前已知NOS有3种异构体:神经型(nNOS),内皮型(eNOS),及诱生型(iNOS)。其中诱导型一氧化氮合酶(iNOS)主要产生于巨噬细胞、中性粒细胞自然杀伤细胞中。iNOS在静息状态下的巨噬细胞中不表达,但当巨噬细胞被激活时,iNOS可以大量表达,诱发机体产生大量的NO[6]。因此在本试验中选择了以上几个指标来检测人参寡糖粗提物对巨噬细胞的激活作用。
本实验采用热水低温提取的方法,从人参中提取了人参寡糖粗提物CGOS,首先检测了CGOS对小鼠巨噬细胞吞噬功能的影响,结果CGOS在1μg/ml-200μg/ml范围内能明显增强小鼠腹腔巨噬细胞吞噬中性红能力;其分泌TNF-α和NO的水平也显著提高;本实验同时还证明CGOS通过增强iNOS的酶活力,从而诱导了巨噬细胞分泌大量NO。表明人参寡糖CGOS对巨噬细胞有明显的激活作用,这有可能是人参增强机体免疫力的作用方式之一。也将为人参的深加工提供又一科学依据。然而,人参寡糖激活巨噬细胞的作用机制仍不清楚。寡糖的单糖组成、连接键型、聚合度等都会影响其生物活性,因此,人参寡糖激活巨噬细胞的作用机理还有待于进一步研究。
[1]Anoja S A,Wu J A,Yuan C S.Ginseng Pharmacology multiple constituents and multiole actions.Biochemical Pharmacology,58,1685-1693,1999.
[2]Mizuno M,Yamada J,Terai H.Differences in immunomodulating effects between wild and cultured Panax Ginseng.Biochemical and Biophysical Research Communications.1994,200(3):1672-1678.
[3]陈黎,雷玉林.人乳低寡糖的结构及其特殊功能.生命的化学,2004,24(3):332-334.
[4]Yuan H M,Song J M,Li X G,et al.Immunomodulation and antitumor activity of k-carrageenan oligosaccharides.Cancer Letters,2006,243,228-234.
[5]刘福君,赵修南,汤建芳,等.地黄低聚糖对快速老化模型小鼠造血功能的影响.中国药理学通报,1997,13(6):509-512.
[6]郑永晨.一氧化氮与巨噬细胞的免疫调节.国外医学免疫学分册,1995,4,204-206.