蒽环类抗生素糖基化的研究进展
2014-12-16刘芷瑜
刘芷瑜
(福建师范大学生命科学学院 福建福州 350108)
目前,已发现2000余种的蒽环类抗生素,大多都具有抗肿瘤活性,然而能够应用于临床治疗却不多,这些抗肿瘤药物应用时还伴有心脏毒性和耐药性等副作用[1],而可用于临床治疗的新型天然蒽环类抗生素的筛选十分困难,因此对蒽环类抗生素进行结构修饰,以期获得生物活性更好,抗药性更低的新型抗生素药物。糖基化是目前改造蒽环类化合物成药的重要手段,催化糖基化反应的糖基转移酶(GTase)作用机制已逐渐被阐明。本文介绍了近年来糖基化的蒽环类抗生素,以具体事例介绍了糖基化的生物功能,对控制其糖基化的糖基转移酶及其编码基因进行了阐述,简述了近年来蒽环类抗生素的糖基化方式。
1 蒽环类抗生素及其作用机制
蒽环类(Anthracycline)抗生素是由一个四环糖苷配基通过糖苷键与一个或多个糖基侧链连接而成的一类糖苷类化合物[2](见图1)。可广泛用于治疗各种癌症,如乳腺癌、淋巴瘤、急性白血病、神经细胞瘤和软组织肉瘤等[3]。目前常见的蒽环类抗生素主要有道诺霉素(Daunorubicin)、阿霉素(Adriamycin)、诺加霉素(Aogalamycin)、表柔比星(Epirubicin)、阿柔比星(Aclacinomycin)、洋红霉素(Carminomycin)、吡柔比星(Pirarubicin)、米托蒽醌(Mitoxantrone)以及伊达比星(Idarubicin)等。
2 蒽环类抗生素糖基配体的生物功能
在蒽环类抗生素的芳香族聚酮体上通常具有一个或多个的脱氧己糖修饰,这些糖基不仅能增加化合物的溶解性,而且对识别作用靶点DNA序列也很重要,同时在一定程度上增强某些抗生素的化学稳定性[4]。
蒽环类抗生素聚酮结构的A环和糖基部分对DNA的识别及位点的选择起着关键的作用。Lown等研究发现这类化合物与DNA的作用方式是蒽醌环嵌入DNA双螺旋,蒽醌环的长轴基本垂直于碱基对的氢键,在DNA的小沟区存在氨基糖,大沟区有D环插入[5]。这样的方式使碱基对之间的距离增加,引起DNA裂解。
诺加霉素是于1965年被发现由黑胡桃链霉菌(Streptomy cesnogalaterATCC27451)产生的重要的蒽环类抗生素[6],其生物活性需要两个脱氧己糖:诺加糖胺(nogalamine)、诺加糖(nogalose),诺加霉素可与DNA发生交叉联结,部分断开DNA的双螺旋结构对多种肿瘤细胞具有强抑制活性和抗革兰氏阳性菌作用[7]。在许多情况下,糖苷配基结构的改变可以产生新的有活性的药物[8]。表柔比星(epirubicin)是阿霉素的衍生物,通过在阿霉素的4-OH部位添加脱氧糖基团,使得这种衍生物比道诺霉素毒性更小[3],大大降低了心脏毒性而成为更理想的临床抗肿瘤药物。从加利利链霉菌(Strepto myces galilaeus)中提取的新蒽环抗生素阿柔比星X(见图1b),经IR吸收光谱显示在其配糖体阿柔比星存在羟基、酯羰基。经检测,阿柔比星X有更为显著的胞内毒性[9]。越野他汀(kosinostatin,KST)是从海洋小单孢菌Micromonospora sp.TP-A0468中分离得到的一种具有良好抗肿瘤活性的蒽环类抗生素,异醌环素B与越野他汀是结构类似物,对异醌环素B糖基的3''位脱氧得到脱氧异醌环素B,李慧等人用人肺癌细胞h1299测试了二者的体外细胞毒性,发现脱氧异醌环素B比异醌环素B的活性降低1个数量级[10],这也体现了研究糖基化的天然产物的重要意义。
3 蒽环抗生素的糖基化
3.1 蒽环糖基转移酶
糖基转移酶(glycosyltransferase,GTase)通常负责将供体的糖单体部分转移到特异的受体,从而形成特异的糖苷键[11]。这些特定的受体分子可以是核酸、蛋白质、脂类、寡糖、各类杂环化合物及次级代谢产物。糖基供体包括核苷酸二磷酸活化形式(NDP-)的各种糖基,主要是一些NDP-己糖,其中UDP-葡萄糖最为常见;另外还包括一些NDP-脱氧己糖以及许多稀有的NDP-糖胺等[12]。
糖基转移酶的机制:(1)GT-催化的反应的可能的立体化学结果。(2)直接位移机制提出了反相GTs。(3)双位移机制提出保留GTs。(4)替代机制来保留涉及由糖分子作为离去基团出发的同一面上亲核进攻GTs。(5)提议为芳基-C-糖苷键的形成机制。(6)UrdGT2催化了C-和O-糖苷键的形成。大部分糖基转移酶均有类似尿苷二磷酸(UDP)-葡萄糖和UDP-葡萄糖醛转移酶中C端富含甘氨酸的保守区域[13]。Liu、Salas对糖基转移酶的催化机制做了详尽综述[14]。
3.2 糖基转移酶的编码基因
随着对抗生素生物合成基因簇研究的不断深入,目前已报道了50多个编码糖基转移酶的基因[13]。通过插入失活的糖合成基因或敲除部分基因得到缺失了糖环的中间体或是糖苷配基上连接了结构已改变的糖代谢中间体,以证明某些基因参与糖的生物合成。
许多糖基转移酶基因的作用机制大体相似。例如,能够编码转移氨基脱氧糖的糖基转移酶基因,cosG[3](来自链霉菌中的cosmomycin),Dnrs(来自S.peucetius中的道诺霉素),AclS(来自S.galilaeus中的阿柔比星),RhoG(来自S.violaceus中的紫红霉素)以及DesVII(来自S.venezuelaeZ中的苦霉素)。CosK与AknK相似(从S.galilaeus中提出的阿柔比星)都能在阿柔比星生物合成中添加2-脱氧-岩藻糖。
Sianidis等人从Streptomyces echinatus中克隆了一种编码新型糖基转移酶AraGT的基因araGT。AraGT能将甲基戊糖转移至Aranciamycin糖苷配基上。AraGT的出现为扩大Aranciamycin衍生物文库有重要意义[4]。诺加霉素衍生物诺加霉素R和诺加霉素F,二者的形成都是由于诺加霉素的诺加糖被取代,诺加霉素的生物合成中有三个糖基转移酶,其中SnogE和SnogD分别作为诺加糖和诺加糖胺的转移酶。诺加糖胺转移酶SnogD能够从诺加霉素F中去除2—脱氧糖,而在snogZ簇中的糖基转移酶作用不大[15]。若中断snogE基因得突变株mSXW-2-71发酵产物中检测不到诺加霉素的产生[16]。
有些糖基转移酶具有一定的灵活的底物适应性,可以识别多种糖基供体。例如,异醌环素B糖基的C-3''位脱氧产生的脱氧异醌环素B是越野他汀和异醌环素B的结构类似物,其基因簇中的kstD5能够编码一个对糖基底物识别不专一的糖基转移酶介导越野他汀与异醌环素B分子中两种不同糖基的识别和转移[10]。Lu等报道了从S.galilaeus ATCC 31615中获取的糖基转移酶基因aknK。aknK编码的AknKGT作用于蒽环类抗肿瘤药物阿柔比星A的生物合成。AknK不仅能够通过串联L-2-脱氧岩藻糖来催化一系列三糖链,还可以接受其他单糖基化的蒽环类抗生素,包括道诺霉素、阿霉素、伊达比星等来建立蒽环类抗生素的二糖变体[17]。又如,埃洛霉素(Elloramycin)是从S.olivaceus Tu2353中提出的蒽环类抗生素类似物,其基因编码的elmGT能够转移不同的单糖和二糖至糖苷配基8-demethyl-tetracenomycin C(8-DMTC)上。质粒cos16F4包含编码合成埃罗霉素中间体8-脱甲基丁省霉素C的生物合成基因簇以及elmGT基因,在竹桃霉素的生物合成基因簇中有合成L-鼠李糖、L-橄榄糖和L-夹竹桃糖的3种质粒。将cos16F4与上述质粒重组,在S.olivaceus中共同表达出三种新的混合抗生素。将cos16F4分别与合成NDP-Lmycarose、NDP-4-deacetyl-L-nogalose的质粒pFL942、pFL947共同表达得到相应糖苷化衍生物[18],这些都说明elmGT的宽的底物适应性。许多酶都具有宽泛性,像将阿维菌素中的4-酮基还原酶AvrE或者红霉素合成途径中的EryBIV分别在Streptomyces peucetius所产的阿霉素(本身缺乏4-酮基还原酶合成基因)中表达都能得到表柔比星[19]。研究利用这些酶的特性为获得更多蒽环类衍生物奠定了基础。
其实,大部分蒽环糖基转移酶是单独作用的,但是要在自然状态下糖基化多种糖苷配基还需其他辅助蛋白的激活,例如阿柔比星A的生物合成过程中,AknSGT能将L-氨基脱氧糖转移至阿柔比星A的糖苷配基上,而只有经过辅助蛋白AknT的激活才能发挥糖基化功能[20]。若同时敲除光辉霉素的4个糖基转移酶形成的突变株中不能合成得到双糖衍生物,但有趣的是当同时表达光辉霉素的两个糖苷转移酶(MemGⅠ、MemGⅡ)和ElmGT时能得到这个双糖的衍生物,这是首次通过3个糖苷转移酶共同作用产生新糖苷化衍生物,此衍生物的产生是运用糖苷转移酶的组合生物合成[21]。在大环内酯类抗生素中也有类似情况,DesVII作用则需要一个辅助蛋DesVIII,EryCII作用需要辅助蛋白EryCIII的激活。
3.3 糖基化方式
糖基化通常发生在蒽环类抗生素生物合成的后期,利用糖基转移酶使糖苷配基在C7-OH上被糖基化[17]。根据糖苷键类型不同,可分为O-糖基化、N-糖基化、C-糖基化。C-糖基化较为罕见,糖基供体和受体之间通过稀有的C-C糖苷键连接其生物学机制还未彻底阐明。目前含C-糖基化的抗生素有榴红菌素(granaticin)、smiocyclinoneD8、美达霉素(medemycin)、gilvocarcin、hedamycin、乌达霉素(urdamycin)[22],而蒽环类抗生素的C-糖基化更为少见,诺加霉素的两个脱氧糖:诺加糖胺(Nogalamine)、诺加糖(Nogalose),分别附加在芳香聚酮糖苷配基的C1和C7位,氨基诺加糖通过C-C键连接C2和C5'',由此形成一个蒽环骨架C-C键缩合成并环的结构[23](见图2)。
目前,通过遗传和生化方法进行体内糖基化已取得显著进展。例如,通过重塑糖生物合成工具以产生不同的糖结构,将外源的糖基转移酶基因在适当的菌株中异源表达以促进各种糖供体和受体之间耦合,又如通过化学方法将非天然的糖基转移至天然产物中[4]。然而由于细胞生长或死亡都会抑制这种体内糖基化,化学试剂又会影响复杂的糖基化系统,寻找更合适的糖基化方式非常重要。
将分离的糖基转移酶在体外进行糖基化可以基本克服上述难题,例如利用体外酶法对天然产物糖基进行侧链改造[24]:通过体外制备不同种类NDP-糖并纯化GTs,具有底物适应性的GTs催化配糖体和不同NDP-糖基发生连接反应,从而对天然产物进行糖基侧链改造。通过易错PCR、饱和突变、DNA重组等方式建立新糖基转移酶基因的突变体库,同时对不同突变基因表达的酶进行筛选,这种体外定向获取糖基转移酶的方法不仅能提高酶的宽泛性,也能提高催化活性[25]。
李路等人报道了一种合成柔红霉素糖基类似物的新方法利用Ferrier重排反应使L-di-0-acetylrhamnal转化成β,γ-不饱和内酯,再经Mi1sunobu反应,叠氮化反应,并利用TBDMSCI保护合成了两种糖基供体,使用三氟甲磺酸三甲基硅酯催化糖基供体得到,这种方法简单易行且收率较高[26]。肟键的构建也已成为合成共轭糖肽的合理路线,将带有1-ONH2的多种类型糖基与简化的蒽醌母核以肟醚的形式连接,这样既除去了C-4位甲氧基又降低了可导致心脏毒性的二级醇代谢产物的生成,从而得到毒性更小,抗癌活性更好的蒽环类抗生素[23]。
大多数天然抗生素去糖基化会导致生物活性降低甚至失活。例如,Westman EL.等人通过NADH脱氢酶让阿霉素发生还原型去糖基化使Streptomyces WAC04685 所产阿霉素失活[27]。发生去糖基化除了可以运用酶,物理化学法也有报道。屈海云等人运用光谱电化学等技术,使DRN(道诺霉素)稀溶液经历一可逆电极过程,结果证明这是一种典型的还原脱糖反应。道诺霉素在电极上被还原之后紧接着发生一糖基脱除的化学反应。在循环伏安体系中,道诺霉素的电极还原和脱糖反应是一对竞争反应,当扫速较大时,电极反应的快速进行抑制了化学脱糖反应的发生,还原产物很快被重新氧化,但当扫速较慢时,部分还原产物在未被重新氧化之前,发生了后续的脱糖反应[28]。
4 结语
蒽环类抗生素作为化疗领域重要的抗肿瘤药物,虽有显著的抗癌效果却伴有严重的心脏毒性以及多重抗药性,这无疑限制了其临床应用,经糖基化的抗肿瘤药物由于糖基的存在,能够协助药物生物转运并特异性识别、结合DNA。而开发具有底物灵活性的糖基转移酶,能够将糖基转移至各种聚酮化合物。因此,它们可以作用于小型化合物库以开发有价值的药物[4]。通过糖基化方法重塑天然蒽环类抗生素的结构对开发低毒的临床候选药物意义重大。
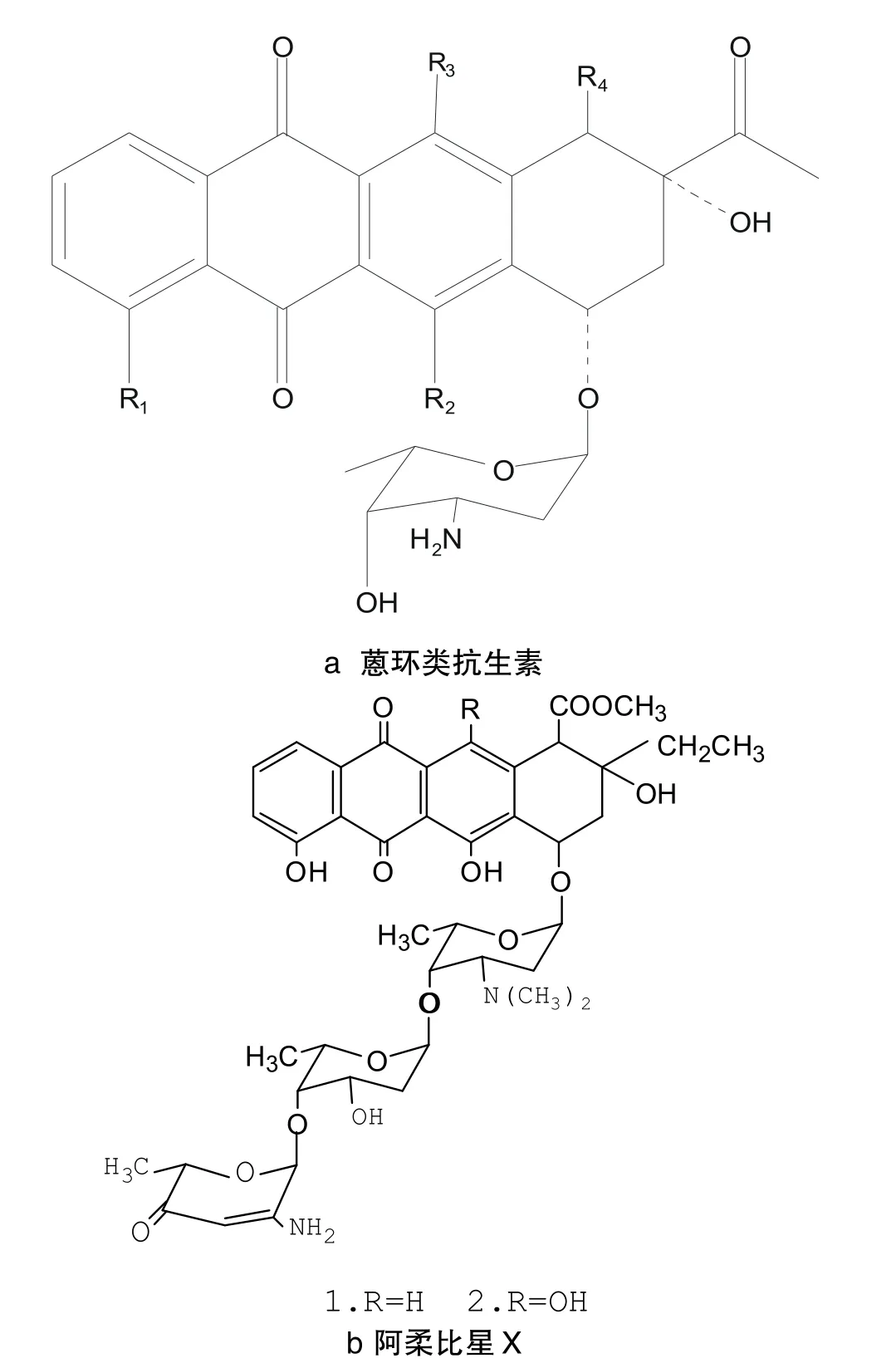
图1 蒽环类抗生素
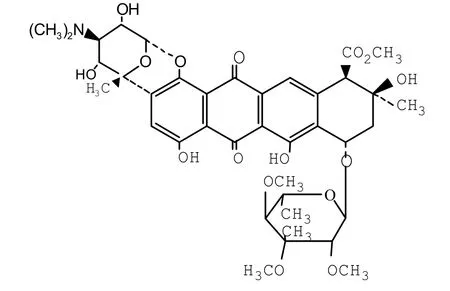
图2 诺加霉素
[1]钱璟.蒽环类抗肿瘤抗生素的研究进展[J].北方药学,2012,9(11):57-58.
[2]陆振举,尹婕,邓盛齐.蒽环类抗肿瘤抗生素脂质体制剂的研究现状与进展述评[J].国外医药:抗生素分册,2009,(3):106-112.
[3]Garrido L M,Lombo F,Baig I,et al.Insights in the glycosylation steps during biosynthesis of the antitumor anthracycline cosmomycin: characterization of two glycosyltransferase genes[J]. Appl Microbiol Biotechnol,2006,73(1):122-31.
[4]Sianidis G,Wohlert S-E,Pozidis C,et al.Cloning, purification and characterization of a functional anthracycline glycosyltransferase[J].Journal of biotechnology,2006,125(3): 425-433.
[5]Williamálown J.Discovery and development of anthracycline antitumour antibiotics[J]. Chemical Society Reviews,1993,22(3):165-176.
[6]Wiley P F,Kelly R B,Caron E L,et al.Structure of nogalamycin[J].J Am Chem Soc,1977,99(2): 542-9.
[7]刘伟,石煊雯,李梦茜,et al.产诺加霉素链霉菌摇瓶发酵条件的研究[J].药物生物技术,2013,1:011.
[8]Grynkiewicz G, Szeja W, Boryski J. Synthetic analogs of natural glycosides in drug discovery and development[J].Acta Pol Pharm,2008,65(6):655-76.
[9]方金瑞,黄维真.由加利利链霉菌产生的新蒽环抗生素阿柔比星X[J].国外医药(抗生素分册),1997, 18(3):233-233.
[10]李慧,周强,唐玉敏,et al.越野他汀生物合成介导的海洋小单孢菌中一个新天然产物的发现[J].有机化学,2013,33(006):1326-1332.
[11]Liang D M,Qiao J J.Recent advances in the study of macrolide glycosyltransferases[J].Yao Xue Xue Bao,2007,42(5):455-62.
[12]Breton C,Imberty A.Structure/function studies of glycosyltransferases[J].Curr Opin Struct Biol,1999,9(5):563-71.
[13]尚珂,胡又佳,朱春宝,et al.脱氧糖组合生物合成的研究进展[J].中国医药工业杂志,2007,38(4): 304-308.
[14]Thibodeaux C J, Melancon C E, 3rd, Liu H W. Naturalproduct sugar biosynthesis and enzymatic glycodiversification[J].Angew Chem Int Ed Engl,2008,47(51):9814-59.
[15]Siitonen V, Claesson M,Patrikainen P, et al. Identification of late-stage glycosylation steps in the biosynthetic pathway of the anthracycline nogalamycin[J]. Chembiochem, 2012, 13(1): 120-8.
[16]石煊雯,李梦茜,李航,et al.糖基转移酶编码基因 snogE 中断对诺加霉素生物合成的影响[J].中国药科大学学报 (中文版),2013,44(5):460-464.
[17]Lu W,Leimkuhler C,Oberth ür M,et al.AknK is an L-2-deoxyfucosyltransferase in the biosynthesis of the anthracycline aclacinomycin A[J].Biochemistry, 2004, 43(15):4548-4558.
[18]Lomb ó F,Gibson M,Greenwell L,et al.Engineering biosynthetic pathways for deoxysugars: branched-chain sugar pathways and derivatives from the antitumor tetracenomycin[J].Chemistry & biology,2004,11(12):1709-1718.
[19]Madduri K,Kennedy J,Rivola G,et al.Production of the antitumor drug epirubicin (4′-epidoxorubicin) and its precursor by a genetically engineered strain of Streptomyces peucetius[J].Nature biotechnology,1998,16(1):69-74.
[20]Lu W,Leimkuhler C,Gatto Jr G J,et al.AknT is an activating protein for the glycosyltransferase AknS in L-aminodeoxysugar transfer to the aglycone of aclacinomycin A[J]. Chemistry &biology,2005,12(5): 527-534.
[21]Blanco G, Patallo E P,Braa A F,et al. Identification of a sugar flexible glycosyltransferase from,the producer of the antitumor polyketide elloramycin[J].Chemistry & biology,2001,8(3):253-263.
[22]邓会群,王惠利,杨红.天然产物的C-糖基化研究进展[J].生物技术通报,2009,5:27-30.
[23]薛冰林.含肟醚结构的蒽醌糖基缀合物的合成[D].河南师范大学,2011.
[24]朱西粉,潘国辉,李莉媛,et al.放线菌天然产物糖基化改造研究进展[J].微生物学通报,2013, 40(10):1765-1782.
[25]吴佳茜,王 旻 ,陈代杰,et al.糖基转移酶定向进化研究进展[J].生命科学,2009.
[26]李路,朱静,赵文献.一种合成柔红霉素糖基类似物的新方法[J].化学研究,2011,22(5):70-73.
[27]Westman E L,Canova M J, Radhi I J,et al.Bacterial inactivation of the anticancer drug doxorubicin[J].Chemistry & biology,2012,19(10):1255-1264.
[28]屈海云,程圭芳,彭惠琦,et al.抗癌药物柔红霉素的光谱电化学研究[J].高等学校化学学报,2001,22(12):2-2.