邻苯二甲醛法(OPA)与高效液相色谱法(HPLC)测定降胆固醇的双歧杆菌的对比
2014-12-16张汝娇何腊平李翠芹张玲王猛朱秋劲
张汝娇,何腊平,3,李翠芹,张玲,王猛,朱秋劲
1(贵州大学酿酒与食品工程学院,贵州贵阳,550025)2(贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳,550025)
3(贵州省猪肉制品工程技术研究中心,贵州贵阳,550025)4(贵州大学化学与化工学院,贵州 贵阳,550025)
WHO曾预测,心脑血管疾病到2030年仍是引起死亡的主要原因[1]。而血清中胆固醇过高是引发冠心病、动脉硬化、脑中风等心脑血管疾病的重要因素[2]。因此,降低血清中胆固醇的含量则成为目前心血管疾病科学研究工作的热点之一。目前,运用生物转化法,特别是运用益生菌对胆固醇进行直接降解已成为研究的趋势。
双歧杆菌是一种具有降低胆固醇作用的肠道益生菌[3],但不同菌株间降胆固醇作用差异较大,所以一般需先建立体外筛选降胆固醇的模型,然后进行双歧杆菌菌株降胆固醇能力的初步筛选。Bordoni[4]曾发现1株两歧双歧杆菌(Bifidobacterium bifidum)能在体外吸附胆固醇达到81 mg/g。陈路清[5]等研究也发现青春双歧杆菌(Bifidobacterium adolescentis)体外能降低胆固醇在50%左右。
由于胆固醇是不溶于水的物质,体外筛选能降胆固醇的双歧杆菌通常是制备含有胆固醇胶束的培养基,加入菌体培养后测其胆固醇的值进行判断。目前常用于测定胆固醇的方法有化学法,包括硫酸铁铵法[6]、邻苯二甲醛(OPA)法[7];色谱法,包括高效液相色谱(HPLC)[8]、气相色谱(GC)[9];色质联用法,包括气质联用(GC-MS)和液质联用(LC-MS/MS)[10-11];以及运用分子印迹聚合物为填料的固相萃取技术的物理法[12]等等。化学法简单易操作,色谱及质谱法则对实验仪器配置要求高,酶法对测定胆固醇特异性强,主要用于血清中胆固醇的检测,而分子印迹技术尚在探索中条件不成熟。但考虑前期大量体外筛选菌株的情况,本实验选择了常用的化学法OPA法与色谱法HPLC法对实验所保藏的5株双歧杆菌菌株进行降胆固醇实验,通过比较这2种方法来选择最宜的体外筛选的检测方法。
1 材料与方法
1.1 材料
1.1.1 菌株来源
香猪源性双歧杆菌,由实验室提供。
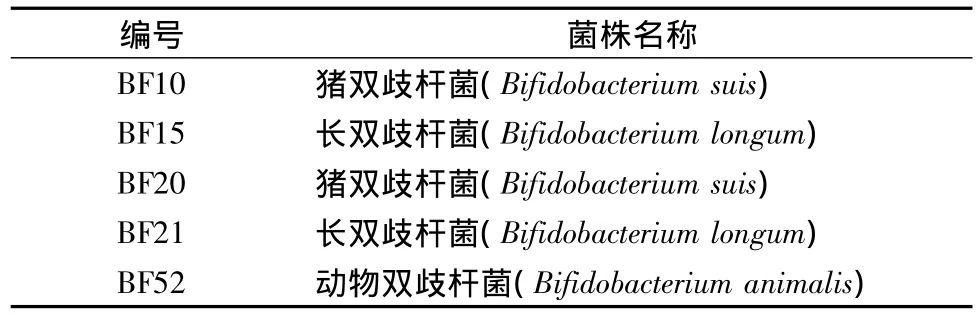
表1 菌株名称Table 1 The name of stains
1.1.2 主要设备及仪器
YQX-II厌氧培养箱,上海新苗医疗器械制造有限公司;SW-CJ-10超净工作台,苏州净化有限公司;CX21SF1奥林巴斯生物显微镜,奥林巴斯中国有限公司;TU—1810PC紫外可见分光光度计,北京普析通用仪器有限公司;1260安捷伦高效液相色谱,安捷伦科技有限公司;08-2G磁力搅拌加热冷凝回流装置,上海梅颖浦仪器仪表制造有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂。
1.1.3 培养基及主要试剂
培养基:PTYG 培养基[13],降胆固醇培养基CHOL-PTYG:参考陈路清[5]的方法进行改良:在普通PTYG液体培养基中,加入胆固醇胶束溶解液使胆固醇浓度为0.1 mg/mL。1 000 mL液体培养基中含0.l mg/mL胆固醇胶束溶液的制备:准确称量胆固醇(分析纯)0.1 g放入小烧杯中加入0.2 g牛胆盐、1 mL TWEEN-80、0.1 g蔗糖八乙酸酯,搅拌均匀,再移取5 mL的冰乙酸加热溶解,把溶解液用超声波处理15 min后,过0.45 μm滤膜后快速加入到配制好的液体培养基中,边加入边搅拌,使其形成均匀稳定的胶体溶液。以上均121℃灭菌20 min后备用。
主要试剂:胆固醇(≥99%),色谱纯,Sigma公司(C8667-1G);胆固醇(≥99%),分析纯,上海蓝季科技发展有限公司;邻苯二甲醛 ,化学纯,国药集团化学试剂有限公司;蔗糖八乙酸酯 ,化学纯,国药集团化学试剂有限公司。
胆固醇储备液(1 mg/mL):精确称取0.05 g(精确至0.01 mg)胆固醇(色谱纯),用10 mL无水乙醇完全溶解后定溶至50 mL,即得1 mg/mL的胆固醇母液,于4℃冰箱放置过夜。
OPA试剂(0.5 mg/mL):精确称取0.05 g邻苯二甲醛,用20 mL冰乙酸完全溶解后定溶至100 mL,即得0.5 mg/mL的邻苯二甲醛溶液,避光保存。
1.2 实验方法
1.2.1 邻苯二甲醛法(OPA)[14]
1.2.1.1 OPA法标准曲线绘制
准确吸取胆固醇储备液各 0.2、0.5、1.0、1.2、1.5、2.0 mL,用无水乙醇定容至10 mL。配置分别相当于 0.02、0.05、0.10、0.12、0.15、0.20 mg/mL 质量浓度的标准溶液。在各管中加入OPA试剂总体积达到4 mL,室温放置10 min。再向其中缓慢加入4 mL浓硫酸,立即用振荡器振20 s,充分混匀后于室温条件下放置10 min。空白对照以1 mL无水乙醇代替胆固醇储备液,最后测其在550 nm处的吸光度值,以胆固醇浓度为横坐标,吸光度值为纵坐标做标准曲线,并计算线性回归方程。
1.2.1.2 总胆固醇提取
取待测液1 mL放于清洁试管中,每管加入6 mL的95%乙醇 ,混匀后每管加入4 mL的500 g/mL KOH溶液。然后加盖置于60℃水浴锅中水浴30 min进行皂化,每隔10 min振摇1次使皂化完全,皂化完毕取出试管冷却后加入10 mL正己烷,用振荡器振1 min,使之充分混合,再加入6 mL蒸馏水,混匀。在室温放置20 min,静置分层,小心吸取8 mL正己烷层(上层)转移到清洁试管中小心放置于60℃水浴锅中,氮气吹干。
1.2.1.3 总胆固醇测定
于蒸干后的试管中加入4 mL当天配置的OPA试剂,室温放置10 min。再向其中缓慢加入4 mL浓硫酸,立即用振荡器振20 s,充分混匀后于室温条件下放置10 min。最后测其在550nm处的吸光度(A550),以空白实验校零,查标准曲线,结果用mg/mL表示。
1.2.2 高效液相色谱法[15]
1.2.2.1 样品测定前处理
(1)皂化。加入20 mL的降胆固醇培养基上清液,于250 mL平底烧瓶中,用10 mL无水乙醇分3次冲洗三角锥形瓶,洗液并入平底烧瓶。再加入20 mL无水乙醇,10 mL 60%KOH溶液,混匀。将试样在100℃磁力搅拌加热皂化回流1 h,皂化结束,用10 mL无水乙醇自冷凝管顶端冲洗其内部和温度感应器,取下平底烧瓶,冷却至室温。
(2)提取.向冷却皂化液中加入5 mL蒸馏水,用漏斗全部转移与250 mL分液漏斗中,用30 mL蒸馏水,分3次冲洗平底烧瓶和漏斗,洗液并入分液漏斗,再用40 mL正己烷分3次冲洗平底烧瓶和漏斗,洗液并入分液漏斗,振摇2 min,静置分层。转移水相于第二个分液漏斗,再用30 mL正己烷重复提取两次,弃去水相,合并3次有机相。分别用10mL正己烷用蒸馏水每次100 mL洗涤提取液至中性(5次),提取液通过约10 g无水Na2SO4脱水,全部转移至250 mL平底烧瓶中,用20 mL正己烷分2次冲洗分液漏斗,一并倒入平底烧瓶。
(3)浓缩。将上述平底烧瓶中的提取液在旋转蒸发仪上,40~45℃蒸发至近干,用无水乙醇溶解定容至10 mL,超声溶解,然后过0.45μm过滤膜,过滤液待HPLC检测。
1.2.2.2 高效液相色谱法测定色谱条件
色谱柱:SinoChrom ODS-BP 4.6 mm×150 mm 5 μm;柱温:35℃;流动相:甲醇;流速:1 mL/min;波长205 nm;进样量 10 μL。
1.2.2.3 HPLC标准曲线绘制
准确吸取胆固醇储备液各 1.0、2.0、3.0、4.0、5.0、6.0、7.0 mL,用无水乙醇定容至 10 mL。配置分别相当于0.1、0.2、0.3、0.4、0.5、0.6、0.7 mg/mL 质量浓度标准溶液。然后进行HPLC测定。以浓度为横坐标,峰面积(响应值)为纵坐标绘制标准曲线,并计算线性回归方程。
1.2.3 精密度试验
取同一空白CHOL-PTYG培养基溶液按方法1.2.1和1.2.2中的测定条件重复平行测定5次,计算相对标准偏差,并分析其重现性。
1.2.4 加标回收率试验
取同一空白CHOL-PTYG培养基溶液按方法1.2.1和1.2.2中的测定条件重复平行测定3次,分别计算其胆固醇的浓度。另取CHOL-PTYG培养基溶液加入一定量的胆固醇标准溶液,按照方法方法1.2.1和1.2.2分别计算两种方法的加标回收率。
1.2.5 双歧杆菌降胆固醇率的测定
将表1中的5株菌株进行活化,在PTYG培养基上纯化培养3次后,接种到液体PYTG培养基中富集培养。将待测菌液值调至OD 0.4按10%(V/V)接种量接种于胆固醇含量为0.1 mg/mL的CHOLPTYG 中厌氧培养(N2∶CO2∶H2=90∶5∶5)37 ℃中培养48 h。菌液以10 000 r/min,4℃条件下离心20 min,保留上层清液作为待测液用于测定胆固醇含量,以未接种的PTYG-CHOL作为对照。降胆固醇率S计算:
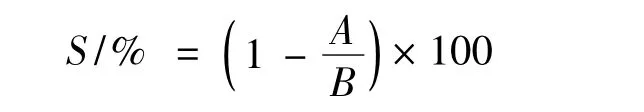
式中:S,降胆固醇率;B,未接种的PTYG-CHOL培养基中胆固醇浓度,mg/mL;A,待测发酵上清液中胆固醇质量浓度,mg/mL。
1.2.6 数据分析
所有数据运用OriginPro 8.0与SPSS Statistics 17进行统计分析。
2 结果与分析
2.1 OPA法胆固醇标准曲线的绘制
按方法1.2.2.1绘制的OPA法胆固醇标准曲线见图1。胆固醇在0~0.20 mg/mL的质量浓度范围内呈现良好的线性关系,其回归方程为y=4.9264x-0.0130,相关系数R2为0.999 2。
2.2 HPLC法胆固醇标准曲线的建立
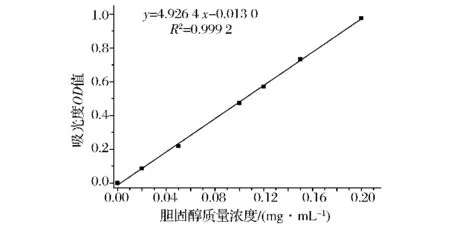
图1 胆固醇标品的OPA标准曲线图Fig.1 Standard curve of cholesterol measured by OPA
从图2可以看出,在1.2.3.2色谱条件下,胆固醇能够很好地达到分离效果,其保留时间t(胆固醇)=6.852 min。经多次重复实验和实际样品分析显示,保留时间在±0.1 s范围内均代表同一物质。
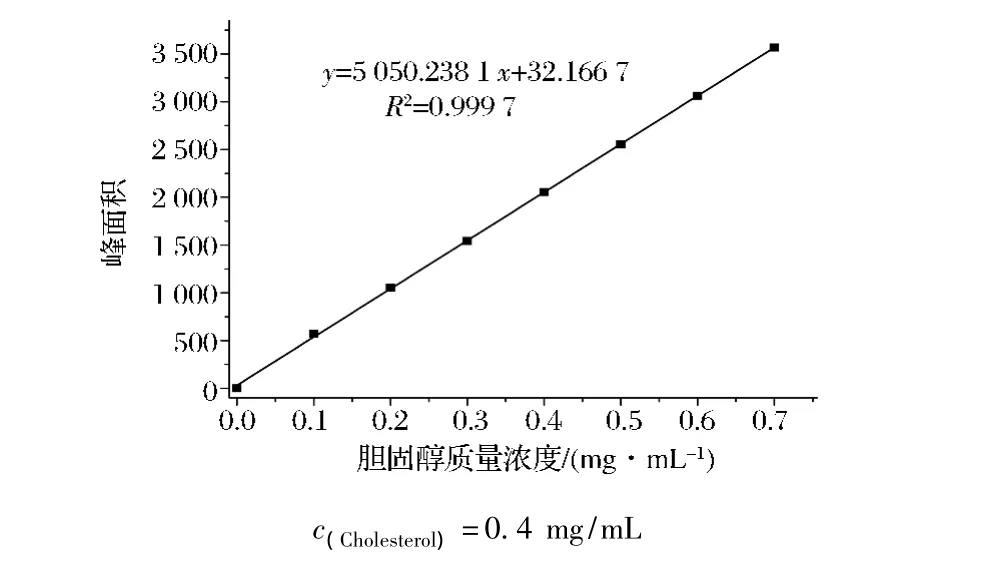
图2 胆固醇标品的HPLC分离图Fig.2 Chromatogram of standard solution of cholesterol
按方法1.2.3.3绘制的HPLC法胆固醇标曲曲线见图3,由图3可以表明胆固醇浓度在0~0.70 mg/mL的质量浓度范围内呈现良好的线性关系,胆固醇标准曲线为y=5 050.238 1x+32.166 7相关系数R2=0.999 7。

图3 胆固醇标品的HPLC标准曲线图Fig.3 Standard curve of cholesterol measured by HPLC
2.3 精密度试验
同一空白CHOL-PTYG培养基,相同条件下用OPA法重复测定吸光度5次,计算所得吸光度平均值0.493,相对平均偏差RSD%=0.32%(n=5),表明OPA法重现性良好,仪器精密度良好。相同条件下用HPLC法重复进样5次,计算所得峰面积平均值1 074,相对平均偏差 RSD%=0.96%(n=5),表明HPLC法重现性良好,高效液相色谱精密度良好。
2.4 加标回收率试验
经计算得到CHOL-PTYG培养基的胆固醇含量为0.103 mg/mL,加入质量浓度为0.1 mg/mL的胆固醇标准溶液。经OPA方法测定其平均加标回收率为100.18%,相对平均偏差RSD=0.30%(n=3),说明OPA方法准确可信。经HPLC方法测定其平均加标回收率为99.33%,相对平均偏差RSD=0.30%(n=3)。
2.5 实验菌株OPA与HPLC方法比较结果
将表2得到的数据进行t检验,得到t=0.437,查对t值表得出,OPA法与HPLC方法两种方法的测定结果差异不显著(P=0.669>0.05)。5株菌株的降胆固醇率在12.34%~28.57%不等。

表2 5株双歧杆菌菌株的降胆固醇率结果Table 2 The result of degradation rate of cholestrol of five strains in vitro
3 讨论与结论
实验结果表明,邻苯二甲醛法与高效液相色谱法检测胆固醇含量这两种方法,其精密度相当,重复性好,所测得的加标回收率表明两种方法准确可信。而且5株菌株经过降胆固醇实验说明OPA法与HPLC方法两种方法的测定结果差异不显著(P=0.669>0.05),也即化学法OPA法与色谱法HPLC法均可用于降胆固醇双歧杆菌的初筛检测。郭翔[16]同样通过OPA法与HPLC法测定卵磷脂-胆固醇胶束溶液中的胆固醇含量发现两种方法其差异不显著。
国标GB/T5009.128《食品中胆固醇的测定》[6]中的同样采用化学方法,但其试用范围仅为各类动物性食品中的胆固醇的测定,在测定时预先采用索氏脂肪提取法提取油脂后,再以硫酸铁铵作为显色剂,测定油脂中的胆固醇含量。而OPA是一种经典的方法,所需的实验仪器及试剂条件更易获取,不需要流动相,测试环节中的成本相对较低,也无需在测定胆固醇实验之前,先提取脂肪,缩短了试验进程。本实验的高效液相方法是在国标GB/T22220-2008《食品中胆固醇的测定》[15]基础上修改了提取步骤的试剂,用正己烷代替了石油醚和乙醚,发现提取效果良好,避免了由于乙醚挥发性大而造成的溶剂损失。笔者在实验过程中发现,OPA法相对于HPLC法而言,具有检测迅速,可在2 h内完成的特点,且在待测液胆固醇的提取步骤中更为简便。而HPLC法在皂化提取步骤中较繁琐,更容易因为人为操作不当,造成人为误差。有报道可以通过不进行皂化处理而直接用石油醚、氯仿、甲醇萃取[17-18]或者是通氮气加快皂化处理[19]等方法测定胆固醇,效果良好,所以后期也将继续对本试验中方法进行改良,在筛选的后期阶段采用高效液相方法来验证OPA法的结果。所以,目前对于降胆固醇双歧杆菌的前期大量的筛选环节,建议使用OPA法进行对双歧杆菌降胆固醇能力的测定。
另外本次试验的5株双歧杆菌菌株的降胆固醇率在12.34% ~28.57%之间,降胆固醇能力不高。而香卫钦[20]等从成年人的粪便中分离出1株双歧杆菌,胆固醇去除率能达到34.6%,尹军霞[25]等从东北虎的肠道筛选到1株两歧双歧杆菌(Bifidobacterium bifidum)体外降胆固醇能力达到57.14%,后期还需继续对高降胆固醇的双歧杆菌进行筛选或者对现有双歧杆菌进行诱变,以便得到1株高降胆固醇率的双歧杆菌。
[1] WHO,“Cardiovascular Disease,” Fact sheet no.317,WHO,Geneva,Switzerland,2009,http://www.who.int/mediacentre/factsheets/fs317/en/print.html.
[2] Alogˇlu H,Öner Z.Assimilation of cholesterol in broth,cream,and butter by probiotic bacteria[J].European Journal of Lipid Science and Technology,2006,108(9):709-713.
[3] Ebel B,Lemetais G,Beney L,et al.Impact of Probiotics on Risk Factors for Cardiovascular Diseases.A Review[J].Critical Reviews in Food Science and Nutrition,2014,54(2):175-189.
[4] Bordoni A,Amaretti A,Leonardi A,et al.Cholesterollowering probiotics:in vitro selection and in vivo testing of bifidobacteria[Z].Applied Microbial and Cell Physiology,2013.
[5] 陈路清,李青青,马鎏镠,体外筛选降胆固醇双歧杆菌实验[J].食品工业科技,2010(07):333-335.
[6] 食品中胆固醇的测定[S].GB/T 5009.128-2003,中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会发布,2003.
[7] 白利,王瑞雪,王际辉,等.邻苯二甲醛(OPA)法快速测定蛋黄粉中的胆固醇含量[J].中国酿造,2010(5):162-164.
[8] Daneshfar A,Khezeli T,Lotfi H J.Determination of cholesterol in food samples using dispersive liquid-liquid microextraction followed by HPLC-UV[J].Journal of Chromatography B-analytical Technlogies in the Biomedical and Life Sciences,2009,877(4):456-460.
[9] 李伟,陈华勇,张凯,等.气相色谱内标法测定鱿鱼油中的胆固醇[J]. 食品工业科技,2011,01:284-286.
[10] Honda A,Miyazaki T,Ikegami T,et al.Highly sensitive and specific analysis of sterol profiles in biological samples by HPLC-ESI-MS/MS[J].J Steroid Biochem Mol Biol,2010,121(3/5):556-564.
[11] Amaral C,Gallardo E,Rodrigues R,et al.Quantitative analysis of five sterols in amniotic fluid by GC-MS:application to the diagnosis of cholesterol biosynthesis defects[J].J Chromatogr B,2010,878(23):2 130-2 136.
[12] Baggiani C,Anfossi L,Giovannoli C.Solid phase extraction of food contaminants using molecular imprinted polymers[J].Anal Chim Acta,2007,591(1):29-39.
[13] 张刚.乳酸细菌基础技术和应用[M].北京:化学工业出版社,2007.
[14] Naka H.Determination of serum cholesterol using ophthalaldehyde reagent[J].Rinsho byori.The Japanese Journal of Clinical Pathology,1972,20(4).
[15] 食品中胆固醇的测定-高效液相色谱法[S].GB/T 22220-2008,中华人民共和国国家质量监督检验检疫总局和中国国家标准化管理委员会发布,2008.
[16] 郭翔.降胆固醇益生乳酸菌筛选及其功能机理的研究[D].无锡:江南大学,2009.
[17] 杨琴,戴瑞彤.HPLC法测定不同品种鸡蛋中的胆固醇含量[J].农产品加工(学刊),2006(08):71-74.
[18] 王成涛,曹雁平,孙宝国,等.RP-HPLC同时检测发酵液中7-脱氢胆固醇与胆固醇的研究[J].中国酿造,2009(08):155-157.
[19] 丁卓平,王明华,刘振华,等.食品中胆固醇含量测定方法的研究与比较[J].食品科学,2004,25(1):130-135.
[20] 香卫钦,黄平.一株能降解胆固醇的乳酸菌的选育[J].生物技术,2001,11(5):9-10.
[21] 尹军霞,沈国娟,邹波,等.东北虎肠道降胆固醇双歧杆菌的分离鉴定[J].食品科学,2009,30(5):205-208.
