赖氨酸/葡萄糖美拉德反应产物对丙烯酰胺生成的抑制作用*
2014-12-16郝瑞芳景浩
郝瑞芳,景浩
1(山西林业职业技术学院 园艺系,山西太原,030009)2(中国农业大学食品科学与营养工程学院,北京,100083)
丙烯酰胺(acrylamide,AA)是一种公认的具有神经毒性和潜在致癌性的物质,已被国际癌症研究总署列为“人类可能的致癌物”(2A类)[1]。淀粉含量高的油炸或焙烤类食品(如炸薯条、薯片、面包、饼干等)中含有较多的丙烯酰胺,其形成主要是食品中的天冬酰胺(asparagine,Asn)和还原糖(如葡萄糖、果糖)在高于120℃的条件下加热,通过美拉德反应而生成,且随着加热温度的升高,丙烯酰胺的生成明显增加[2-3]。
研究表明添加抗氧化剂如原花青素、儿茶素和生物黄酮均能够显著抑制模拟体系和谷物、马铃薯等食品体系中丙烯酰胺的生成[4-6]。已有研究证明,美拉德反应产物(Maillard reaction products,MRPs)具有较强的抗氧化性,它是食品中的氨基化合物(氨基酸、肽及蛋白质)的ε-氨基与羰基化合物(糖类、醛、酮等)的羰基之间发生反应生成的产物[7]。景浩等[8-9]研究表明,葡萄糖和核糖分别与赖氨酸和甘氨酸的美拉德反应产物能够阻止亚油酸乳化体系中脂质过氧化,能够清除DPPH自由基、羟自由基、超氧自由基、过氧化物。将赖氨酸/葡萄糖美拉德反应产物分成高分子质量和低分子质量的产物(high and low molecular weight-lysine/glucose Maillard reaction products,H-MRPs and L-MRPs)2部分,并比较其抗氧化性。结果显示:H-MRPs表现出更强的抗氧化性,对羟自由基和DPPH自由基的清除能力强于LMRPs[8]。
因此本试验以高、低分子质量的赖氨酸(Lysine,Lys)/葡萄糖(glucose,Glc)美拉德反应产物(H-LGP和L-LGP)为添加物,探讨其对天冬酰胺/葡萄糖模式体系中丙烯酰胺的生成是否有抑制作用,同时测定模式体系的吸光值和对自由基的清除作用,考察添加物对天冬酰胺/葡萄糖模式体系的褐变程度和抗氧化性的影响。
1 实验部分
1.1 仪器与试剂
SPD-20A型高效液相色谱仪(日本Shimadzu公司),配紫外检测器;Thermo Hypersil ODS C18色谱柱(250 mm ×4.6 mm,5 mm,美国Thermo公司);680型酶标仪(美国Bio-Rad公司)。
丙烯酰胺标准品,纯度99.5% ,购自德国 Labor Dr.Ehrenstorfer-Schafers公司,赖氨酸和天冬酰胺,购自北京拜尔迪生物公司;其他药品均为国产分析纯。丙烯酰胺储备液浓度1.0 mg/mL;磷酸盐缓冲液配制:称取 KH2PO40.20 g,Na2HPO4·12H2O 2.90 g,KCl 0.20 g,NaCl 8.00 g,加900 mL 去离子水溶解,用18%的HCl调pH值至7.4,最后定容至1 L。
1.2 实验方法
1.2.1 反应体系的确立
(1)赖氨酸/葡萄糖美拉德反应产物(LGP)的制备:准确称取Lys 1.46 g,Glc 1.98 g,置于100 mL的容量瓶中,用磷酸盐缓冲液(pH 7.4)溶解,调溶液pH为8.0,最后定容至100 mL,使Lys与Glc的终浓度均为0.1 mol/L。将配好的待反应溶液加入耐高压玻璃管中,密闭管口并置于油浴锅中,于150℃加热30 min,制备LGP。反应体系的温度用红外测温仪测量。反应结束后迅速将玻璃管放入冰水混合浴中终止反应。在LGP中加入9倍体积的无水乙醇,搅拌,于5 000×g离心10 min,收集上清液和沉淀两部分,上清液为低分子质量的LGP(L-LGP),沉淀为高分子量的LGP(H-LGP)。上清液用旋转蒸发仪于40℃浓缩,最后将浓缩的上清和沉淀分别冷冻干燥,备用。
(2)天冬酰胺/葡萄糖(Asn/Glc)、Asn/Glc/HLGP和Asn/Glc/L-LGP反应体系的确立:准确称取Asn 0.15 g,Glc 0.20 g,置于10 mL 的容量瓶中,用磷酸盐缓冲液(pH 7.4)溶解,调溶液pH为8.0,最后定容至10 mL,使Asn与Glc的终浓度均为0.1 mol/L。再准确称取 Asn 0.15 g,Glc 0.20 g,各6份,分别置于6个10 mL的容量瓶中,每份加入不同浓度的HLGP或L-LGP,用磷酸盐缓冲液(pH 7.4)溶解,调溶液pH为8.0,最后定容至10 mL,使Asn与Glc的终浓度均为0.1 mol/L,H-LGP和L-LGP的终浓度分别为1、5 或10 mg/mL。
然后将配好的待反应溶液分别加入耐高压玻璃管中,将耐压玻璃管密闭并置于油浴锅中,分别于150℃下加热30 min。反应结束后迅速将玻璃管放入冰水混合浴中终止反应。
1.2.2 HPLC-UV分析条件
采用高效液相色谱-紫外检测法(HPLC-UV)测定反应体系中的丙烯酰胺含量,色谱操作条件为:色谱柱Thermo Hypersil ODS C18(250 mm×4.6 mm,5 mm),保护柱C18(13 mm×4.0 mm,5 mm),流动相V(甲醇)∶V(水)=3∶97,等浓度洗脱,流速 0.7 mL/min,柱温为室温(25℃),进样量20 mL,紫外检测器,波长204 nm。
1.2.3 反应体系褐变程度的测定
反应体系的褐变程度用反应产物在450 nm处的吸光值(OD450)表示。取加热过的各反应产物,稀释5倍,加入到96孔培养板,每孔100 μL,每个反应产物设3个复孔,用680型酶标仪测定各反应产物OD450。
1.2.4 反应体系抗氧化性的测定
1.2.4.1 ABTS法
取各反应产物100 μL,用去离子水稀释10倍,测定其对自由基ABTS的清除率。具体方法如下:取稀释过的反应产物10 μL,加入90 μL的ABTS溶液,混匀,闭光放置1 min~6 min后,于630 nm处测定吸光值。用PBS代替反应产物作为对照组[10]。

1.2.4.2 DPPH法
取各反应产物200 μL,用去离子水稀释5倍,测定其对自由基DPPH的清除率。具体方法如下:用无水乙醇配制1.52×10-4mol/L的DPPH溶液。测定时取稀释过的反应产物15 μL,加入60 μL浓度为0.5 mol/L的Tris-HCl溶液,再加入150 μL配制好的DPPH溶液,室温闭光放置30 min,然后于520 nm处测定吸光值。用PBS代替反应产物作为对照[8]。
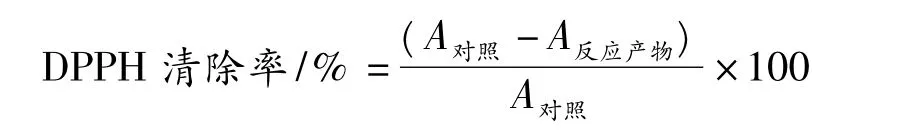
1.2.5 统计分析
每个试验重复3次,每个测定3次,结果表示为Means±SD。采用MINITAB 13.20软件进行One-way ANOVA分析。邓肯氏多重检验用来确定数据间的差异,显著水平为P<0.05。
2 结果与分析
2.1 LGP对Asn/Glc反应体系中丙烯酰胺生成的影响
图1显示了LGP对Asn/Glc反应体系中丙烯酰胺生成的影响。
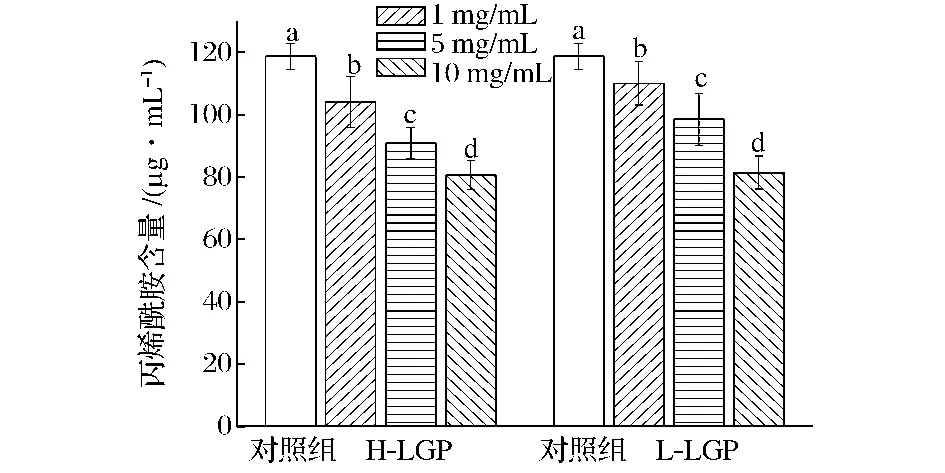
图1 H-LGP和L-LGP对Asn/Glc反应体系中丙烯酰胺生成的影响Fig.1 Effects of H-LGP and L-LGP on acrylamide formation in the Asn/Glc model system
高、低分子质量的赖氨酸/葡萄糖美拉德反应产物(H-LGP和L-LGP)都对体系中丙烯酰胺的生成有显著的抑制作用,添加物的浓度越高,抑制率也越强。当添加1、5、10 mg/mL的H-LGP时,对Asn/Glc体系中丙烯酰胺生成的抑制率分别为12.3%、23.4%、32.0%;添加 1、5、10 mg/mL 的 L-LGP 时,对丙烯酰胺的抑制率分别为7.3%、16.9%、31.4%。可以看出,H-LGP对丙烯酰胺的抑制作用略强于L-LGP,当添加量都为10 mg/mL时,二者无差异。
美拉德反应十分复杂,反应过程分为初期、中期和末期3个阶段,在加热食品中已检测到的、结构明确的与美拉德反应有关的产物约有800多种,很多产物具有一定的生物活性,产物中某些产物可能对丙烯酰胺的生成有抑制作用[4]。本实验的研究结果也表明H-LGP和L-LGP对Asn/Glc反应体系中丙烯酰胺的生成有显著的抑制作用。
H-LGP和L-LGP具有很好的抗氧化性,能够阻止亚油酸乳化体系中脂质过氧化,能够清除DPPH自由基和氧自由基[8]。已有研究表明,在Asn/Glc模式体系和食品体系中添加抗氧化剂柚皮素、原花青素和生物黄酮均能有效抑制丙烯酰胺的形成[6,11-13],生物黄酮对丙烯酰胺的抑制作用与体系的抗氧化性变化之间存在显著的相关性。因此,推测LGP对Asn/Glc反应体系中丙烯酰胺生成的抑制作用可能与LGP的抗氧化性有一定的相关性,抑制机理有待于更深入的研究。
2.2 LGP对Asn/Glc反应体系褐变程度的影响
如图2所示,对照组Asn/Glc体系于150℃下加热30 min后,体系的褐变程度显著增加,OD450达到0.75。

图2 H-LGP和L-LGP对Asn/Glc反应体系吸光值的影响Fig.2 Effects of H-LGP and L-LGP on Absorbance of Asn/Glc model system
分别添加低、中浓度的H-LGP和L-LGP后,Asn/Glc/LGP体系的OD450在0.7~0.8之间,和对照组相比无显著差异,说明低、中浓度的LGP对Asn/Glc反应体系的褐变无影响。当添加高浓度的LGP,整个反应体系的OD450显著增加,且在加热的过程中它们的颜色会随反应时间的延长而逐渐加深[14]。整个体系的褐变程度增加,原因可能有以下3方面:(1)H-LGP和L-LGP溶液本身呈褐色,浓度越高,溶液的颜色也越深,添加高浓度的LGP后,加热前整个体系的颜色就偏浅黄色;经150℃下加热30 min后,由于LGP中还含有未反应完全的Lys和Glc,二者可继续发生美拉德反应,产生褐色的产物;(2)体系中的Asn和Glc同时也在高温加热过程中发生美拉德反应,不仅生成了丙烯酰胺,还生成了其他褐色的产物;(3)LGP参与了体系的反应,使整个体系的颜色加深,褐变程度显著高于对照组。
2.3 LGP对Asn/Glc反应体系抗氧化性的影响
各反应体系的抗氧化性用反应产物对自由基DPPH和ABTS的清除率来表示。
H-LGP和L-LGP对Asn/Glc体系的DPPH自由基清除率的影响如图3所示。分别将H-LGP和LLGP加到 Asn/Glc体系中加热30 min后,只有10 mg/mL的H-LGP和L-LGP增强了整个反应体系对DPPH自由基的清除率,和对照组相比,清除率分别提高了17.7%和9.2%;中、低浓度的2种LGP和对照相比无显著差异。
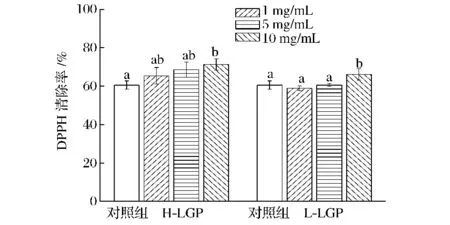
图3 H-LGP和L-LGP对Asn/Glc体系DPPH自由基清除率的影响Fig.3 Effects of H-LGP and L-LGP on DPPH scavenging rate in the Asn/Glc model system
H-LGP和L-LGP对Asn/Glc体系的ABTS自由基清除率的影响如图4所示。3个浓度的LGP均显著提高了反应体系对ABTS自由基的清除率。同一组中,1 mg/mL和5 mg/mL的浓度组之间无差异,而10 mg/mL的浓度组对ABTS的清除率不仅显著高于对照组,还显著高于1 mg/mL和5 mg/mL的浓度组。和对照组相比,添加H-LGP和L-LGP后整个体系对ABTS的最大清除率分别提高了29.0%和22.3%,HLGP的ABTS自由基清除率略高于L-LGP。
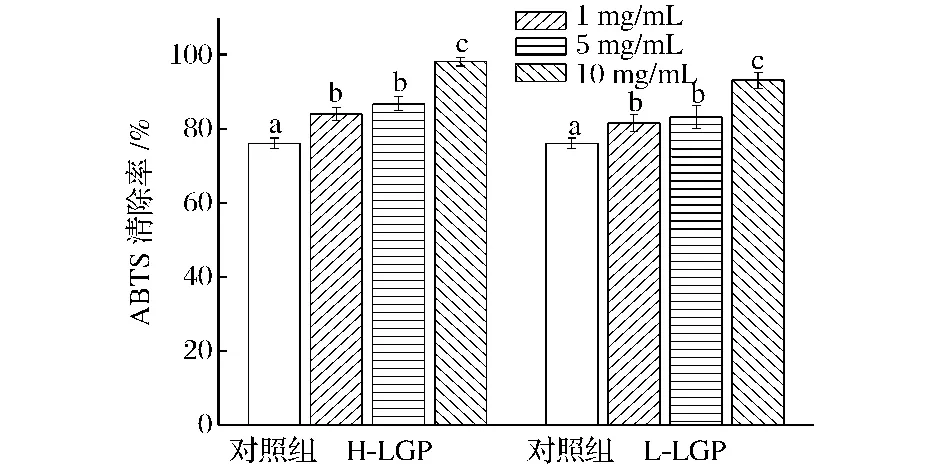
图4 H-LGP和L-LGP对Asn/Glc体系ABTS自由基清除率的影响Fig.4 Effects of H-LGP and L-LGP on ABTS scavenging rate in the Asn/Glc model system
研究表明,美拉德反应产物(MRPs)中的类黑素、还原酮以及一些含N、S的杂环化合物具有一定的抗氧化活性,其中类黑素被认为是主要的抗氧化成分,具有较强的抗ABTS自由基能力,大分子质量的类黑素能够抑制还原型辅酶Ⅱ和谷胱甘肽-S-转移酶的活性,而小分子量的类黑素则可抑制还原型辅酶Ⅱ的活性。除此之外,在谷物油中添加类黑素也能明显降低其过氧化值[15]。本试验也表明赖氨酸/葡萄糖美拉德反应产物具有一定的抗氧化活性,添加到反应体系中能够增强体系的抗氧化活性。
3 结论
LGP(1、5、10 mg/mL)对 Asn/Glc 模式反应体系中丙烯酰胺的生成有显著的抑制作用,且浓度越大,对丙烯酰胺生成的抑制作用越强。低、中浓度的LGP对Asn/Glc体系的褐变程度无影响,但高浓度的LGP则促进了Asn/Glc体系的褐变程度。低、中、高浓度的LGP均显著促进了Asn/Glc体系对ABTS自由基的清除作用,而对DPPH自由基的清除作用中,只有高浓度的L-LGP有显著的促进作用。H-LGP和LLGP相比较,二者对Asn/Glc反应体系中丙烯酰胺的生成、对体系的褐变及抗氧化性的影响均无显著差异。
[1] International Agency for Research on Cancer(IARC).Some industrial chemicals.Monographs on the Evaluation of Carcinogenic Ricks to Humans,1994,60:398-433.
[2] Stadler R H,Blank I,Varga N,et al.Food Chemistry:Acrylamide from Maillard reaction products[J].Nature,2002,419:449-450.
[3] Mottram D S,Wedzicha B L,Dodson A T.Food Chemistry:Acrylamide is formed in the Maillard reaction[J].Nature,2002,419:448-449.
[4] Fernández S,Kurppa L,Hyv?nen L.Content of acrylamide decreased in potato chips with addition of a proprietary flavonoid spice mix(Flavomare)in frying[J].Innovative Food Technology,2003,(Feb):2-3.
[5] Ciesarova Z,Suhaj M,Horvathova J.Correlation between acrylamide contents and antioxidant capacities of spice extracts in a model potato matrix [J].Journal of Food and Nutrition Research,2008,47:1-5.
[6] Cheng Ka-wing,Shi Jian-jun,Ou Shi-yi,et al.Effects of fruit extracts on the formation of acrylamide in model reactions and fried potato crisps[J].Journal of Agricultural and Food Chemistry,2010,58:309-312.
[7] Mlotkiewicz J A.The Royal Society of Chemistry[M].London(UK):Cambridge,1998:19-27.
[8] Jing Hao,Kitts D D.Antioxidant activity of sugar-lysine Maillard reaction products in cell free and cell culture systems [J].Archives of Biochemistry and Biophysics,2004,429:154-163.
[9] Chen Xiu-min,Kitts D D.Antioxidant activity and chemical properties of crude and fractionated Maillard reaction products derived from four sugar-amino acid Maillard reaction model systems[J].Annals of the New York Academy of Science,2008,1 126:220-224.
[10] Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay [J].Free Radical Biology and Medicine,1999,26:1 231-1 237.
[11] CHENG Ka-wing,ZENG Xiao-hui,TANG Yun-sang,et al.Inhibitory mechanism of naringenin against carcinogenic acrylamide formation and nonenzymatic browning in Maillard model reactions[J].Chemical Research in Toxicology,2009,22:1 483-1 489.
[12] ZHANG Yu,ZHANG Ying.Effect of natural antioxidants on kinetic behavior of acrylamide formation and elimination in low-moisture asparagine-glucose model system[J].Journal of Food Engineering,2008,85:105-115.
[13] ZHANG Y,ZHANG Y.Study on reduction of acrylamide in fried bread sticks by addition of antioxidant of bamboo leaves and extract of green tea[J].Asia Pacific Journal of Clinical Nutrition,2007,16(Suppl 1):131-136.
[14] Friedman M.Food browning and its prevention:an overview [J].Journal of Agricultural and Food Chemistry,1996,44:631-653.
[15] Wagner K H,Derkits S,Herr M,et al.Antioxideative potential of melanoidins isolated from a roasted glucoseglycine model[J].Food Chemistry,2002,78(3):375-382.
