诱导植物乳杆菌生物膜形成的环境因素探索*
2014-12-16任晓镤李明杨任少东王群霞
任晓镤,李明杨,任少东,王群霞
1(塔里木大学 生命科学学院,新疆阿拉尔,843300)
2(新疆南疆特色农产品深加工兵团重点实验室,新疆阿拉尔,843300)
3(新疆阿拉尔质量技术监督综合检测检验所,新疆阿拉尔,843300)
细菌生物膜是指由细菌本身分泌的多聚基质包裹、能黏附于某种有生命或者无生命固体表面的一种有结构的群体,这是一种保护性的生长模式,它使细菌能够在恶劣环境下存活[1]。所有的微生物均能够形成生物膜[2]。细菌生物膜的形成是一个极为复杂的过程,受到外界各种因素的影响。不同的微生物,不同的因素均对生物膜的形成有重要影响。李延荣等[3]曾对金黄色葡萄球菌生物膜形成的影响因素进行过探索,表明金葡菌生物膜的形成存在不依赖于细菌数量的机制,NaCl及葡萄糖能够在不影响细菌生长的条件下促进其生物膜的形成。任晓镤等[4]曾经对表皮葡萄球菌ATCC 35984生物膜的形成有过研究,其结果显示NaCl、高于0.2%的Ca2+以及8%及以上浓度的乳糖均对表葡菌生物膜的形成有明显的抑制作用。李静等[5]对粪肠球菌生物膜形成及其影响因素进行了分析,发现培养时间为36 h,培养温度为37℃,生物膜引导材料为乳胶时生物膜内活菌数最多。真菌也能够形成生物膜使其更适应于环境。任晓萍等[6]对真菌生物膜形成的影响因素进行了综述,指出碳源、唾液、氧气、酸碱、温度及真菌种类均对其生物膜的形成影响巨大。长久以来,国内外研究人员对病原微生物生物膜形成的影响因素探讨较多,而对于有益生物膜的研究较少。Morikawa[7]曾对枯草芽孢杆菌有益生物膜对人类的贡献进行了综述,他指出有益生物膜在作为生防试剂、生物反应器及生物修复等方面起着重要作用。吴迪等[8]将固定化微生物生物膜技术应用于处理农村生活污水,较大程度地除去了污水中的有机物质,使污水处理与利用结合得更加紧密。张正等[9]则是将微生物生物膜应用于水产养殖业,他指出依靠富集有益微生物所形成的生物膜,通过微生物的新陈代谢作用实现对养殖废水中有害物质的降解和去除,进而达到水质净化的目的。乳酸菌作为公认安全细菌,其胞外代谢产物均为公认安全,因此该类细菌所形成的生物膜有着巨大的开发研究潜力,深入研究并开发利用其特性成为必然趋势。同其他微生物一样,乳酸菌生物膜的形成也受到各种外界环境因素的影响。植物乳杆菌是一种常见于乳制品、肉类及蔬菜发酵制品中的乳酸菌,与人类的关系极为密切,对肠道微生物有重要影响,能够通过胃并定植于人体肠道发挥有益作用[10]。无论在食品发酵、工业乳酸发酵,还是医疗保健等领域,都有着极为广泛的应用。本文旨在探索1株分离自新疆传统乳制品——酸奶疙瘩并且不能形成生物膜的植物乳杆菌,寻找外界环境因素中是否存在能够诱导其生物膜形成的条件,使乳酸菌的有益生物膜更广泛地应用于食品领域。
1 材料方法
1.1 实验材料
1.1.1 试验菌株
生物膜形成强阳性标准菌株——表皮葡萄球菌ATCC 35984,生物膜阴性乳酸菌——植物乳杆菌10#。
1.1.2 仪器及试剂
Absorbance Microplate Reader(Bilog,ELx808),96孔板(Labphil Biotechnology),移液器(Eppendorf AG),MRS肉汤培养基(北京奥博星生物技术有限公司),葡萄糖、NaCl、CaCl2、MgCl2、乳酸、柠檬酸、苹果酸、H3PO4、麦芽糊精及明胶等均为国产分析纯。
1.1.3 微量板半定量法检测细菌生物膜的形成
根据Christensen等的方法[11]并略做改动。按1∶100的接种比例将过夜培养的菌液30 μL,接种至3 mL培养基中,振荡摇匀后,吸取200 μL至96孔细胞培养板中,每株接种5孔;剩余3孔为对应空白对照(等体积的相应空白液体培养基);同时每一培养板中设阳性对照(ATCC 35984)。37℃恒温静置培养48 h后,取出培养板用Microplate Reader测定其生长浊度OD590值,然后轻轻拍出培养液,无菌水洗板4次,每次振摇30下左右,以洗去未黏附细菌。56℃烘干固定1 h,50 μL 0.5%结晶紫染色5 min,自来水冲洗除去多余染液,37℃晾干,再用Microplate Reader测定其生物膜形成OD490值。所有生物膜形成检测实验均在不同时间重复3次。
1.1.4 不同理化因素对植物乳杆菌生物膜形成的诱导
1.1.4.1 不同接种量
按不同的接种比例(1∶1、1∶5、1∶10、1∶50、1∶100、1∶200、1∶300、1∶400、1∶500、1∶1 000)将培养过夜的细菌母液接种至3 mL液体培养基中,按照1.1.3所述检测细菌生物膜的形成。
1.1.4.2 不同培养温度
按1.1.3所述将上样好的96孔板分别置于不同的温度(20、28、37、42 ℃)静置培养48 h,然后再检测其生物膜的形成。
1.1.4.3 不同培养时间
按1.1.3所述将上样好的96孔板置于37℃条件下分别培养不同的时间(8、16、24、48、72 h),然后检测其生物膜的形成。
1.1.4.4 不同浓度葡萄糖
在细胞培养板中分别加入以含不同质量分数(0、0.5%、1.0%、2.0%、3.0%、4.0%、6.0%、8.0%、10.0%)葡萄糖的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.4.5 不同浓度NaCl
在细胞培养板中分别加入以含不同质量分数(0、1.0%、2.0%、4.0%、6.0%、8.0%、10.0%)NaCl的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.4.6 不同pH值
按1.1.3所述分别将液体培养基调为不同的pH(1.8、2.8、3.8、4.8、5.8、6.8、7.8、8.8、9.8、10.8),再检测其生物膜的形成。
1.1.4.7 不同浓度Ca2+和Mg2+
在细胞培养板中分别加入以含不同质量分数(0、0.5%、1.0%、1.5%)Ca2+与 Mg2+的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.5 不同食品添加剂对植物乳杆菌生物膜形成的诱导
1.1.5.1 不同浓度乳酸
在细胞培养板中分别加入以含不同体积分数(0、0.2% 、0.4% 、0.8% 、1.2% 、1.6% 、2.0% 、3.0%)乳酸的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.5.2 不同浓度柠檬酸
在细胞培养板中分别加入以含不同体积分数(0、0.2% 、0.4% 、0.8% 、1.2% 、1.6% 、2.0% 、3.0%)柠檬酸的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.5.3 不同浓度H3PO4
在细胞培养板中分别加入以含不同体积分数(0、0.2% 、0.4% 、0.8% 、1.2% 、1.6% 、2.0% 、3.0%)磷酸的液体培养基200 μL,按照1.1.3所述检测细菌生物膜的形成。
1.1.5.4 不同浓度麦芽糊精
在细胞培养板中分别加入以含不同质量分数(0、2.0%、5.0%、8.0%、12.0%、15.0%、18.0%)麦芽糊精的液体培养基稀释的菌液200 μL,按1.1.3所述检测生物膜形成。
1.1.5.5 不同浓度明胶
在细胞培养板中分别加入以含不同质量分数(0、0.05%、0.10%、0.15%、0.20%)明胶的液体培养基稀释的菌液200 μL,按1.1.3所述检测生物膜形成。
2 实验结果
2.1 不同理化因素诱导植物乳杆菌生物膜的形成
从图1可以看出,不同的理化条件对植物乳杆菌的生长影响各不相同,并且对该细菌生物膜形成的诱导情况也各异。细菌母液接种量在1∶1~1∶1 000变化时,细菌的生长情况变化不大,各比例的接种量也对其生物膜的形成无明显诱导作用(如图1a);该细菌在所选择4个温度梯度条件下,细菌的生长及其生物膜均无明显变化(如图1b);细菌培养时间的缩短及延长对其生长及生物膜的形成无明显影响(如图1c);葡萄糖的添加能够显著提高细菌的生长量(P<0.05),并且随着浓度的增高呈增高趋势,尤其当葡萄糖浓度达到6.0%及以上时,相对于2.0%浓度其生长量显著增高(P<0.05),而葡萄糖的加入对细菌生物膜的形成却无影响(如图1d);8%及以上的NaCl能够显著抑制该细菌的生长(P<0.05),而在NaCl浓度低于6%时,对生长无明显影响。但是,当NaCl浓度在6%时,能够显著诱导植物乳杆菌形成强阳性生物膜(P<0.05),其他各浓度NaCl均无此作用(如图1e)。不同pH对细菌的生长及对生物膜形成的诱导作用也不相同,当初始培养液的pH在4.8~8.8之间时,细菌的生长基本未受到明显影响。同时,pH为4.8和5.8时,具有诱导植物乳杆菌形成弱阳性生物膜的作用(如图1f)。在所选浓度范围内,Ca2+和Mg2+均对细菌的生长和生物膜的形成无明显影响(如图1g)。
2.2 不同食品添加剂诱导植物乳杆菌生物膜的形成
从图2可以看出,不同的食品添加剂对植物乳杆菌的生长及对其生物膜的诱导方面各不相同。低浓度的乳酸(0.2%)的加入即可显著抑制细菌的生长(P<0.05),对其生物膜也无任何诱导形成的作用(如图2a);而其他2种食品添加酸——柠檬酸和H3PO4,在较低浓度条件下能够对细菌的生物膜起到一定的诱导作用。当柠檬酸浓度为0.2%~0.8%时,细菌能够形成弱阳性的生物膜(如图2b);而H3PO4诱导其形成弱阳性生物膜的范围为0.2%~0.4%(如图2c)。经t检验分析,2种有机酸对细菌生物膜形成的诱导作用存在一定差异,0.2%的柠檬酸能够达到显著水平(P<0.05),而0.2%浓度的H3PO4诱导生物膜形成的水平不显著。当2种酸浓度达到一定浓度时(高于1.2%),对细菌的生长有显著抑制作用(P<0.05)。麦芽糊精对细菌的生长及生物膜的形成均无影响(如图2d);而明胶却能够在不影响细菌生长的情况下诱导细菌形成弱阳性的生物膜(P<0.05)(如图2e)。
3 讨论
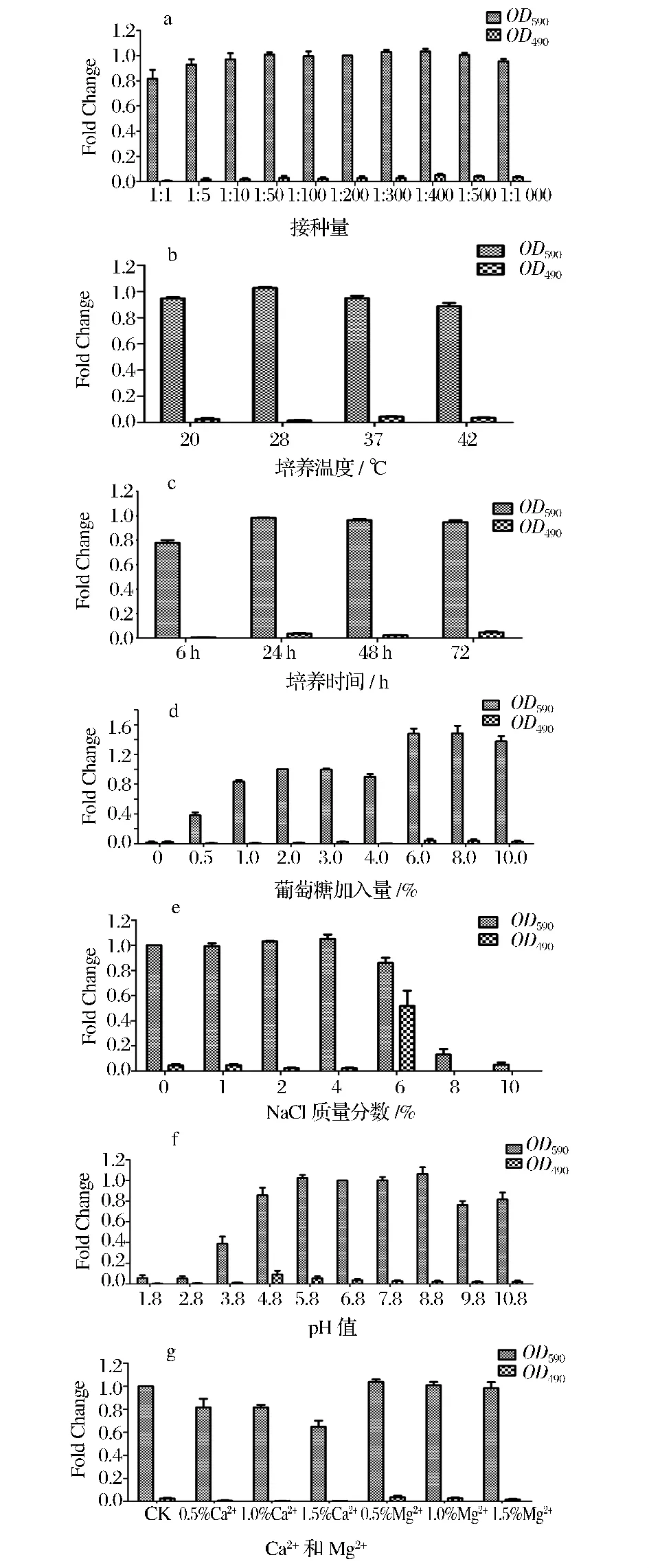
图1 不同的理化因素对植物乳杆菌生物膜形成的诱导Fig.1 Effects of different physical and chemical factors on biofilm formation by Lactobacillus plantarum
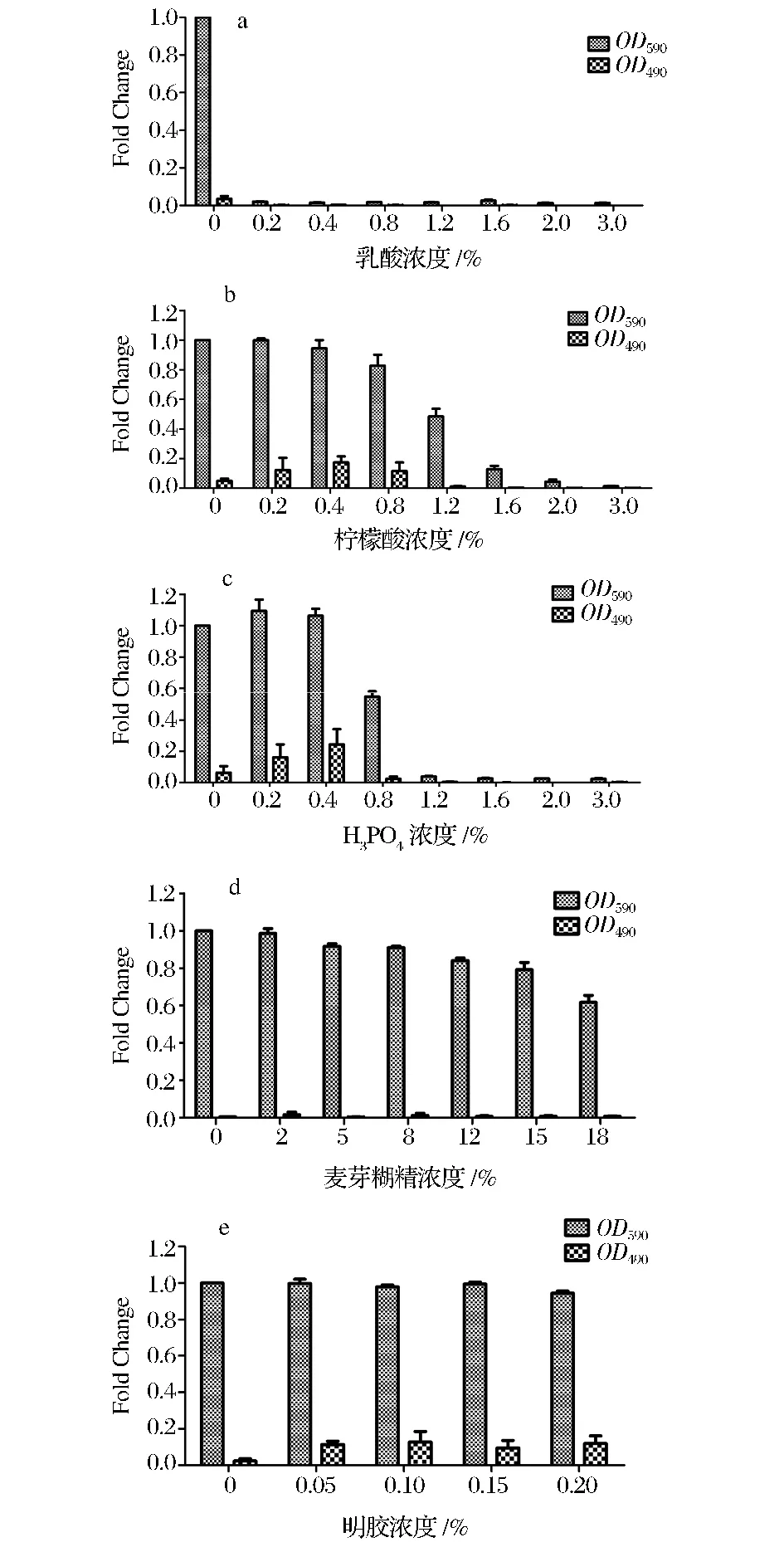
图2 不同的食品添加剂对植物乳杆菌生物膜形成的诱导Fig.2 Effects of different food additives on biofilm formation by Lactobacillus plantarum
乳酸菌是一类能够利用可发酵性糖类产生大量乳酸的细菌总称,它与人类的关系极为密切。乳酸菌代谢产物乳酸、胞外多糖及细菌素等广泛应用于食品及医药等领域,人类利用乳酸菌的历史可以追溯到5 000多年前[12]。许多乳酸菌是人体胃肠道固有有益菌丛,起着改善肠道内环境、抑制致病菌生长的作用,并且能够维持胃肠道微生态平衡,提高机体免疫力等功能[13]。细菌生物膜通常作为常见致病菌耐药性产生的主要原因之一,而人们往往忽略了生物膜对人类有益贡献的另一方面。充分将细菌生物膜的特性利用以为人类作更大的贡献成为一种必然趋势。例如枯草芽孢杆菌生物膜已被用作生物反应器、作为生防试剂及生物修复等方面;乳酸菌生物膜的应用也开始崭露头角,Atsumu等[14]已将乳酸菌与酵母菌共生形成的混合生物膜应用于发酵生产乙醇,并指出该种混合生物膜对细胞固定化技术的发展有极大推进作用。因此,深入探索诱导乳酸菌生物膜形成的各种外界环境条件,有助于进一步开发利用乳酸菌生物膜。
本文研究了1株分离自新疆传统乳制品——酸奶疙瘩中的植物乳杆菌,它是生物膜阴性乳酸菌,本研究探索了不同的外界环境条件对其生物膜形成的诱导。结果表明,接种量、培养时间、培养温度、葡萄糖、Ca2+、Mg2+等理化因素均对该植物乳杆菌生物膜的形成无诱导作用;而乳酸及麦芽糊精也对其生物膜的形成无影响。在理化因素中,6%NaCl能够显著诱导该细菌生物膜的形成(P<0.05),而其他各浓度的NaCl均无此诱导作用。这可能是因为6%NaCl能够激活调控其生物膜形成的基因,进而诱导生物膜的形成。NaCl的这种诱导作用早在2001年就被提出过,Knobloch等[15]曾指出,NaCl能够抑制表皮葡萄球菌icaR基因(阻遏生物膜形成的基因)的表达,激活SigB和RsbU因子,进而诱导生物膜的形成;Rode等[16]证明NaCl对金葡菌生物膜的形成具有显著增强作用,这进一步验证了NaCl特有的诱导作用。有学者[17]指出,pH值在微生物生物膜的形成过程中起着至关重要的作用。这个作用可能是通过影响电子转移而达到对生物膜的影响的。适合于生物膜形成的pH范围很窄,并且不同的微生物其范围不同。在本研究中,当pH为4.8~5.8时,植物乳杆菌能够被诱导形成弱阳性的生物膜。同样,当加入食品添加酸类的浓度达到0.4%时,培养液的pH约为5.6,弱阳性的生物膜也被诱导形成。这两者前后呼应,说明在某个范围的pH能够起到诱导乳酸菌形成弱阳性生物膜的作用。明胶是水溶性蛋白质混合物,是一种无脂肪的高蛋白且不含胆固醇的天然营养型食品增稠剂,其主要组成为氨基酸组成相同而分子质量分布很宽的多肽分子混合物,组成明胶的蛋白质中含有18种氨基酸,蛋白质的含量高达82%以上,另外还含有16%的水和无机盐。国内外有关明胶与微生物生物膜的研究多是利用生物膜作为生物反应器进行明胶的水解,关于采用明胶作为微生物生物膜形成的诱导剂尚无研究。从本研究结果可以看出,明胶能够诱导植物乳杆菌形成弱阳性的生物膜,这可能是因为明胶具有较好的增稠效果,能够粘连细菌胞外多糖而发生聚集,进而形成生物膜。
从以上结果可以看出,各种不同的外界环境条件对细菌生物膜形成的诱导作用各不相同,在本研究中6%的NaCl能够诱导植物乳杆菌形成强阳性的生物膜,酸环境以及明胶也能够诱导该细菌形成弱阳性的生物膜,但是可能对其他种类的微生物,诱导其形成生物膜的因素又会发生改变,因为生物膜形成的影响因素众多且复杂。无论是哪种因素对其生物膜的诱导作用,其诱导机理均为推测,具体调控机制尚不清楚,需要进一步探索和研究。
[1] 陈伟.奶牛乳房炎葡萄球菌生物被膜形成机制研究进展[J].中国预防兽医学报,2009,31(12):996-1 000.
[2] Flemming H C,Neu T R,Wozniak D J.The EPS matrix:the"house of biofilm cells[J].Journal of Bacteriology,2007,189(22):7 945-7 947.
[3] 李延荣,陈伟.不同理化因素对奶牛乳腺炎性金黄色葡萄球菌生物膜形成的影响[J].中国预防兽医学报,2013(12):964-967.
[4] 任晓镤,陈伟,张利莉.不同环境因素对表皮葡萄球菌生物膜形成的影响[J].西北农业学报,2011,20(12):1-5.
[5] 李静,马勋.粪肠球菌生物膜的形成及影响因素[J].中国预防兽医学报,2008,30(7):523-526.
[6] 任晓萍,杨蓉娅,樊昕等.真菌生物膜影响因素的研究进展[J].中国真菌学杂志,2009,4(3):183-185.
[7] Morikawa M.Beneficial biofilm formation by industrial bacteria Bacillus subtilis and related species[J].Journal of Bioscience and Bioengineering,2006,101(1):1-8.
[8] 吴迪,高贤彪,李玉华,等.两级回流生物膜工艺处理农村生活污水效果[J].农业工程学报,2013,29(1):218-224.
[9] 张正,王印庚,曹磊,等.海水循环水养殖系统生物膜快速挂膜试验[J].农业工程学报,2012,28(15):157-162.
[10] 王水泉,包艳,董喜梅,等.植物乳杆菌的生理功能及应用[J].中国农业科技导报,2010,12(4):49-55.
[11] Christensen G D,Simpson W A,Younger J J,et al.Adherence of coagulase-negative staphylococci to plastic tissue culture plates:a quantitative model for the adherence of staphylococci to medical devices[J].Journal of Clin Microbiol,1985,22(6):996-1 006.
[12] 顾瑞霞.乳酸菌胞外多糖生物合成及生理功能特性的研究[D].哈尔滨:东北农业大学,2000.
[13] 肖荣,王远亮,李宗军.益生性乳酸菌黏附性研究进展[J].食品与发酵工业,2008,34(5):134-137.
[14] Atsumu Abe,Soichi Furukawa,Shinya Watanabe,et al.Yeasts and lactic acid bacteria mixed-specie biofilm formation is a promising cell immobilization technology for ethanol fermentation[J].Appl Biochem Biotechnol.2013,171(1):72-79.
[15] Knobloch J K,Bartscht K,Sabottke A,et al.Biofilm formation by Staphylococcus epidermidis deponds on functional RsbU,an Activator of the sigB operon:differential activation mechanisms due to ethanol and salt stress[J].Journal of Bacteriol,2001,183(8):2 624-2 630.
[16] Rode T M,Langsrud S,Holck A,et al.Different patterns of biofilm formation in Staphylococcus aureus under food-related stress conditions[J].International Journal of Food Microbiology,2007,116(3):372-383.
[17] Patil SA,Harnisch F,Koch C,et al.Electroactive mixed culture derived biofilms in microbial bioelectrochemical systems:The role of pH on biofilm formation,performance and composition[J]. Bioresource Technology,2011,102(20):9 683-9 690.
