高渗胁迫对光滑球拟酵母蛋白质组的影响*
2014-12-16徐沙刘立明
徐沙,刘立明
1(江南大学生物工程学院工业生物技术教育部重点实验室,江苏无锡,214122)
2(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
3(江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡,214122)
光滑球拟酵母(Torulopsis glabrata)发酵生产丙酮酸过程中,为了维持发酵体系的pH始终处于最适范围,需要流加NaOH等碱性物质。随着NaOH等中和剂的不断添加,发酵体系渗透压不断升高,导致细胞活力和丙酮酸积累能力的显著下降,最终影响丙酮酸生产效率。前期研究表明,在利用T.glabrata发酵生产丙酮酸的过程中,当发酵液中丙酮酸浓度大于45 g/L时,丙酮酸合成能力受到显著限制,高渗透压的抑制作用在此时成为进一步优化发酵过程的关键限制因素[1]。
微生物在遭受环境刺激时,往往会伴随着蛋白质组表达水平的变化[2]。如Gori等在研究汉逊酵母盐胁迫条件下蛋白质组的变化情况时发现,盐胁迫条件下被诱导表达的蛋白主要是甘油合成/异化途径和糖酵解途径上游酶系;而被抑制表达的蛋白主要是糖酵解途径的下游、三羧酸途径和氨基酸合成途径中的酶[3]。利用二维电泳和同位素标记相对和绝对定量(iTRAQ)技术,可以同时分析数以百计的蛋白质,从系统水平研究微生物在蛋白质表达层面响应胁迫的机制[4]。本研究以具有工业应用价值的T.glabrata为研究模型,采用蛋白质组学的理论和技术,从应用基础方面,探索T.glabrata抵御高渗透压胁迫的机理。在此基础上,如能根据所获得的生理机制,采用适当的手段强化T.glabrata在高渗透压胁迫条件下的生理功能,可以最终可以达到提高目标产物的产量、转化率和生产强度的目的。这一研究结果可应用于有机酸发酵及其他典型工业生物过程中,为工业生物技术,特别是发酵过程优化提供新的技术思路。
1 材料与方法
1.1 菌种
T.glabrata CCTCC M202019,是 NA-、Bio-、B6-和Bio-营养缺陷型,由本研究室自行筛选并保藏[5]。
1.2 培养基和培养条件
1.2.1 发酵培养基(/L)
葡萄糖 100 g,NH4Cl 7 g,KH2PO45 g,MgSO4·7H2O 0.8 g,乙酸钠6 g,烟酸4 mg,盐酸硫胺素30 μg,烟酸吡哆醇 100 μg,生物素10 μg,核黄素50 μg,CaCO340 g(摇瓶培养时调节pH用)。添加NaCl改变发酵培养基渗透压,0、30、50、80 g/L NaCl对应的溶液渗透压分别为 860,1 765,2 603和 3 324 mOsmol/kg。培养基初始pH 5.5。维生素液过滤除菌后加入。
1.2.2 摇瓶培养
从新鲜斜面上接1环菌入种子培养基(50 mL/500 mL锥形瓶),于30℃、200 r/min下摇瓶培养24 h后,以10%接种量(v/v)接入发酵培养基。摇瓶发酵:500 mL锥形瓶中发酵培养基为50 mL,温度为30℃,转速200 r/min,发酵时间为48 h。
1.3 试剂
ReadyPrepTMProtein extraction kit,ReadyPrep 2-D clean up kit,ReadyPrep 2-D Starter kit,RC DC Protein Assay Kit I(bovine IgG standard),17 cm/pH4 ~7 预制胶条,覆盖琼脂糖溶液,矿物油均购自Bio-Rad(上海)公司。SDS-PAGE凝胶配制试剂盒购自碧云天生物技术研究所,蛋白酶抑制剂Cocktail购自Roche公司,其余化学药剂均购自上海生工。
1.4 二维电泳
1.4.1 样品制备
取培养至对数生长中期的细胞,发酵液离心(4 ℃,10 000×g,1 min),除去上清,用超纯水洗涤3次。取出 ReadyPrepTMProtein extraction kit,取 1 mL 2-D Rehydration/Sample Buffer 并加入 10 μL TBP、0.2%两性电解质和20 μL蛋白酶抑制剂,漩涡混匀器混匀,再加入50 μL湿菌体。将混合后的样品置于冰上,用超声波破碎仪进行细胞破碎,方法为:每破碎30 s停10 s,共破碎30 min。离心(4 ℃,16 000×g,30 min),将上清液转移至干净的离心管中。样品可直接用于上样至IPG胶条,或者-80℃保藏待用。
1.4.2 总蛋白定量
采用RC DC Protein Assay Kit I(Bovine IgG standard)进行总蛋白定量。
1.4.3 等电聚焦和聚丙烯酰胺凝胶电泳
(1)取出低温保存的样品溶液和17 cm IPG胶条,室温放置10 min。
(2)沿聚焦盘中槽边缘由左至右,线性加入样品,保证中间样品液连贯且无气泡。
(3)去除IPG胶条上的保护层,将IPG胶条胶面朝下置于样品液上,胶条正极对应聚焦盘正极并与电极紧密接触,胶条下面溶液保证无气泡。
(4)每根胶条上覆盖约1.5 mL矿物油,对好正、负极,盖上盖子,将聚焦槽水平放置于等电聚焦仪中,设置等电聚焦程序。
(5)等电聚焦程序:

选择所放置的胶条数,设置胶条极限电流(50 μA/根)和等电聚焦时的温度(20℃)。
(6)聚焦结束后,将胶条置于水化盘中,立即采用ReadyPrep2-D Starter kit中的平衡液平衡15 min。
(7)将胶条转移至15%聚丙烯酰胺凝胶,电泳程序为:2 w/gel 1 h,16 w/gel 4 h。
(8)电泳结束后,轻轻撬开两层玻璃,取出凝胶,进行染色。
1.4.4 图像采集及蛋白点差异分析
将经过染色的凝胶用Image Scanner III Image Scanner III(GE美国)扫描仪扫描成像之后,应用PDQuest 8.0.1(Bio-Rad)软件进行图像分析。
1.5 基于iTRAQ的蛋白质组学分析
(1)提取对数生长中期的细胞全蛋白并定量。
(2)蛋白定量后,各取相同量(50~100 μg)的蛋白(体积不大于25 μL,少于25 μL的用专用裂解液补至25 μL)进行还原化和烷基化。
(3)按样品50∶1加胰蛋白酶,37℃放置12~16 h。
(4)加入相应的同位素标记试剂(114、115、116和117,标记试剂为 ABI公司的 iTRAQ标记试剂盒),室温放置1 h。
(5)加入10 μL 1 mol/L的乙醇胺进行终止,室温放置30 min。
(6)各取相同的体积的样品混合后进行HPLC分离(4个梯度),自动点板器点板。
(7)将带有样品的靶板加基质后进行HPLC-质谱鉴定,HPLC为日本岛津公司的2D-nano-HPLC,质谱为美国ABI公司的MALDI-TOF-TOF 4700。
(8)搜索数据库,得出峰对应的蛋白质,并进一步获得相对定量结果。
两样本的比值在0.9~1.1之间的,可以认为两样本的含量是一样的(对于本次实验而言,每次实验这个值会略有不同),而小于0.9或大于1.1均可认为两样本之间的比值存在差异。
1.6 渗透压测定
发酵液渗透压采用OSMOMAT 030冰点渗透压仪测定(OSMOMAT 030,Gonotech GmbH,Berlin,Germany)。
2 实验结果
2.1 光滑球拟酵母蛋白质组概况
为了对T.glabrata盐胁迫前后蛋白表达具有更加全面的认识,进行了针对细胞胞内全蛋白分布的蛋白质组学分析。在pI值为4~7的胶条上,T.glabrata的蛋白质点主要分布在pI值为5~7,分子量主要分布在30 k~100 kDa的范围内(图1A),说明 T.glabrata的蛋白多偏碱性,小分子量的蛋白质含量较少。不同渗透压胁迫条件下T.glabrata蛋白质组差异比较如图1所示。
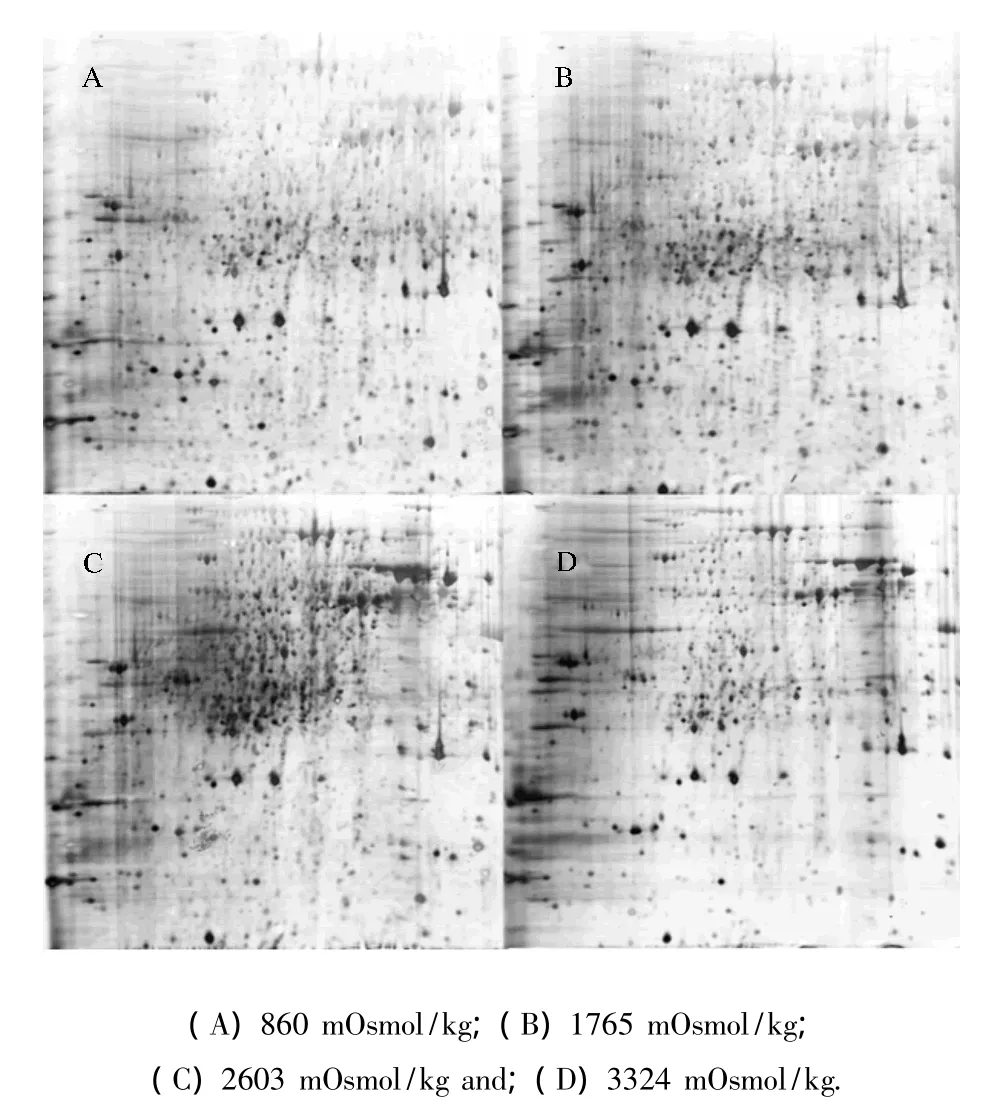
图1 不同渗透压条件下光滑球拟酵母蛋白质组的变化Fig.1 Total proteome of T.glabrata on the gel with pH of 4~7
采用PDQuest 8.0软件进行图像分析和数据采集,在培养基渗透压分别为 860 mOsmol/kg、1765 mOsmol/kg、2603 mOsmol/kg和 3324 mOsmol/kg时,T.glabrata的蛋白点分别鉴定出891、869、822和805个,匹配率分别为98%、98%、100%和96%,说明蛋白质种类随渗透压变化影响不大。比较渗透压为3324 mOsmol/kg的条件与正常条件(860 mOsmol/kg)时蛋白质组差异表明,含量提高2倍的蛋白点有37个,其中含量提高3倍的蛋白点20个,另外含量下降2倍以上的点为35个。
为了更深入透彻地研究不同渗透压条件下T.glabrata蛋白质组的变化,采用同位素标记相对和绝对定量(iTRAQ)技术进行进一步分析。iTRAQ技术是一种新的蛋白质组学定量研究技术(下文中的得到所有结果均基于这项技术)。在不同渗透压胁迫条件下,T.glabrata的相对蛋白含量(即高渗胁迫与正常培养条件下蛋白含量之比),两样本的比值如果在0.9~1.1之间的,可以认为两样本的含量是一样的,即比值为1∶1;而小于0.9或大于1.1均可认为两样本之间的比值是有差异的。iTRAQ技术检测到589个蛋白,绝大多数都功能已知。在渗透压为1765 mOsmol/kg、2603 mOsmol/kg和 3324 mOsmol/kg时,相对于对照条件(860 mOsmol/kg),分别有125、91和109个蛋白表达水平上调;94、89和78个蛋白表达水平下调。
2.2 中心代谢途径的差异蛋白分析
如表1所示,中心代谢途径中表达量发生上调的蛋白有8个。其中6-磷酸葡萄糖异构酶(CAGL0H05445g)、果糖二磷酸醛缩酶(CAGL0L02497g)、柠檬酸合酶(CAGL0H03993g)和 6-磷酸葡萄糖酸脱氢酶(CAGL0M13343g)只在较低的高渗条件下蛋白表达量提高;而异柠檬酸脱氢酶(CAGL0I07227g)和转酮醇酶(CAGL0D01298g)在3个不同的高渗条件下表达水平均有提高。己糖激酶(CAGL0F00605g)的表达水平受到一定程度的抑制。整体而言,相比正常条件,高渗环境下的酵母细胞中心代谢途径略有上调,其中多数蛋白的表达水平只在渗透压相对较低的条件下(1765 mOsmol/kg)有所提高,渗透压对中心代谢途径的蛋白质表达水平影响不大。
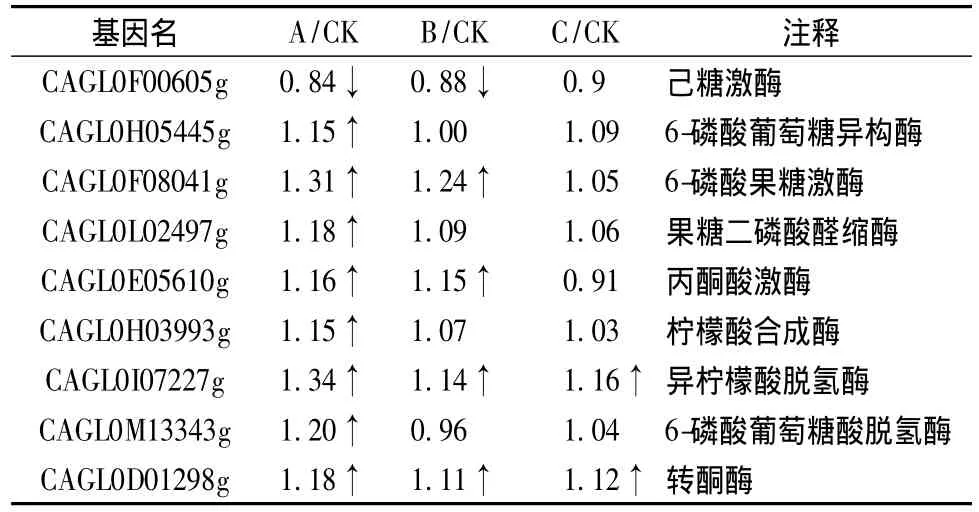
表1 中心代谢途径的差异表达蛋白Table 1 Differential expression proteins in central metabolic pathways
2.3 能量代谢途径的差异蛋白分析
检测到的中心代谢途径中与能量代谢相关的差异表达蛋白有6-磷酸果糖激酶(CAGL0F08041g)、丙酮酸激酶(CAGL0E05610g)、异柠檬酸脱氢酶(CAGL0I07227g)和己糖激酶(CAGL0F00605g),前三者蛋白表达水平上调,而后者的表达受到一定程度的抑制。
氧化磷酸化途径中的蛋白表达如表2所示,共检测到8个蛋白或亚基。除复合物II以外(未检测到相关蛋白或亚基),复合体Ⅲ、Ⅴ的表达水平特别是复合体V有明显上调;而复合体I的表达可能略有下调。其中H+转运ATP酶(CAGL0A00495g)的蛋白表达水平上调幅度在1.2倍以上,有明显提高。
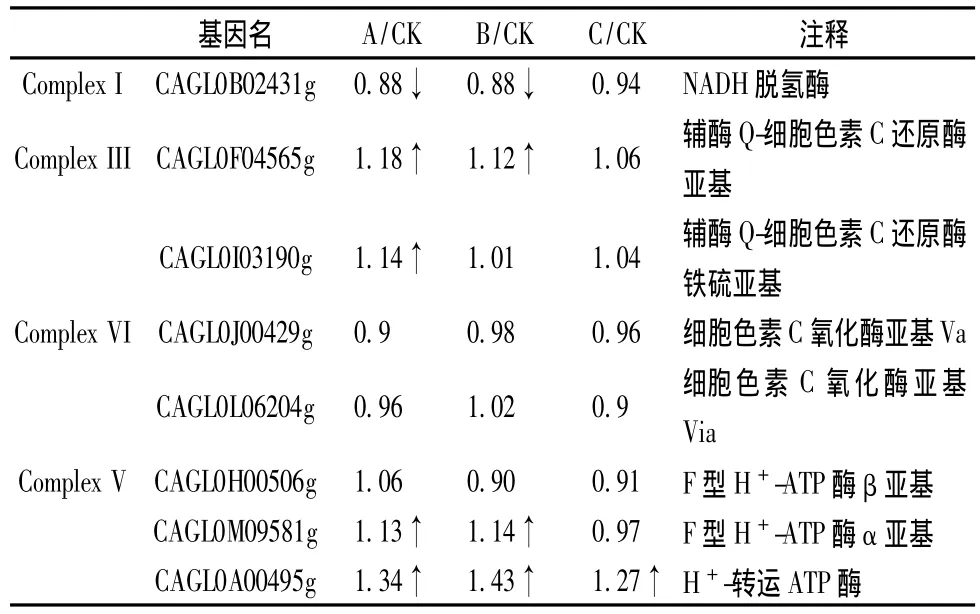
表2 高渗条件对能量代谢途径蛋白质表达的影响Table 2 Osmotic-regulated proteins in energy metabolism pathway
2.4 其他代谢途径的差异蛋白分析
如表3所示,在渗透压为1765 mOsmol/kg、2603 mOsmol/kg和3324 mOsmol/kg的条件下尿素羧化酶(CAGL0M05533g)的蛋白表达水平分别为正常条件下(860 mOsmol/kg)的0.72、0.74和0.74倍,有明显下降。与液泡相关的蛋白如CAGL0M00352g、CAGL0G01342g、CAGL0K04807g和 CAGL0M00616g等表达水平有一定程度的提高,可能与高渗条件下相容性溶质在胞质和液泡中的分布情况有关。液泡Ca2+通道蛋白(CAGL0J08613g)介导高渗胁迫下的液泡Ca2+释放,但研究表明该蛋白的表达水平没有发生变化,说明它可能并不依靠浓度的增加而是通过提高蛋白活性,来降低高渗胁迫对细胞的影响。此外,超氧化物歧化酶(CAGL0C04741g)和富脯蛋白(CAGL0G00968g)的表达水平也有明显提高。
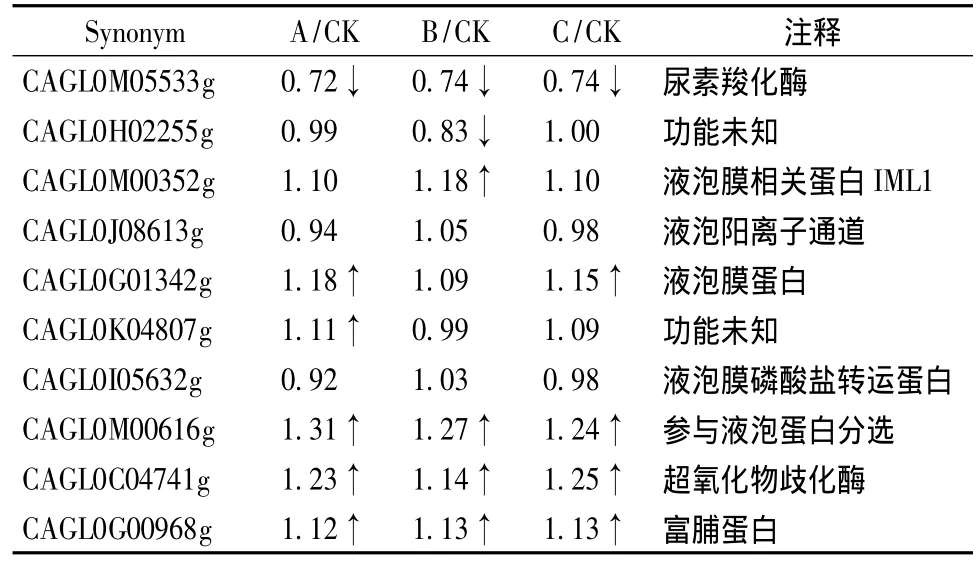
表3 高渗条件对其他蛋白质表达的影响Table 3 Other osmotic-regulated proteins
3 讨论
尽管有部分蛋白未检出,但作者通过对中心代谢途径、能量代谢途径、其他途径等分析仍然得到了一些有用的结果。对中心代谢和能量代谢途径的研究发现,在高渗条件下,与能量相关的蛋白表达量有一定程度的提高,尤其是那些参与产生ATP或形成NADH的基因。高渗胁迫条件下,细胞产生更多的能量,可以用于合成相容性溶质或激活其他抗胁迫途径,抵抗高渗胁迫对细胞的负面作用。上述研究结果和Schmidt等关于pH胁迫对T.glabrata蛋白质组的研究结果类似。Schmidt等发现在pH为4.0的条件下,葡萄糖分解酶(Glk1p、Fba1p、Pgi1p、Cdc19p/Pyk1p、Pdc1p、Tdh3p和Tkl1p)和三羧酸循环途径中的酶(Aco1p、Lsc2p和 Mdh1p)表达水平都发生上调[6]。
多数生物依靠积累甘油作为相容性溶质抵御渗透压胁迫[7]。如Hirasawa等通过研究酿酒酵母在高渗胁迫条件下胞内蛋白质表达的变化情况,发现胁迫诱导3-磷酸甘油脱氢酶(Hor2p)表达量提高并伴随着甘油的积累[8]。但在本研究中,当发酵液渗透压分别为 1765 mOsmol/kg、1765 mOsmol/kg和 3324 mOsmol/kg时,3-磷酸甘油脱氢酶(CAGL0C05137g)的蛋白表达量与正常条件(860 mOsmol/kg)之比分别为1.05、1.02和1.02,没有发生上调。前期转录组研究也表明,高渗胁迫对HOG-MAPK途径的影响不大。因此作者认为,与酿酒酵母不同,T.glabrata可能并不存在积累甘油作为相容性溶质,平衡胞内外渗透压,抵御高渗胁迫的机制。
此外,本研究还发现超氧化物歧化酶(CAGL0C04741g)和富脯蛋白(CAGL0G00968g)的表达量大幅度提高。作者前期研究表明,高NaCl浓度会增加胞内的活性氧(ROS)浓度[9],超氧化物歧化酶的表达量提高可能起到减轻ROS对细胞的损伤作用。而富脯蛋白是一种含磷蛋白,其主要特点是氨基酸组成中脯氨酸含量特别高占25%~40%以上。高渗环境下,富脯蛋白表达量提高可能与T.glabrata胞内的脯氨酸的积累有一定关系[10]。因此,下一步作者将考虑添加脯氨酸或者在胞内过量表达脯氨酸作为相容性溶质,达到进一步提高T.glabrata抗高渗胁迫能力的目的。
[1] LIU LM,Xu QL,LI Y,et al.Enhancement of pyruvate production byosmotic-tolerant mutant of Torulopsis glabrata[J].Biotechnology and Bioengineering,2007,97(4):825-832.
[2] Lackner DH,Schmidt MW,Wu S,et al.Regulation of transcriptome,translation,and proteome in response to environmental stress in fission yeast[J].Genome Biology,2012,13:R25.
[3] Klaus GM,Christophe C,Henrik DM,et al.Proteomic changes in Debaryomyces hansenii upon exposure to NaCl stress[J].FEMS Yeast Research,2007,7(2):293-303.
[4] 乌日娜,岳喜庆,张和平.益生菌Lactobacillus casei Zhang在酸胁迫下的蛋白质组学研究[J].食品与发酵工业,2012,38(7):17-20.
[5] XU S,ZHOU JW,LIU LM,et al.Arginine:A novel compatible solute to protect Candida glabrata against hyperosmotic stress[J].Process Biochemistry,2011,46(6):1 230-1 235.
[6] Schmidt P,Walker J,Selway L,et al.Proteomic analysis of the pH response in the fungal pathogen Candida glabrata[J].PROTEOMICS,2008,8(3):534-544.
[7] Bahieldin A,Sabir JSM,Ramadan A,et al.Control of glycerol biosynthesis under high salt stress in Arabidopsis[J].Functional Plant Biology,2013,41(1):87-95.
[8] Hirasawa T,Yamada K,Nagahisa K,et al.Proteomic analysis of responses to osmotic stress in laboratory and sake-brewing strains of Saccharomyces cerevisiae[J].Process Biochemistry,2009,44(6):647-653.
[9] Zhou XM,Ferraris JD,Burg MB.Mitochondrial reactive oxygen species contribute to high NaCl-induced activation of the transcription factor TonEBP/OREBP[J].American Journal of Physiology-renal Physiology,2006,290:1 169-1 176.
[10] CHEN JY,ZHAO J,NING J,et al.NtProRP1,a novel proline-rich protein,is an osmotic stress-responsive factor and specifically functions in pollen tube growth and early embryogenesis in Nicotiana tabacum[J].Plant Cell and Environment,2014,37(2):499-511.
