螺旋藻多糖抗H 22肿瘤作用研究
2014-12-16陈宏硕李晓颖冯鹏棉柏松高建胜
陈宏硕,李晓颖,冯鹏棉,柏松,高建胜
(1.河北联合大学电气工程学院,河北唐山063009;2.河北联合大学公共卫生学院,河北唐山063009;3.河北联合大学冀唐学院,河北唐山063009)
螺旋藻是一种微藻类古老生物,属于蓝藻门,颤藻科。螺旋藻不仅营养价值很高,且其含有的大量生物活性物质对人体非常有益,其中最引人注目的是螺旋藻多糖。螺旋藻多糖是从螺旋藻藻体、螺旋藻培养液中提取分离出来的水溶性多糖,是一类具有促进细胞生长、抗辐射、抗衰老、降血脂、抗肿瘤、免疫调节活性、促进蛋白质合成等功能的天然生物活性物质[1-3]。尤其近年来研究报道螺旋藻多糖具有良好的抗肿瘤作用,并且它还是天然化合物,具有无毒、高效的特点。
因此,对于研究其抗肿瘤作用及机制变得越来越重要。本文就螺旋藻多糖抗小鼠H22肿瘤作用进行初步研究,旨在探讨螺旋藻多糖其抗肿瘤作用及机制,从而为进一步研究开发螺旋藻多糖药物提供理论参考。
1 材料与方法
1.1 螺旋藻
食用螺旋藻粉购自山东东营康瑞科技开发有限责任公司,符合国家标准GB/T 16919-1997。
1.2 细胞株
H22肝癌细胞购自上海研晶试剂公司。
1.3 实验动物
BALB/c小鼠,6~8 周,体重 20 g~22 g,购自中国人民解放军军事医学科学院实验动物中心。
1.4 仪器
R-1001-L旋转蒸发仪:郑州长城仪器有限公司;BCM-1000A型生物洁净工作台:南京庚辰科学仪器公司;Forma 3110系列水套CO2培养箱:上海创迅医疗器械有限公司;XSZ-H型生物显微镜:重庆光电仪器有限公司;MK3全自动酶标仪:北京华运安特科技有限公司等。
1.5 螺旋藻多糖提取
螺旋藻粉→配成12%的藻粉溶液→加入胰蛋白酶水解→加入木瓜蛋白酶水解→真空浓缩→酒精沉淀→丙酮洗涤→冷冻干燥→多糖粗制品→柱层析→透析→得多糖精品。
1.6 模型制备及分组
动物适应性饲养7 d后,取健康的小鼠60只(雌雄各半),称重后随机分为3组:空白对照组、模型组、给药组。取接种7d的种鼠腹水H22细胞,用生理盐水制成细胞数为2×106个/mL的细胞悬液,以每鼠0.2 mL接种于模型组和给药组小鼠右前肢腋窝皮下[4]。接种24 h后开始给药,给药组以 1000 mg/kg/d灌胃,空白对照组、模型组用等量生理盐水灌胃,连续14 d,观察多糖的抑瘤作用
1.7 螺旋藻多糖抗H22肿瘤作用
1.7.1 脏器指数和抑瘤率的测定
连续给药14 d后,摘取瘤块、胸腺、脾,按所列公式方法计算抑瘤率、胸腺指数。
抑瘤率(%)=[1-平均给药组瘤重(g)/平均模型组瘤重(g)]×100%
胸腺指数=胸腺重(mg)/体重(g)
脾指数=脾重(mg)/体重(g)
1.7.2 脾细胞增殖能力的测定
制备浓度为5×106个/mL的脾细胞悬液加入96孔板中,每孔100 μL。实验孔分两组分别加ConA(终浓度 10 μg/mL)和 LPS(终浓度 5 μg/mL),对照孔加培养液100 μL,均设3个复孔,于5%CO2培养箱中37℃培养48 h后,离心弃去上清,每孔加入100 μL MTT(终浓度5μg/mL),继续培养4h,离心弃上清。每孔加DMSO 150 μL,溶解Fomazan颗粒,充分震荡后静置20 min,酶标仪570 nm波长下读数,按下列公式计算出其刺激指数(SI)。
刺激指数=实验孔OD570-630值/对照孔OD570-630值
1.7.3 NK细胞杀伤能力的测定
制得脾细胞悬液1×107个/mL作为效应细胞,取对数期H22肝癌细胞制成5×105个/mL为靶细胞,各组均设六个复孔,效应孔每孔加效应细胞100 μL,培养液100 μL,效靶孔每孔加效应细胞100LμL,靶细胞100 μL,单设一组靶细胞孔,每孔加靶细胞 100 μL,37℃培养4 h后,加入MTT,继续培养4 h,加入DMSO,用酶标仪在570 nm处测定其吸光度值,求出各组平均值以杀伤百分率表示NK细胞活性。
NK细胞活性(%)=[1-(实验孔OD值-效应孔OD值)/靶细胞对照孔OD值]×100%
1.7.4 吞噬细胞吞噬中性红能力测定
制备浓度为1.8×106个/mL的腹腔细胞悬液,96孔板中各加100 μL,每组6个复孔,于37℃培养2 h~5 h,弃上清,每孔加入0.073%的中性红溶液50 μL,继续培养30 min,弃去中性红,用预冷的PBS洗2次,每孔加入100 μL细胞裂解剂( 1000 mmol/L醋酸∶无水乙醇=1∶1,体积比),混匀在酶标仪上540 nm处测吸光度值。
1.7.5 小鼠血清肿瘤坏死因子(TNF-α)和γ干扰素(IFN-γ)含量的测定
连续给药14 d后,空白对照组、模型组、给药组分别小鼠眼球取血,静置30 min,2500 r/min离心10 min以分离血清,-20℃保存。ELISA法检测血清中TNF-α、IFN-γ含量。
1.8 统计学处理
所得数据用x±s表示,统计学分析采用双样本等方差假设的t检验法,以P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 小鼠脏器指数及抑瘤率的测定结果
小鼠脏器指数及抑瘤率的测定结果见表1。
表1 脏器指数及抑瘤率的测定结果(±s,n=20)Table 1 The experimental results of organ index and antitumor rate(±s,n=20)
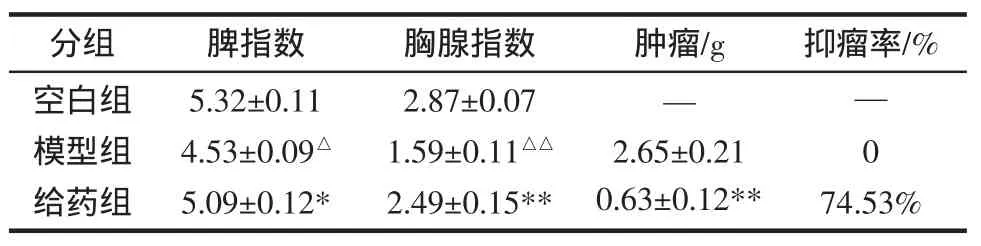
表1 脏器指数及抑瘤率的测定结果(±s,n=20)Table 1 The experimental results of organ index and antitumor rate(±s,n=20)
注:△P<0.05,△△P<0.01vs空白组;*P<0.05,**P<0.01vs模型组。
分组 脾指数 胸腺指数 肿瘤/g 抑瘤率/%空白组模型组给药组5.32±0. 114.53±0.09△5.09±0.12*2.87±0. 071.59±0.11△△2.49±0.15**—2.65±0. 210.63±0.12**— 074.53%
由表1可见,与空白组相比,模型组脾指数有明显差异(P<0.05),胸腺指数有明显差异(P<0.01);与模型组相比,给药组脾指数有明显差异(P<0.05),给药组胸腺指数有明显差异(P<0.01)。这就说明螺旋藻多糖对小鼠免疫器官起到了一定的保护作用。与模型组相比,给药组瘤重显著降低,差异显著(**P<0.01),且抑瘤率达74.53%,而根据国家药监局新药特药评审规定,抑瘤率达30%以上,就算作有效即可作为新药开发。综上,螺旋藻多糖在一定程度上能够明显抑制肿瘤生长。
2.2 小鼠脾淋巴细胞增殖的测定结果
小鼠脾淋巴细胞增殖的测定结果见表2。
表2 淋巴细胞增殖实验结果(±s,n=20)Table 2 The experimental results of Lymphocyte proliferation(±s,n=20)

表2 淋巴细胞增殖实验结果(±s,n=20)Table 2 The experimental results of Lymphocyte proliferation(±s,n=20)
注:**P<0.01vs模型组。
分组 T细胞刺激指数 B细胞刺激指数空白组模型组给药组4.39±0. 232.27±0. 133.74±0.31**4.27±0. 362.11±0. 143.58±0.29**
从表2中得出,与模型组相比,T淋巴细胞的刺激指数有显著升高 (P<0.01),B淋巴细胞的刺激指数亦有显著升高(P<0.01)。实验结果表明小鼠的T细胞和B细胞的刺激指数均有明显改善,螺旋藻多糖是一种免疫细胞激活剂,有提高免疫力的作用。
2.3 小鼠脾NK细胞活性的测定结果
小鼠脾NK细胞活性的测定结果见表3。
表 3 NK 细胞杀伤活性(±s,n=20)Table 3 Kill rate of NK cells(±s,n=20)

表 3 NK 细胞杀伤活性(±s,n=20)Table 3 Kill rate of NK cells(±s,n=20)
注:△P<0.05,△△P<0.01vs空白组;*P<0.05,**P<0.01vs模型组。
分组 NK细胞杀伤率/%空白组模型组给药组56.19±2. 1333.27±3. 2750.53±4.04**
从表3中得出,与模型组相比显著性差异(P<0.01),给药组小鼠的NK细胞杀伤率达到50.53%,说明给药组小鼠NK细胞杀伤活性得到有效恢复。与空白组相比,给药组小鼠NK细胞杀伤率无显著性差异(P>0.05)。本实验结果表明,螺旋藻多糖可能具有激活NK细胞的活性及抑制NK细胞凋亡的能力。
2.4 巨噬细胞吞噬中性红能力的测定结果
巨噬细胞吞噬中性红能力的测定结果见表4。
表4 巨噬细胞吞噬中性红能力(±s,n=20)Table 4 Phagocytic index of Neutral Red(±s,n=20)

表4 巨噬细胞吞噬中性红能力(±s,n=20)Table 4 Phagocytic index of Neutral Red(±s,n=20)
注:△△P<0.01vs空白组;**P<0.01vs模型组。
分组 OD空白组模型组给药组0.59±0. 030.25±0.01△△0.47±0.03**
从表4中得出,与空白组相比,模型组的吞噬能力明显下降,呈显著性差异(P<0.01)。而给药组小鼠巨噬细胞的活性却得到恢复,与空白组相比无显著性差异(P>0.05),与模型组相比呈显著性差异(P<0.01)。这说明螺旋藻多糖能够有效改善巨噬细胞的活性,从而提高由巨噬细胞诱导的细胞免疫能力。
2.5 小鼠血清TNF-α和IFN-γ含量的测定结果
小鼠血清TNF-α和IFN-γ含量的测定结果见表5。
表5 小鼠血清中TNF-α和IFN-γ含量(±s,n=20)Table 5 The concentrations of TNF-α and IFN-γ in mice blood serum(±s,n=20)
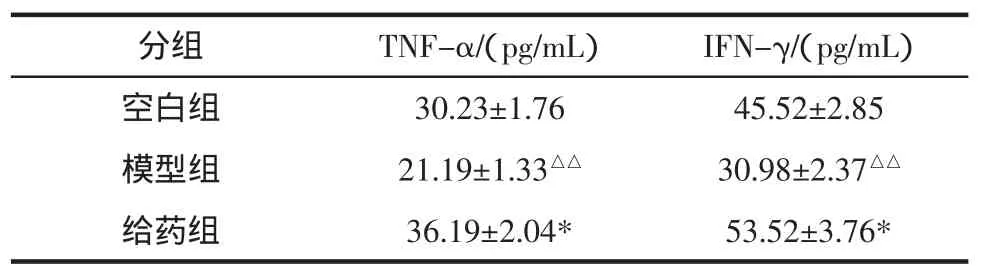
表5 小鼠血清中TNF-α和IFN-γ含量(±s,n=20)Table 5 The concentrations of TNF-α and IFN-γ in mice blood serum(±s,n=20)
注:△P<0.05,△△P<0.01vs空白组;*P<0.05,**P<0.01vs模型组。
分组TNF-α/(pg/mL)IFN-γ/(pg/mL)空白组 30.23±1. 7645.52±2.85模型组 21.19±1.33△△ 30.98±2.37△△给药组 36.19±2.04* 53.52±3.76*
从表5看出,与空白组相比,模型组血清中TNF-α、IFN-γ 含量均呈现显著性差异(P<0.01);与模型组相比,给药组血清中TNF-α、IFN-γ含量均呈现显著性差异(P<0.05)。这说明螺旋藻多糖在一定程度上能够升高TNF-α、IFN-γ在血清中的浓度,从而发挥其抑制肿瘤的作用。
3 结论与讨论
科学研究表明藻类中所含有的天然活性植物多糖具有免疫调节活性、抗肿瘤、毒副作用小的优势,且药物质量通过化学手段容易控制,故藻类多糖药物的开发及利用变得越来越重要。
本实验以 1000 mg/kg/d螺旋藻多糖给小鼠灌胃,抑瘤率可达到74.53%,抑制肿瘤效果良好,这充分说明螺旋藻多糖在抗H22肿瘤方面起到了重要作用。
胸腺和脾脏是机体内重要的免疫器官,其中胸腺是是T细胞发育、分化和成熟的场所,在机体的免疫调节中发挥重要的作用;而脾脏是各类免疫细胞居住和产生免疫应答的场所,也是合成免疫活性物质(如干扰素、补体、细胞因子等)的重要场所。因此,胸腺指数和脾脏指数能够反映机体免疫功能的强弱,可作为评价机体的免疫状态的客观指标。实验结果表明,模型组小鼠的胸腺细胞、脾细胞受到肿瘤细胞的诱导而逐渐凋亡,导致胸腺、脾明显萎缩。螺旋藻多糖能显著提高小鼠的胸腺指数与脾指数,与模型组相比,脾指数升高呈显著性差异(P<0.05),胸腺指数升高也呈现显著性差异(P<0.01),这说明螺旋藻多糖对免疫系统起到了保护和促进恢复作用。
NK细胞的免疫反应在宿主抗肿瘤和抗感染防御机制中扮演着重要角色。NK细胞是细胞免疫的非特异性成分,不需预先活化即可直接杀伤肿瘤细胞,是一类在肿瘤发生的免疫反应中起重要作用的效应细胞,处于机体抗肿瘤的第一道防线。它的活性受免疫因子调节,可引起一系列免疫应答[6,7]。因此,NK细胞杀伤活性的高低也是判断机体免疫功能尤其是细胞免疫功能大小的重要指标。实验结果显示,螺旋藻多糖能显著提高NK细胞的杀伤活性,与模型组相比,给药组的NK细胞杀伤活性提高并呈显著性差异(P<0.01)。另外,巨噬细胞是机体抗肿瘤免疫中的重要效应细胞,其抗肿瘤作用的最大特点是对肿瘤细胞的杀伤没有选择性,因而巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的标志之一。本实验结果表明,与模型组相比,给药组小鼠巨噬细胞吞噬能力显著提高(P<0.01)。以上说明螺旋藻多糖可增强特异性细胞免疫功能,能促进H22荷瘤小鼠非特异性免疫功能。
TNF-α是由活化的巨噬细胞/单核细胞和NK细胞、成纤维细胞产生的细胞因子有介导炎症、免疫调节、抗肿瘤等多种生物学功能。TNF-α对肿瘤细胞具有直接的杀伤和诱导凋亡作用[5-9]。TNF-α抗肿瘤具有高选择性杀伤功能,仅仅对肿瘤细胞细胞毒性作用,而不损伤正常细胞。IFN-γ主要由活化的T细胞和自然杀伤细胞(natural killer cel)所分泌,并以多种方式参与影响免疫应答,是体内作用最强的炎症介质之一,其生物学作用非常广泛,能通过多种机制激发炎症反应,在肿瘤的治疗中发挥重要作用。IFN-γ抑制肿瘤细胞增殖机制主要有以下几方面[10-12]:(1)能有效抗肿瘤内血管生成,抑制肿瘤转移;(2)对恶性肿瘤细胞有直接杀伤作用;(3)干扰素能抑制肿瘤细胞增生,诱导肿瘤细胞凋亡;(4)能够对癌基因进行调控,从而抑制癌基因的表达;(5)通过影响基质金属蛋白酶的表达而发挥抗肿瘤活性。本实验结果显示,螺旋藻多糖给药组显著提高了血清中TNF-α和IFN-γ的含量,增强了机体抗肿瘤的能力,且与模型组相比呈现显著性差异(P<0.05)。
综上所述,螺旋藻多糖具有良好的免疫增强活性,对H22肿瘤有抑制作用,提高了H22荷瘤小鼠的胸腺、脾脏指数、NK细胞杀伤活性及巨噬细胞的吞噬能力,增加了血清中TNF-α和IFN-γ的含量。从而显著提高机体免疫力,起到抑制肿瘤细胞的生长的作用。
[1] 刘志伟,邵学良.螺旋藻多糖研究进展[J].中国食物与营养,2008,29(1):18-21
[2] 盛建春,杨方美,胡秋辉.海藻多糖生物活性研究[J].食品科学,2005,26(3):262-264
[3] 孙鹏,胡君彦,李瑞强.螺旋藻多糖的结构及生物学活性研究[J].中国生物药物杂志,2005,26(3):185-187
[4] 徐叔云,卞如濂,陈修.药理试验方法学[M].3版.北京:人民卫生出版社,2002:1757-1827
[5] 王庭欣,夏立娅,吴广臣,等.海带多糖对小鼠T淋巴细胞及NK细胞活性的影响[J].河北大学学报,2008,28(6):656-658
[6] 徐惠波,牛晓晖,纪凤兰,等.云芝多糖对小鼠NK细胞与单核吞噬细胞系统的影响[J].中药药理与临床,2006,22(5):25-26
[7] 黄爱民,陈方,林卡莉.香菇多糖对荷瘤鼠血清IL-10、TNF-α和肿瘤DC表达的影响[J].时珍国医国药,2012,23(3):665-666
[8] 王丽君,姜红.龙牙楤木多糖抗肿瘤活性及对荷瘤小鼠免疫功能的影响[J].中国免疫学杂志,2011,27(2):130-134
[9] RUAN Zheng,FU Xiao-fang,ZHOU Quan-cheng etl.Effect of Polysaccharide L-2 from Lentinus edodes on TNF-α and IL-2[J].食品科学(英文版),2006,27(1):223-226
[10]杨铁虹,贾敏,梅其炳.当归多糖组分AP-3诱生小鼠脾细胞IL-2和 IFN-γ 的作用[J].药学学报,2006,41(1):54-57
[11]耿卫朴,徐曼,罗祎,等.灵芝多糖和当归多糖促进人外周血T淋巴细胞增殖和分泌IFN-γ[J].中国药理学通报,2012,28(5):665-668
[12]徐康康,李嵘,钱宗云.当归多糖对脾淋巴细胞IFN-γ、IL-2免疫活性的影响[J].药物生物技术,2007,14(6):439-441
