多重PCR法用于鸡、鸭肉源性的鉴定
2014-12-16段庆梓尚柯张玉张良
段庆梓,尚柯,张玉,张良
(成都市食品药品检测中心,四川成都610045)
目前,针对肉制品源性鉴定方法主要有蛋白质鉴定(等电聚焦电泳、酶联免疫吸附试验、色谱等)和基因鉴定两类。但食品中的肉类在经过蒸煮、熏烤等加工烹调过程后,失去了原有的蛋白质特性,因此蛋白质对肉类的鉴定存在一定的局限性。而利用PCR进行基因鉴定则很大程度上弥补了这一不足,DNA的耐热性强,在高温处理过的食品中仍能提取出小片段的DNA,并且DNA鉴别不依赖于组织和细胞的类型[1-3]。
近些年来,通过PCR方法对肉质源性的鉴定已经有了一定的研究。Dalmasso等选择12S rDNA和16S rDNA两个基因,建立了反刍动物、禽类、鱼类和猪肉的特异性引物,分别扩增出不同大小的片段来实现混合样品中物种的鉴定[4]。陈文炳等开发了真核生物所共有的18 S核糖体DNA(18S rDNA)与食品中猪、牛、羊、鸡等多种动物物种特异性基因片段之间的二重PCR检测方法[5]。Tanabe等构建了一对猪特异性引物,用于特异性扩增猪Cytb中基因长度为130bp的序列[6];Fujimura等构建了一对鸡特异性引物,能特异性扩增16S rDNA上一段102 bp的片段,在其他禽类中都没有扩增出该产物[7]。
本文通过对鸡、鸭的Cyt-b基因进行序列比对,设计了一条共同的上游引物(CD-U1)和鸡、鸭各自的下游引物(C-L1,D-L1),并通过调节PCR反应中3条引物的比例,同时以猪肉作为负对照,扩增得到的鸡、鸭片段大小分别为505 bp和436 bp,而猪肉无任何条带的扩增,说明所设计的引物具有较好的特异性。同时,将PCR的结果进行测序,并分别与GenBank中鸡、鸭的Cyt-b基因序列进行比对,结果显示我们所扩增的即为鸡、鸭Cyt-b基因的片段。且该多重PCR方法可检测出混合样品中鸡、鸭肉的比例最低为10%。因此,该多重PCR方法可根据所得基因片段的大小差异来对禽肉中鸡肉和鸭肉的成分进行鉴定。
1 材料
1.1 样品的采集
鸡肉、鸭肉、猪肉均购自当地超市和农贸市场。
1.2 主要试剂
动物基因组DNA提取试剂盒(购自Generay公司)、DNA聚合酶、10×缓冲液(含Mg2+离子)(购自TransGen公司)、DL1000 Marker和6×Loading Buffer(购自宝生物工程公司)、dNTP和GoldView染料(购自SolarBio公司),其余试剂均为国产分析纯。
1.3 引物设计
通过查阅文献[8-11]并参照GenBank中已提交的鸡(GU261716.1)、鸭(EU755252.1)的序列,设计了鸡、鸭共同的一条上游引物(CD-U1)和其各自的特异性下游引物(C-L1,D-L1)。CD-U1与C-L1扩增鸡的片段大小为505 bp,CD-U1与D-L1所扩增鸭的片段大小为436 bp。引物序列见表1。
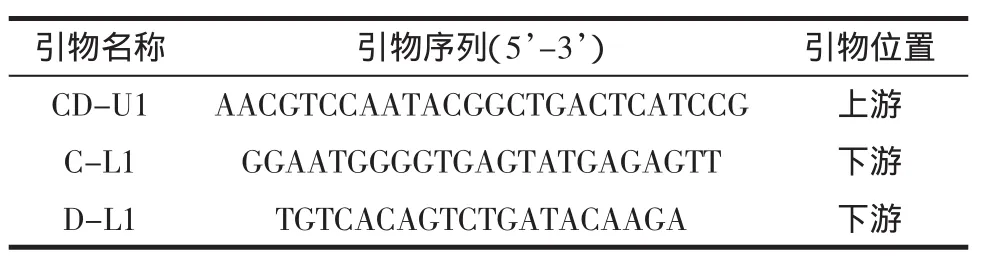
表1 鸡、鸭多重PCR引物序列Table 1 Primer sequence of chicken and duck for multiplex PCR
2 方法
2.1 基因组DNA提取
依照Generay公司动物组织基因组提取试剂盒操作说明分别提取鸡肉、鸭肉和猪肉的基因组DNA,所取组织量均为20 mg。提取的DNA用20 μL灭菌的超纯水溶解,放置-20℃保存备用。
2.2 多重PCR反应体系的确定
经引物比例调节后的PCR反应体系见表2。
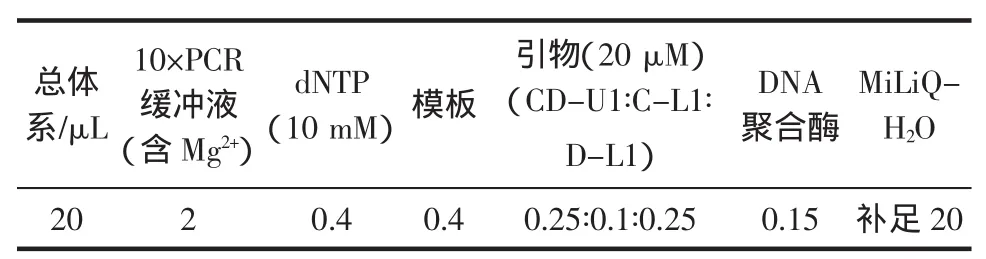
表2 鸡、鸭肉质鉴定的多重PCR反应体系Table 2 Multiplex PCR system for detecting chicken and duck
配制完毕后充分混匀进行如下PCR反应:94℃预变性 2 min,30 个扩增循环(94℃30s,54℃30s,72℃30 s),72℃最后延伸10 min。反应完毕后,将PCR产物取出,用琼脂糖凝胶电泳进行检测分析。
3 结果
3.1 多重PCR引物比例的确定
分别以不同体系的混合鸡、鸭DNA为模板(表3),来调整三个引物之间的比例,按2.2方法进行反应,进而确定多重PCR反应的最佳引物比例。

表3 鸡、鸭多重PCR预实验模板比例Table 3 Template proportion of chicken and duck for preliminary PCR μL
1)当引物比例 CD-U1∶C-L1∶D-L1=0.25∶0.15∶0.15时,进行PCR反应,电泳结果见图1(a)。
2)当引物比例 CD-U1∶C-L1∶D-L1=0.25∶0.1∶0.25时,进行PCR反应,电泳结果见图1(b)。
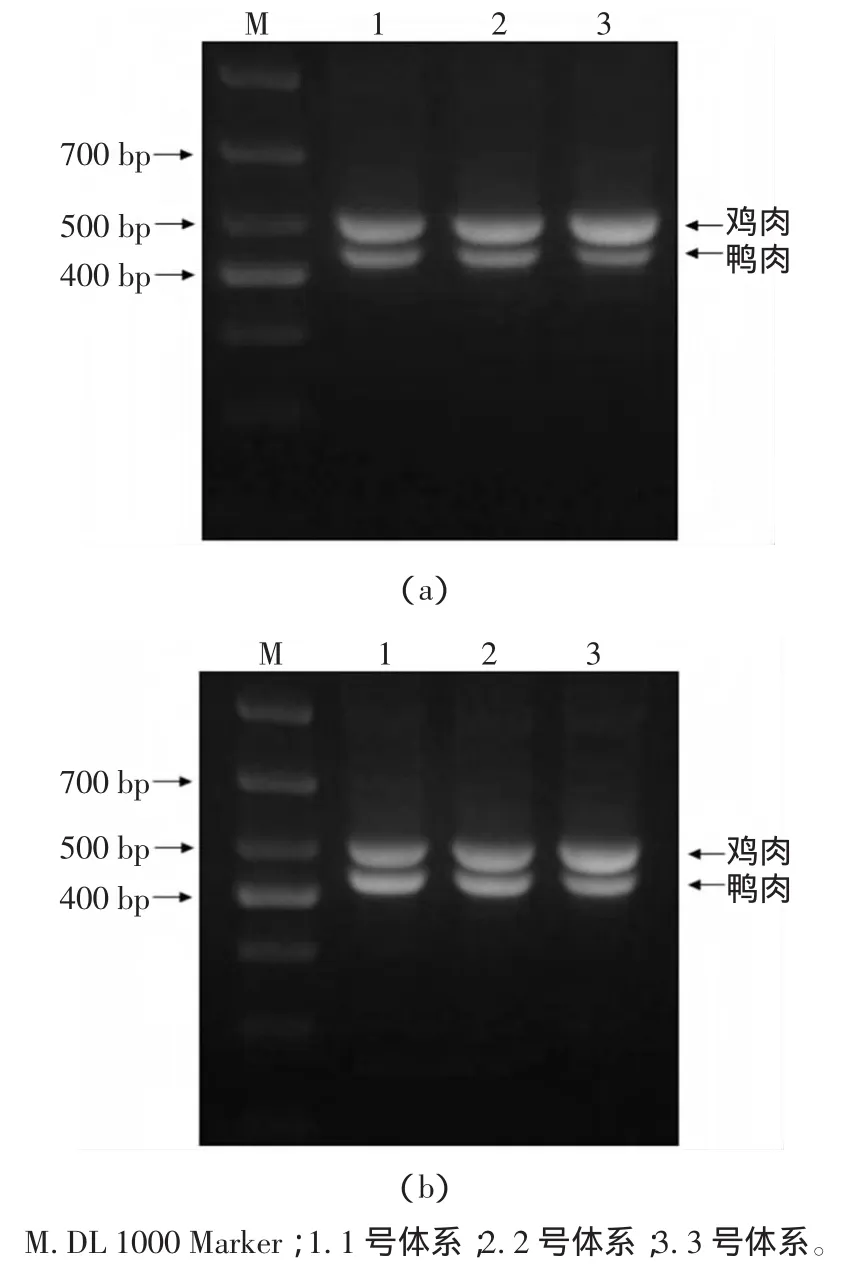
图1 不同引物比例的PCR预实验Fig.1 Different primer proportion of preliminary PCR
由图1可以显示,当引物比例CD-U1∶C-L1∶DL1=0.25∶0.15∶0.15时,不论模板量的多少,鸡条带(505 bp)亮度总高于鸭条带(436 bp),不符合预期结果;而当引物比例 CD-U1∶C-L1∶D-L1=0.25∶0.1∶0.25时,鸡、鸭条带的亮度随不同体系中模板量的变化而变化,且在鸡、鸭模板量相同的条件下,所扩增条带亮度一致,符合预期试验结果。因此选取引物比例CDU1∶C-L1∶D-L1=0.25∶0.1∶0.25为多重 PCR的引物比例。
3.2 鸡、鸭肉成分的鉴定
将所提取的鸡、鸭肉和猪肉基因组DNA分别按2.2方法进行PCR检测,电泳结果如图2所示。
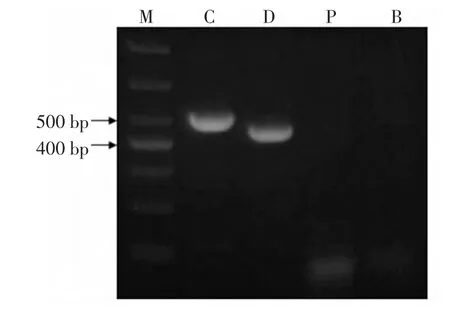
图2 鸡、鸭肉鉴定的PCR结果Fig.2 PCR results of detecting chicken and duck
阳性对照,阴性对照和空白对照均成立,即鸡肉扩增出505 bp的条带,鸭肉扩增出436 bp的条带,而猪肉和空白对照中均无条带。
3.3 鸡、鸭肉混合样品的检测
鸡、鸭混合(即PCR模板中鸡肉与鸭肉DNA的比例)依次为(0 ∶1);(0.1 ∶0.9);(0.25 ∶0.75);(0.5 ∶0.5);(0.75 ∶0.25);(0.9 ∶0.1);(1 ∶0)。模板混合均匀后,按2.2方法进行PCR扩增,电泳检测结果见图3所示。
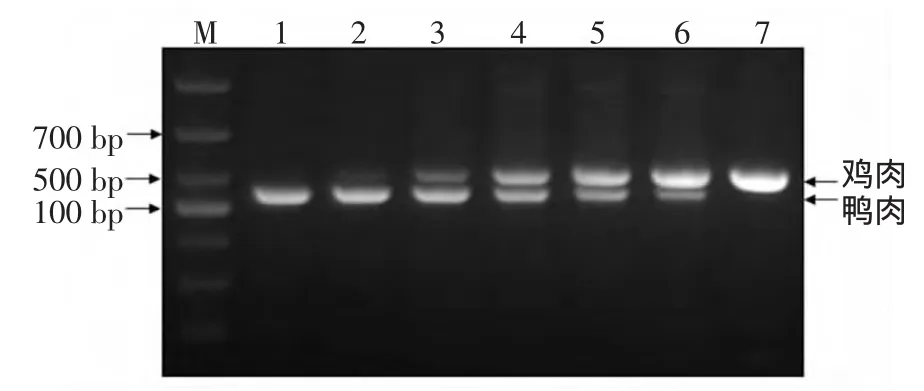
图3 多重PCR检测鸡鸭肉不同比例的混合模板Fig.3 Multiplex PCR detection of Mixture template containing chicken and duck.
第1泳道(模板完全为鸭肉)为鸭肉436 bp的条带;第7泳道(模板完全为鸡肉)为鸡肉505 bp的条带。第4泳道(鸡、鸭模板比例为0.5∶0.5)则同时出现鸡肉和鸭肉的条带,且亮度一致,表明所选取的引物比例合适。整个PCR结果随混合模板中鸡、鸭DNA量的变化而相应的改变。因此,该多重PCR体系可检测出混合样品中鸡、鸭肉的比例最低为10%。
3.4 成都市鸡、鸭肉的鉴别检测
分别在成都市的生产、流通和餐饮环节随机抽取鸡、鸭肉各30批,用所建立的多重PCR方法进行鉴别,部分(10个批次)检测结果见图4。

图4 鸡、鸭肉鉴别检测的部分(10批)PCR结果Fig.4 Partial PCR results of detecting chicken and duck
PCR结果显示目前成都市市场上的鸡、鸭肉风险度较低,暂无掺伪造假现象。
4 讨论
本实验所选取的鸡、鸭特异性引物均位于线粒体Cyt-b上,因为线粒体在动物的各个组织均大量存在,并且Cyt-b基因具有很高的保守性[12]。通过比对鸡、鸭的Cyt-b基因序列,确定了针对鸡、鸭的特异性检测引物,并进行了相应引物比例的PCR反应。同时,还对鸡、鸭混合模板进行了PCR试验,结果表明该方法所建立的多重PCR体系可检测出混合样品中鸡、鸭肉的比例最低为10%。为了进一步验证PCR结果的准确性性,将PCR产物送由华大基因公司进行测序,并将测序结果与GenBank中鸡、鸭的Cyt-b基因进行比对(图5)。比对结果显示,我们所扩增的鸡(505 bp)片段和鸭(436 bp)片段确实位于Cyt-b基因上,表明试验结果真实可靠。同时,用该方法对成都市场上的鸡、鸭肉抽样检测显示,目前市场上暂无鸡、鸭肉的掺伪造假现象。

图5 鸡、鸭PCR测序结果分别与GenBank中Cyt-b基因的序列比对Fig.5 The sequence of PCR results for chicken and duck were compared with Cyt-b gene in Genbank,respectively
由于目前相关法律法规没有明确规定,要求市场上的肉类制品标示出所含肉类的种类及含量,所以市售的肉制品均只标明成分而不标明各成分含量。在这种情况下,对肉制品中不同种属的肉类进行定量检测意义不大,故本试验中所使用的引物其特异性和灵敏度完全符合市场检测的要求[10]。因此,本实验设计的引物具有特异性强、灵敏度高的特点,建立的PCR检测方法样品用量少,结果准确,适合大规模推广应用。
[1] 李文静,李燕俊.分子学方法鉴定肉制品种属来源的研究进展[J].国外医学:卫生学分册,2009(3):151-158
[2] 韩敏义,唐明丽.PCR在肉类科学中的应用[J].畜牧与饲料科学,2009,30(9):57-60
[3] 刘旭辉,马贵平,史喜菊,等.商品中动物源性成分检测方法的研究进展[J].物医学进展,2007,28(10):91-94
[4] Dalmasso A,Fontanella E,Piatti P,et al.A multiplex PCR assay for the identification of animal species in feedstuffs[J].Mol Cell Probes,2004,18(2):81-87
[5] 陈文炳,邵碧英,廖宪彪,等.加工食品中若干动物成分的PCR检测技术应用研究[J].食品科学,2005,26(8):338-342
[6]TANABE S,MIYAUCHI E,MUNESHIG A E,et al.Method of detecting pork in foods for verifying allergen labeling and for identifying hidden pork in gradients in processed foods[J].Biotechnol Biochem,2007,71(7):1663-1667
[7]FUJIMURA T,TANABE S,MORIMATSU F,et al.Specific discrimination of chicken DNA from other poultry DNA in processed foods using the polymerase chain reaction[J].Biotechnol Biochem,2008,72(3):909-913
[8] Masunaga T,Chikuni K,Tanabe R,et al.A quick and simple method for the identification of meat species and meat products by PCR assay[J].Meat Science,1999,51(2):143-148
[9] 宗卉,范万红,温燕辉.应用多重PCR同时检测牛、羊源性成分[J].中国草食动物,2006,26(6):21-22
[10]孙艳华,张智禹,牛晋阳,等.PCR法快速检测熟肉制品中肉类来源[J].食品研究与开发,2010,31(5):139-142
[11]O irfan iLHAK,Ali ARSLAN.Identification of meat species by polymerase chain reaction technique[J].Turk J Anim Sci,2007,31(3):159-163
[12]Unseld M,Beyermann B,Brandt P,et al.Identification of the species origin of highly processed meat products by mitochondrial DNA sequences[J].Genome Research,1995,4:241-243
