橙皮苷酶高产菌株的选育及其酶学性质的研究
2014-12-16申丽静汪钊章银军沈雪亮
申丽静,汪钊,章银军,沈雪亮
(1.嘉兴职业技术学院生物与环境分院,浙江嘉兴314036;2.浙江工业大学生物与环境工程学院,浙江杭州310014)
橙皮苷是一种生物类黄酮,又名橘皮甙、陈皮甙、橘皮素-7-O-芸香糖甙等,橙皮苷广泛地分布于葡萄柚、橘、橙等芸香科植物中。我国是柑橘生产大国,除部分品种用于鲜食及加工外,许多品种及下脚料都未得到综合利用,造成极大的浪费。橙皮苷大部分存在于柑橘加工的废弃物中,每吨柑橘果实的下脚料中可得到橙皮苷7 kg~8 kg,橙皮苷在直径为1.27 cm~2.54 cm的果实中甚至达到干重的10%,因此橙皮苷来源非常广泛而且提取成本较低。由于橙皮苷在水中的溶解度和生物利用度都很低,所表现出来的药理作用相对较弱,需通过化学或者生物的方法对其进行结构修饰,以改进其溶解性,增强其功效。橙皮苷酶能够将橙皮苷水解为橙皮素单糖苷和橙皮素。橙皮素单糖苷是一种甜味剂的前体,口感好,热值低,安全性好,它还具有较强的抗感冒病毒的活性,并可用于生产染料。橙皮素是3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,具有抗氧化[1]、抗肿瘤[2]等功效,对糖尿病慢性并发症、皮肤病也有很好的疗效。橙皮苷的另一酶解产物鼠李糖是合成强心药物的前体之一,被广泛地应用于食品行业,如作为高档咖啡、饮料、肉制品的食品添加剂。
据报道[3],橙皮苷酶一般以酶系的方式存在,但是关于其作用机理的研究较少。本文利用固态发酵制备橙皮苷酶,初步研究了橙皮苷酶的酶学性质,并且对其酶解产物进行了鉴定,为橙皮苷酶作用机制的研究提供了一定的参考。橙皮苷酶还可防止橘片罐头中白浊的产生[4-6],影响橘片罐头质量的白点主要成分是橙皮苷,在其中添加一定的橙皮苷酶,即可防止白浊的产生。
1 材料与方法
1.1 培养基
1.1.1 富集培养基
酵母膏0.2%,葡萄糖2.0%,磷酸氢二钾0.2%,七水硫酸镁0.05%,硫酸铁0.001%,橙皮苷0.25%,pH自然。
1.1.2 平板培养基
蔗糖0.1%,橙皮苷0.25%,硫酸镁0.5%,磷酸氢二钾1.0%,氯化钾0.5%,硫酸铁0.01%,琼脂1.5%~2.0%,pH自然。
1.1.3 斜面培养基
硝酸钠0.2%,磷酸氢二钾0.1%,氯化钾0.05%,硫酸亚铁0.001%,硫酸镁0.05%,蔗糖3%,琼脂1.5%~2.0%,pH自然。
1.1.4 固体培养基
麸皮100 g,豆饼粉 20 g,200 mL水,磷酸氢二钾0.1%。
1.2 菌体的富集培养
称取菌源土样2 g,溶于装有50 mL无菌水和数十颗玻璃珠的250 mL三角瓶中,摇匀,移取5 mL悬浮液加入盛有25 mL富集培养基的250 mL三角瓶中,在30℃、200 r/min的条件下摇瓶培养4 d,移取5 mL培养液至另一盛有新鲜富集培养基的三角瓶中继续培养。如此重复3次。
1.3 菌种的初筛
将菌悬液涂布于平板培养基上,30℃下培养5 d,观察其透明圈大小,挑取有透明圈的菌株,进一步分离纯化后,接种于斜面培养基,30℃下培养72 h。
1.4 菌种的复筛
初筛所得的菌株接种于固体培养基,30℃下培养72 h,分别测定各个菌株橙皮苷酶活力,选取橙皮苷酶活力较大的作为实验用菌株。
1.5 诱变方法
单孢子菌悬液的制备:菌种在斜面培养基上培养7天后,用接种环挑取4~5环孢子于50 mL生理盐水中,用玻璃珠打散,通过双层滤纸过滤,滤纸在显微镜下观察,99%为单孢子,用血球计数板计算孢子数。
紫外线诱变处理:常规方法[7]。
硫酸二乙酯(DES)诱变处理:常规方法[7]。
1.6 橙皮苷酶的提取
将用固体培养基培养好的菌体用10倍培养基质量的蒸馏水浸泡,静置3 h~8 h,过滤得粗酶液,于0℃~4℃下保藏,备用。
1.7 橙皮苷酶酶活测定方法
橙皮苷酶酶活定义:在45℃、pH4.5的条件下,每分钟转化1μg橙皮苷所需的酶量为一个酶活力单位(U)。
橙皮苷及其酶解产物的检测方法:反相高效液相色谱法(HPLC),分离柱是Agilent的 ZORAX SB-C18,流动相比例为甲醇∶水=55∶45,流速1 mL/min,进样量20 μL,检测波长 283 nm。
酶活测定方法:试管中加5 mL pH4.5的醋酸-醋酸钠缓冲液、4.5 mL浓度为0.2%的橙皮苷溶液,在45℃下保温10 min,加入0.5 mL酶液,保温15 min,立即用沸水浴灭活10 min,高效液相色谱法测得剩余底物量或者生成产物的量,通过计算可得底物减少量。
2 结果与讨论
2.1 产橙皮苷酶菌种的筛选
2.1.1 菌种的初筛
将富集过的土样培养液和实验室保藏菌株斜面培养菌体用无菌水稀释后涂布于平板培养基上,30℃下培养5 d,观察其透明圈大小,挑取43株有透明圈的菌株,进一步分离纯化后,接种于斜面培养基,30℃下培养72 h。
2.1.2 菌种的复筛
初筛所得的菌株接种于固体培养基,30℃下培养72 h,根据方法1.6提取橙皮苷酶,测定橙皮苷酶活力,结果如图1所示。

图1 不同菌株的酶活力Fig.1 The enzyme activity of different strains
由菌种复筛结果可知,编号为10的菌株酶活力最高,达到105.6U/g培养基。酶活力为200 U/g~300 U/g的菌株共有19株,其活力只有第10号菌株的1/4左右,故选择第10号菌株为实验用菌株,命名为WZ1。
2.1.3 菌种的诱变
紫外线诱变:在20 W紫外灯40 cm处,菌悬液在磁力搅拌器下边搅拌边诱变,照射时间为16 min,致死率达到98.2%,正突变率为20%,经过筛选得到一突变株Aspergillus niger WZ01酶活有明显提高,经固态发酵后酶活可达 1839 U/g固体培养基,紫外诱变后其酶活力提高了74.2%。
硫酸二乙酯(DES)诱变:用磷酸缓冲液将Aspergillus niger WZ01新鲜斜面的孢子洗下,制成菌悬液,含孢子密度在106个/mL~107个/mL,取DES溶液和菌悬液等量(如5∶5)加入到无菌试管内混合,最后处理浓度为1%,在30℃下振荡处理30 min,致死率达到90%,正突变率为50%经过筛选得到一酶活力较高突变株AspergillusnigerWZ001,经固态发酵后酶活可达 3668 U/g固体培养基,DES诱变后其酶活力提高了99.4%。
2.2 橙皮苷酶解产物的鉴定
利用液质联用(LC-MS)法对橙皮苷酶转化液进行定性和定量的分析,并对液相色谱图上的三个主峰和橙皮苷标样、橙皮素标样进行二极管阵列全波长扫描,其液相结果如图2所示,质谱图如图3所示。

图2 酶转化液色谱图Fig.2 HPLC chromatogram of the enzymatic reactants
由图2可知,酶转化液中有三个主峰,峰1的保留时间和标样橙皮苷保留时间3.796 min一致,说明峰1是底物橙皮苷,峰2的保留时间为4.233 min,峰3的保留时间和标样橙皮素保留时间是9.221 min一致,说明峰3可能是橙皮素。
对液相色谱图中三个主峰以及橙皮苷标样和橙皮素标样进行二极管阵列全波长扫描。由于黄酮分子中存在桂皮酰基及苯甲酰基组成的交叉共轭体系,故黄酮类物质一般在紫外区域内有两个主要的吸收带,称为峰带Ⅰ(300 nm~400 nm)和峰带Ⅱ(220 nm~280 nm)[8]橙皮苷和橙皮素都是二氢黄酮,因其B环与吡喃酮环上的羰基共轭很弱,故带Ⅰ很弱,只在主峰峰带Ⅱ的长波方向处有一肩峰,而带Ⅱ也会有所红移。物质的吸收峰是由其结构决定的,吸收峰的相似性可以说明物质结构的相似性。由全波长扫描结果可知,它们的扫描图谱基本一致,即在250 nm~315 nm的范围内都有一明显的吸收带,其最大吸收波长为288 nm,在长波方向处都有一肩峰。扫描图谱的相似性说明了这5个峰所代表的物质结构的相似性,所以可以进一步验证了转化液的HPLC图谱中峰1为橙皮苷,峰3为橙皮素,而峰2是与橙皮苷、橙皮素结构相似的一种黄酮类物质。

图3 两种产物的质谱图Fig.3 Mass spectra of the products
由图3可知,峰2物质的分子量为464,与橙皮素单糖苷的分子量相吻合。通过全波长扫描已知峰2是一种与橙皮素、橙皮苷结构相似的物质,而且它是橙皮苷的酶解产物,由此可以确定峰2即橙皮素单糖苷。峰3物质的分子量与橙皮素的分子量302一致,在此也进一步验证了峰3是橙皮素。
2.3 橙皮苷酶酶学性质的研究
2.3.1 pH对酶活的影响
以橙皮苷作为底物,分别在pH为2.0、3.0、4.0、4.5、5.0、5.5、6.0、7.0、8.0、9.0 的条件下,测定橙皮苷酶酶活力,结果见图4所示。
由图4可见,当pH为5.0时橙皮苷酶酶活最高。pH对橙皮苷酶酶活影响较大,处于碱性和pH小于3.0的环境中橙皮苷酶基本失活。
2.3.2 温度对酶活的影响
以橙皮苷为底物,pH为4.5的醋酸-醋酸钠作为缓冲液,分别在 0、20、30、40、50、55、60、65、70、80 ℃的温度下,测定橙皮苷酶酶活,结果如图5所示。

图4 pH对酶活的影响Fig.4 Effect of pH on enzyme activity

图5 温度对橙皮苷酶的影响Fig.5 Effect of temperature on enzyme activity
由图5可知,橙皮苷酶的最适转化温度为60℃,当温度小于60℃时,随着温度的增加橙皮苷酶活力也稳步增加,而当温度大于60℃时,酶活下降趋势较快,当温度达到80℃时,橙皮苷酶基本失活。
2.3.3 橙皮苷酶的酸碱稳定性
将橙皮苷酶分别在 pH2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0 的环境中下放置 60 min,分别测定其酶活,结果如图6所示。

图6 橙皮苷酶的酸碱稳定性Fig.6 Effect of pH on enzyme stability
由图6可知,橙皮苷酶经过不同pH的缓冲液处理后酶活有所变化,但是在pH3.0~10.0的范围内都比较稳定,处理60 min后橙皮苷酶相对酶活都保持在90%以上,当pH超出该范围时橙皮苷酶酶活力急速下降。
2.3.4 橙皮苷酶的热稳定性
将橙皮苷酶分别在 0、20、30、40、50、60、70、80 ℃的环境中放置60 min,分别测定其酶活,结果如图7所示。
由图7可知,橙皮苷酶在低于60℃的条件下,其酶活性还可保持在最高酶活的90%以上,当处理的温度达到70℃时,酶活基本丧失。
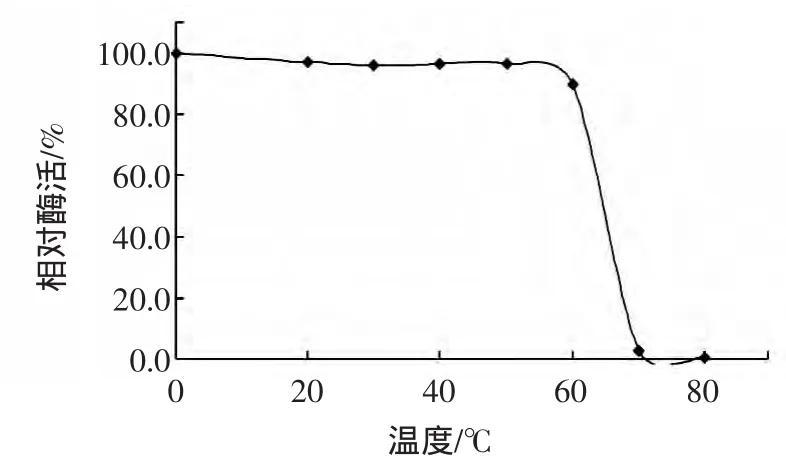
图7 橙皮苷酶的热稳定性Fig.7 Effect of temperature on enzyme stability
2.4 小结
从土壤和实验室保藏菌株中筛选得到了一株橙皮苷酶的高产菌株Aspergillus niger WZ1,经紫外诱变和硫酸二乙酯(DES)诱变后酶活分别提高了74.2%和99.4%,酶活达到了 3668 U/g固体培养基。该菌株所产橙皮苷酶能够将橙皮苷酶解为橙皮素单糖苷和橙皮素,该酶最适pH和最适温度分别是5.0和60℃,在pH 3.0~10.0和温度0℃~60℃的环境中,酶的稳定性较。
橙皮苷酶解后出现两个产物,说明橙皮苷酶可能以酶系的方式存在,它们分别作用于两个不同的糖苷键,即α-L-鼠李糖苷键和β-D-葡萄糖苷键,但是也有可能是一个酶同时作用于两个糖苷键。本论文的研究结果为进一步研究橙皮苷酶催化机理提供了一定的参考,若要进行深入的研究,还需对橙皮苷酶进行分离纯化,该工作的开展不但有利于理论研究的进行,而且能促进其在工业上的应用。
[1] Miyake Y,Yamamoto K,Tsujihara N,et al.Protective effects of lemon flavonoids on oxidative stress in diabetic rats[J].Lipids,1998,33(7):689-695
[2] So F V,Guthrie N,Chambers A F,et al.Inhibition of human breast cancer cell proliferation and delay of mammary tumorigenesis by flavonoids and citrus juices[J].Nutrition and Cancer,1996,26(2):167-181
[3] Daniela Monti,Andrea Pisˇvejcova',Vladiml'r Krˇen,et al.Generation of an A-L-Rhamnosidase Library and its Application for the Selective Derhamnosylation of Natural Products[J].Biotechnology and Bioengineering,2004,87(6):763-771
[4] 刘展,单杨,李向红.桔片罐头中白点消除方法探讨[J].湖南农业科学,2004(3):56-58
[5]陈曾三.酶处理橙皮苷的特性和利用[J].江苏食品与发酵,1999,9:18-21
[6] 康维民,贾文沦,吕国红.酶处理橙皮苷的性质与应用[J].中国食品添加剂,2000(3):19-22
[7] 章名春.工业微生物诱变育种[M].北京:科学出版社,1984:99
[8] 宋晓凯.天然药物化学[M].北京:化学工业出版社,2004:90-95
