培养基组成对布拉氏酵母生长的影响及其优化
2014-12-16杜晓蒙陶如玉圣志存贾士儒
杜晓蒙,陶如玉,圣志存,贾士儒
(教育部工业发酵微生物重点实验室,天津科技大学,天津300457)
布拉氏酵母是法国科学家HenriBoulard于1923年从印尼水果荔枝中分离得到的一株适温、非毒性酵母菌株,一般认为是酿酒酵母的亚种[1]。目前布拉氏酵母广泛用于预防和治疗各种腹泻、肠道炎症[1-2]。药代动力学研究显示,连续口服之后,布拉氏酵母能够在结肠内稳定存在3天左右,停药之后则会随粪便排出,不会在肠道内定植[3-4]。另外,使用细菌作为益生菌的最大危险是其可能会将耐药基因传给致病菌,而酵母不存在此类问题,是安全的微生态调节剂[5]。在许多国家,布拉氏酵母作为冻干产品用于预防儿童和成人的腹泻[2,6]。此外,布拉氏酵母制剂还能够增强微生态平衡,刺激免疫系统,作为饲料添加剂的应用已得到包括中国在内的许多国家的认可,因此在畜牧业中必将有广阔的应用前景[7-10]。
作为微生态制剂,要保证其生物疗效,肠道内必须达到足够数量的活菌数,因此本文以布拉氏酵母菌为菌株,研究了不同培养基成分、培养条件对其生物量积累的影响,初步确定最有利于菌体生长的培养条件,之后利用正交试验确定益生菌布拉氏酵母的最适摇瓶培养条件[11],为其活菌制剂的生产制备提供参考数据。
1 材料与方法
1.1 材料
1.1.1 菌株
布拉氏酵母菌由天津科技大学生化工程研究室分离筛选。
1.1.2 培养基
种子培养基:葡萄糖4%,蛋白胨1%,pH5.0;初始发酵培养基:葡萄糖4%,蛋白胨1%,KH2PO40.1%,MgSO4·7H2O 0.05%,pH5.0。
1.2 方法
1.2.1 培养过程及生物量测定
挑取布拉氏酵母接种至种子培养基中,30℃,200 r/min振荡培养12 h后,以7%接种至发酵培养基中,振荡培养24 h,取样测其生物量及残糖含量[12]。
1.2.2 单因素试验
分别以碳源种类、氮源种类、磷酸二氢钾浓度、硫酸镁浓度为影响因素进行实验,以菌体量、光密度为指标研究各因素对菌体生长的影响及其最适水平。
1.2.3 正交试验
在单因素试验结果基础上,以葡萄糖、酵母膏、磷酸二氢钾及硫酸镁浓度为考察因素,以布拉氏酵母菌体干重(DCW)为考察指标,进行L16(44)正交试验,研究各因素对酵母生长的影响[13],因素水平表如表1所示,共16个实验组。

表1 正交试验因素水平表Table 1 Factors and levels of orthogonal test
1.2.4 培养条件对酵母生长的影响
在正交试验结果基础上,研究接种量和培养基初始pH对酵母生物量的影响,实验步骤同1.2.1。
2 结果与讨论
2.1 布拉氏酵母生长曲线
利用Bioscreen全自动生长曲线测定仪绘制布拉氏酵母生长曲线[14],结果如图1所示,接种后0~4 h处于延滞期,4 h~24 h为对数生长期,24 h之后进入稳定期。因此试验过程中种子液的培养时间选择对数期12 h,发酵培养时间 24 h[15]。
2.2 培养基组成对布拉氏酵母生长的影响
2.2.1 碳源种类对酵母生长的影响
试验结果如图2所示,以麦芽糖为碳源时酵母生物量最高,比葡萄糖组高9.4%;乳糖组生物量最低,其原因可能在于布拉氏酵母菌降解或发酵乳糖的能力较差[14]。鉴于蔗糖成本高于葡萄糖,而且葡萄糖是最容易利用的碳源之一[15],因此综合考虑,选择葡萄糖为碳源较为适宜。
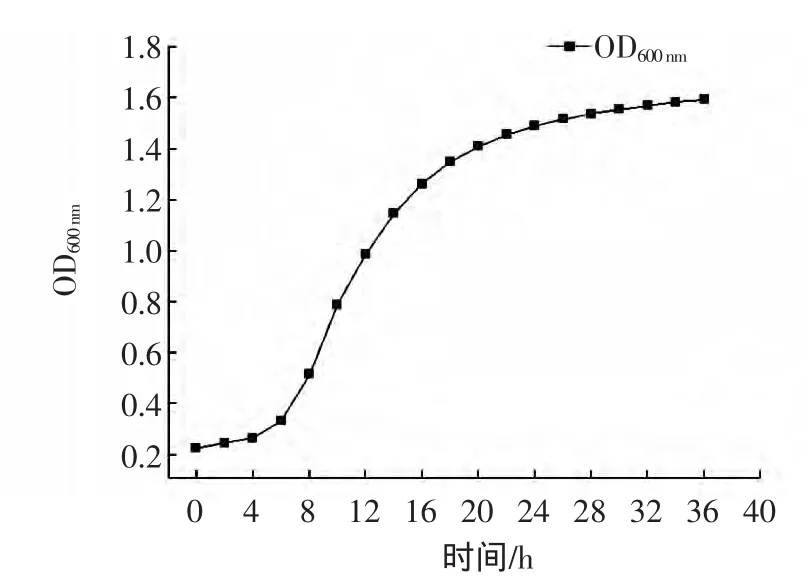
图1 布拉氏酵母生长曲线Fig.1 Growth curve of Saccharomyces boulardii

图2 碳源种类对布拉氏酵母生物量的影响Fig.2 Effect of carbon sources on the biomass
2.2.2 氮源种类对酵母生长的影响
氮源种类对布拉氏酵母生长的影响见图3。
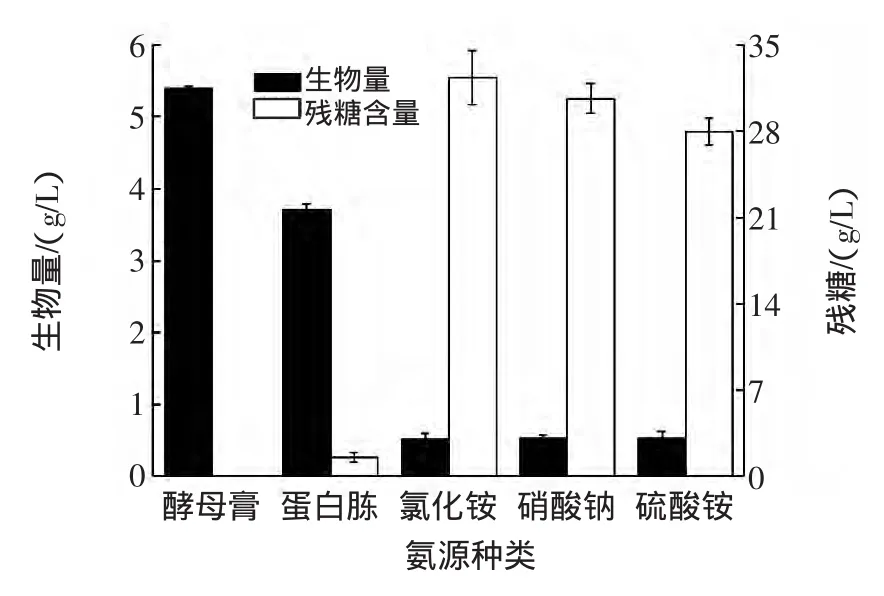
图3 氮源种类对布拉氏酵母生物量的影响Fig.3 Effect of nitrogen sources on biomass
无机氮源对布拉氏酵母生物量的影响相差不大,菌体量都很低,耗糖很少;而有机氮源组的生物量比无机氮源组高出三倍以上,葡萄糖几乎全部耗完,其中以酵母膏的效果最好,其原因在于酵母膏含丰富的蛋白质、多肽和游离氨基酸以及维生素、生长因子等[15],因此它能够使布拉氏酵母迅速繁殖,后续试验选择酵母膏为培养基氮源。
2.2.3 磷酸二氢钾浓度对酵母生长的影响
磷是蛋白质和核酸的必要成分,也是三磷酸腺苷ATP的组成成分,因此磷元素的含量对微生物的生长也有一定影响[15]。试验结果如图4,磷酸二氢钾浓度为0.8 g/L时,酵母生物量最大,之后随浓度上升生物量开始降低。
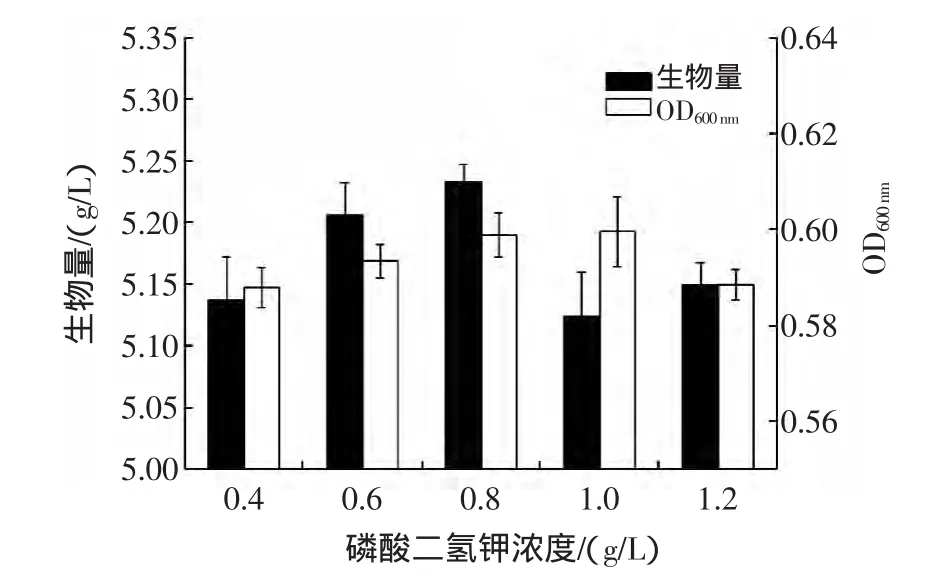
图4 磷酸二氢钾浓度对布拉氏酵母生物量的影响Fig.4 Effect of Potassium Phosphate Monobasic concentration on the biomass
2.2.4 硫酸镁浓度对酵母生长的影响
镁处于离子状态时,是许多重要酶的激活剂,也是发酵过程中不可缺少的成分[15]。硫酸镁浓度对布拉氏酵母生物量的影响如图5。
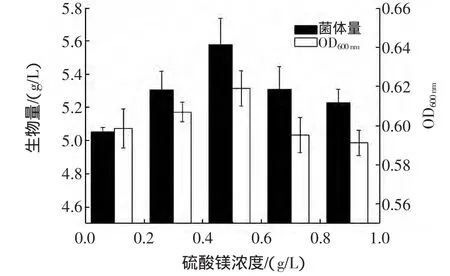
图5 硫酸镁浓度对布拉氏酵母生物量的影响Fig.5 The effect of magnesium sulfate heptahydrate concentration on the biomass
由图5所示,添加镁离子对布拉氏酵母的生长有一定的促进作用,当其浓度为0.05%时,菌体生物量最大,因此初步确定培养基中硫酸镁浓度为0.5 g/L。
2.3 正交试验结果
正交试验结果如表2。四个影响因素对布拉氏酵母生物量的影响大小顺序为A>B>D>C,即葡萄糖浓度的高低是布拉氏酵母生长最重要的调控因子[17],硫酸镁浓度影响最小。
发酵培养基的方差分析见表3,结果表明,四个影响因素中,葡萄糖和酵母膏浓度对布拉氏酵母生物量均有显著性影响。综合表2和表3确定培养基的优方案为A4B3C2D2,即布拉氏酵母培养基组成为葡萄糖45g/L,酵母膏12 g/L,磷酸二氢钾0.8 g/L和硫酸镁0.5 g/L,此时布拉氏酵母菌体干重为6.3 g/L。
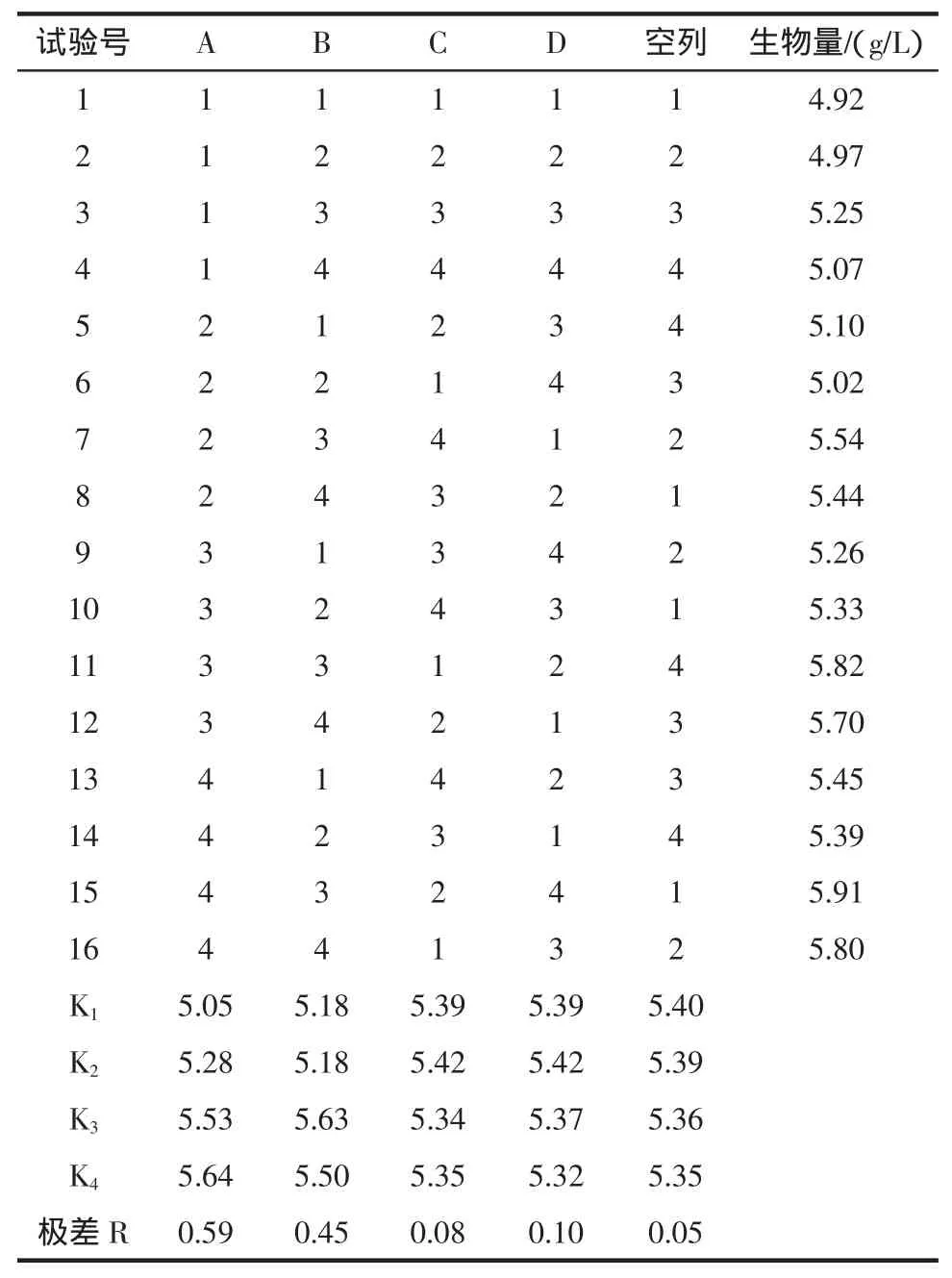
表2 L16(44)正交试验结果分析Table 2The results and analysis of the L16(44)orthogonal test
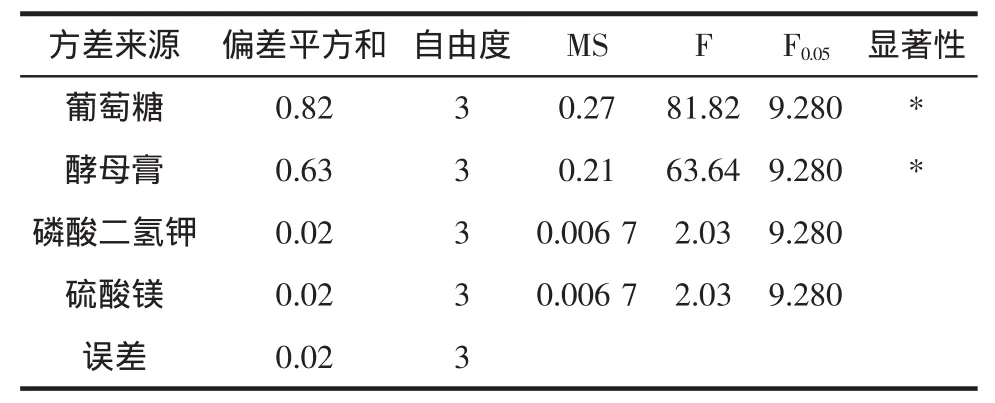
表3 发酵培养基的方差分析表Table 3 Variance analysis of fermentation media
2.4 培养条件对酵母生长的影响
2.4.1 pH对酵母生长的影响
培养基的pH会影响菌体对营养物质的吸收和代谢产物的分泌,还会影响培养基中某些营养物质的分解[15],因此pH是影响微生物生长极为重要的环境因子。图6显示,发酵培养基初始pH5.5时酵母生物量最大,pH偏高或偏低均不利于布拉氏酵母的生长。
2.4.2 接种量对酵母生长的影响

图6 培养基初始pH对菌体生长的影响Fig.6 The effect of initial pH on the biomass of S.boulardii
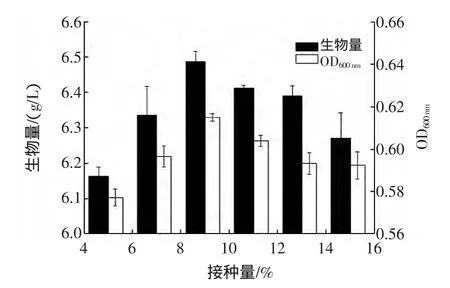
图7 接种量对菌体生长的影响Fig.7 The effect of incubation size on the biomass of S.boulardii
接种量对酵母生长的影响由图7所示,种子液接种量为9%时生物量达到最大值,增大或减小接种量其生物量均有所降低。研究表明,接种量过多,培养液黏度增加,造成溶氧不足,反而会影响菌体生长;接种量过小则会延长发酵周期,并且容易染菌[15]。因此培养过程取接种量为9%,在此条件下培养布拉氏酵母24 h后其细胞干重为6.5 g/L。
3 结论
本研究确定了摇瓶培养布拉氏酵母的培养条件为葡萄糖45 g/L,酵母膏12 g/L,磷酸二氢钾0.8 g/L,硫酸镁0.5 g/L,初始pH5.5,接种量9%。在此条件下,30℃,200 r/min振荡培养24 h后细胞干重达到6.5 g/L,对于益生菌布拉氏酵母在畜牧业、医药等领域的应用具有实际意义。
[1] Martins F S,Vieira A T,Elian S D,et al.Inhibition of tissue inflammation and bacterial translocation as one of the protective mechanisms of Saccharomyces boulardii against Salmonella infection in mice[J].Microbes and infection/Institut Pasteur,2013,15(4):270-279
[2] Fietto J L,Araujo R S,Valadao F N,et al.Molecular and physiological comparisons between Saccharomyces cerevisiae and Saccharomyces boulardii[J].Canadian journal of microbiology,2004,50(8):615-621
[3] Dorota Czerucka,Patrick Rampal.Experimental effects of Saccharomyces boulardii on diarrheal pathogens[J].Microbes and Infection/Institut Pasteur,2002,4(7):733-739
[4] H blehaut,J Massot,G W Elmer,et al.Disposition kinetics of Saccharomyces boulardii in man and rat[J].Biopharmaceutics&Drug Disposition,1989,10(4):353-364
[5] Czerucka D,Piche T,Rampal P.Yeast as probiotics-Saccharomyces boulardii[J].Aliment Phamacol&Ther,2007,26(6):767-778
[6] E lm,C Pothoulakis.Recent advances in Saccharmyces boulardii research[J].Gastroenterologie Clinique,2010,34(supplement 1):62-70
[7] Giang H H,Viet T Q,Ogle B,et al.Growth performance,digestibility,gut environment and health status in weaned piglets fed a diet supplemented with a complex of lactic acid bacteria alone or in combination with Bacillus subtilis and Saccharomyces boulardii[J].Livestock Science 2012,143(2):132-141
[8] 朱建军,徐伟祺,邱怡芳,等.布拉迪酵母菌的作用机制及其在养猪生产中的应用[J].饲料博览,2010,6(3):30-32
[9] H Oeztuerk,B Schroeder,M Beyerbach,et al.Influence of Living and Autoclaved Yeasts of Saccharomyces boulardii on In Vitro Ruminal Microbial Metabolism[J].Journal of dairy science,2005,88(7):2594-2600
[10]楚杰,张大伟,郝永任,等.布拉氏酵母菌对肠道菌群紊乱的调整作用研究[J].中国畜牧兽医,2008,35(7):87-89
[11]Du L P,Hao R X,Xiao D G,et al.Research on the Characteristics and Culture Conditions of Saccharomyces boulardii[J].Advanced Materials Research,2012,343-344(2):594-598
[12]李兴艳,张内云,尚永彪.正交试验优化酵母多糖锌配合物的制备及其对尿素的吸附性能[J].食品科学,2013,34(14):57-62
[13]周康,George Susie,Baranyi Jozsef,et al.不同浓度沙门氏菌细胞生长分布规律研究[J].食品科学,2012,33(13):254-258
[14]洒荣波.基于重组巴斯德毕赤酵母高密度培养研究[D].无锡:江南大学,2005
[15]楚杰,王凤山,张大伟.布拉酵母菌的生物学作用及防治疾病应用研究进展[J].药物生物技术,2006,13(1):71-73
[16]余龙江,鲁明波,何峰,等.发酵工程原理与技术应用[M].北京:化学工业出版社,2006:41-52
[17]李云雁,胡传荣.试验设计与数据处理[M].北京:化学工业出版社,2005:83-87
[18]方尚瑜,贾志华,张霞,等.碳氮源对液体培养蛹虫草生物合成虫草多糖的影响[J].食品科学,2013,34(13):165-169
