大蒜多糖长循环脂质体的制备及稳定性研究
2014-12-16廖振宇汪晓冬高亦军
廖振宇,汪晓冬,高亦军
(天津市产品质量监督检测技术研究院,天津300384)
大蒜(Allium sativum L)为百合科葱属植物的鳞茎,营养丰富,是日常生活中常用的香辛蔬菜和调味佳品,而且具有很强的防病治病保健功能,历来被视为药食兼用佳品[1]。近年来,国内外许多研究人员从大蒜中提取出多糖成分,并逐步发现大蒜多糖具有抗菌消炎、抗血凝、降血脂和防止动脉粥样硬化的功效,同时还有抗尿糖、保护肝功能、抗肿瘤和预防衰老等作用[2-4]。然而,大蒜多糖不能被小肠黏膜细胞吸收进入血液,而且在体内易被酸、碱或酶破坏,导致大蒜多糖生物活性失活,在体内不能起到预期的治疗效果,因此,有必要采取措施改善其在人体内的疗效[5]。
脂质体(1iposome)最早是1965年由Bangham等作为生物膜的模型提出的[6]。脂质体技术首先应用在药物载体领域。近年来,脂质体在食品工业中显示出较为广阔的应用空间,可用于生产微胶囊化的酶制剂、保护维生素在加工过程的损失、用于香精香料的包裹等[7-9]。同时,采用聚乙二醇(PEG)及其脂质衍生物修饰脂质体的研究受到广泛关注,并取得很大进展。由于经PEG修饰后的脂质体表面亲水性增加,降低了其与吞噬细胞的亲和性,因而能逃避网状内皮系统的识别而减少其对脂质体的捕获,延长体内循环时间[10]。因此,为提高大蒜多糖的生物利用率,稳定性和疗效,将其制备成长循环纳米脂质体材料。本实验以PEG2000作为修饰脂质体膜材,采用薄膜分散法制备大蒜多糖长循环脂质体,并对其在体外稳定性进行了初步研究。
1 材料与方法
1.1 材料与试剂
大蒜多糖:天津科技大学食品安全实验室馈赠;卵磷脂(大豆):上海伯奥生物科技有限公司;胆固醇、Triton X-100:天津市光复精细化工研究所;聚乙二醇(MW:2000):天津市天正化学试剂厂;标准葡萄糖溶液(质量浓度为100.0 μg/mL)和蒽酮(质量浓度为2 mg/mL):均为天津市产品质量监督检测技术研究院食品检验室自配得到。
1.2 仪器与设备
旋转蒸发仪:上海亚荣生化仪器厂;BI-90Plus激光粒度仪/Zeta电位仪:美国布鲁克-海文公司;JEOL-100CXII型透射电子显微镜:日本电子光学公司;UV-9100型紫外可见光分光光度计:北京瑞利分析仪器厂;万分之一天平BS110:北京赛多利天平有限公司;PHB-4型pH计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 大蒜多糖脂质体溶液制备
采用薄膜分散法[11]制备大蒜多糖脂质体的过程如下:精确称取适量大豆卵磷脂和胆固醇(质量比例为2∶1),加入到50 mL茄形瓶中,溶于一定量的乙醚中,然后在35℃下于旋转蒸发仪上以50 r/min的旋转速度进行旋蒸,同时向旋转蒸发仪中通入适当流速的氮气流加以保护。当茄形瓶中形成一层透明均匀的脂质膜后,继续旋蒸30 min,之后将茄形瓶取下,向茄形瓶中加入含PEG2000和大蒜多糖的磷酸盐缓冲溶液(pH=7.2)适量,将脂质膜水化,然后用超声波清洗器以60 W的功率进行超声分散,直至形成半透明乳液,通过内径0.8 μm微孔滤膜后,即得大蒜多糖脂质体。
1.3.2 大蒜多糖脂质体形态学观察
将上述脂质体混悬液用透射电子显微镜进行观察,透射电子显微镜采用磷钨酸负染法进行,用微量取样器将大蒜多糖脂质体溶液滴加到铜网上,静置过夜后透射电镜下观察其微观形貌。
1.3.3 粒径和粒度分布研究
取上述脂质体混悬液样品适当稀释进行超声分散,然后将液体样品加入专用的测试皿中,用BI-90Plus激光粒度仪/Zeta电位仪测试分析样品的粒径。
1.3.4 大蒜多糖含量分析
采用蒽酮-硫酸法测定大蒜多糖含量,原理为多糖在浓硫酸的作用下可脱水生成糖醛衍生物,后者再与蒽酮作用形成蓝色化合物,与同法处理的标准葡萄糖溶液比色定量。具体如下:分别吸取标准葡萄糖溶液 0.10、0.20、0.40、0.60、0.80、1.0 mL,置于具塞比色管中,用蒸馏水稀释至1.0 mL,摇匀。然后分别加入蒽酮试剂4.0 mL,迅速浸于冰水浴中冷却,各管加完后一起浸于沸水浴中,管口加盖,以防蒸发。自水浴沸腾起计时,准确煮沸10 min,取出,用冰浴冷却至室温,于波长620 nm测吸光度,以1.0 mL水按同样操作作为空白,以葡萄糖浓度C为横坐标,吸光度值A为纵坐标,制得葡萄糖标准曲线。
样品液的制备:分别配成浓度为10 mg/mL的大蒜多糖。
测定:吸取1 mL已稀释的大蒜多糖于试管中,加入4.0 mL蒽酮试剂,平行3份;空白管以等量蒸馏水替代大蒜多糖。以下操作同标准曲线制作。根据平均值在标准曲线上查出葡萄糖的含量(μg),由此可得到多糖的含量。
1.3.5 脂质体包封率的测定方法
取10 mL大蒜多糖脂质体在 7000 r/min离心20 min,把上层清液去掉,用磷酸盐缓冲液定容至10 mL,再以 7000 r/min离心20 min,去掉上层清液,加Triton X- 1005%乙醇溶液2 mL破乳,用上述方法测定脂质体内包裹大蒜多糖的含量。
脂质体包封率计算公式为:

1.3.6 大蒜多糖脂质体稳定性初步研究
观察大蒜多糖脂质体混悬液在不同温度、不同储存时间等条件下对其泄漏率和粒度的影响。
2 结果与分析
2.1 大蒜多糖脂质体形态学观察
在透射电镜下观察,大蒜多糖长循环脂质体分布均匀、颗粒间彼此分散较好、独立、连续呈圆形或椭圆形微球体(见图1)。
2.2 粒径和粒度分布的检测结果
大蒜多糖脂质体的平均粒径为115.4 nm,粒径分布见图2。
脂质体的粒径较小,多分散指数为0.308,说明其分布均匀。
2.3 葡萄糖标准曲线
本实验采用蒽酮-硫酸法测定大蒜多糖含量,见图3。
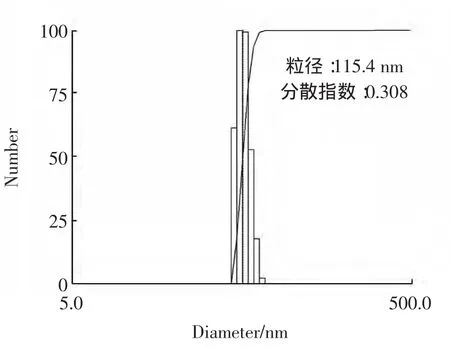
图2 大蒜多糖脂质体粒径分布图Fig.2 Particle size distribution of garlic polysaccharide liposomes
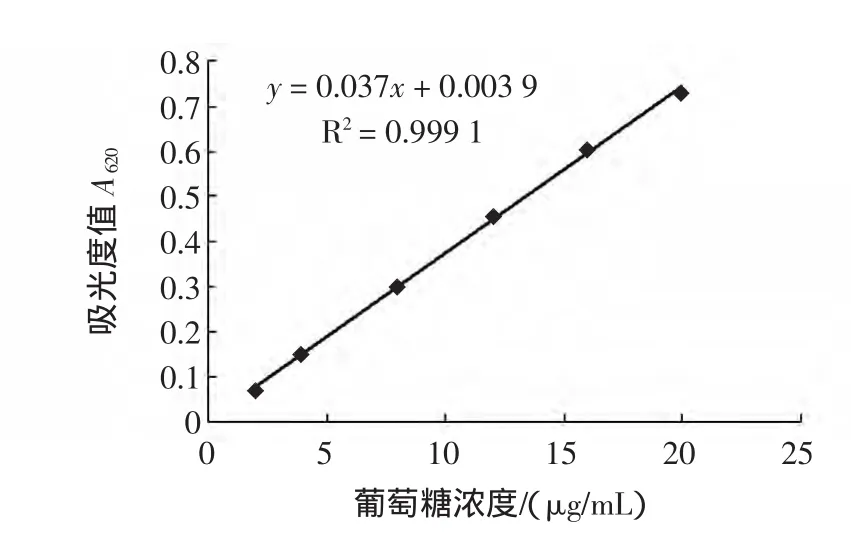
图3 葡萄糖的标准曲线Fig.3 Standard curve of glucose
葡萄糖标准曲线显示,以吸收度A620对葡萄糖浓度作回归曲线得:Y=0.037x+0. 0039,r=0. 9991,表明葡萄糖在2 μg/mL~20 μg/mL的浓度范围之间与吸光度呈良好的线性关系。
2.4 包封率的测定
本实验用Triton X- 1005%乙醇溶液破坏脂质体双层膜,测定长循环脂质体中被包封的大蒜多糖含量,计算脂质体的包封率。通过计算分析,大蒜多糖长循环脂质体的平均包封率为71.94%,普通脂质体的包封率为59.23%,说明经PEG包覆的脂质体的包封率明显高于无PEG修饰的普通大蒜多糖脂质体,这可能由于PEG具有一定的柔性,可交错重叠覆盖在脂质体的表面,形成致密的构像云,从而起到稳定脂质体的作用。
2.5 大蒜多糖长循环脂质体的稳定性考察
大蒜多糖长循环脂质体的稳定性考察指标有很多,本文选择外观、粒径、泄漏率指标来考察其稳定性,基本上能反映脂质体的稳定性变化结果见图4、图5。
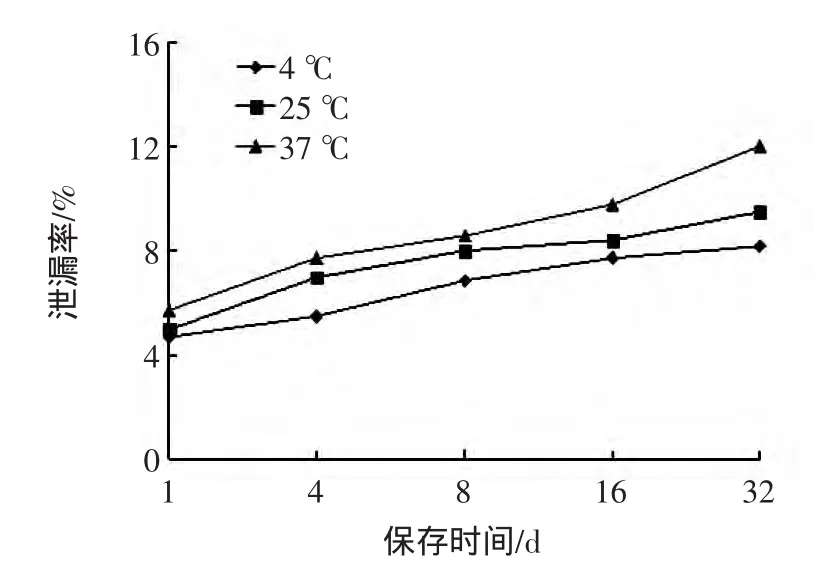
图4 保存时间和温度对大蒜多糖长循环脂质体泄漏率的影响Fig.4 Effects of storage time and temperature on the leakage rate of liposomes

图5 保存时间和温度对大蒜多糖长循环脂质体粒径的影响Fig.5 Effects of storage time and temperature on the particle size distribution of liposomes
由图4可知,脂质体的泄漏率随保存时间的延长逐渐增大;随着温度的升高,泄漏率都随之增加。从图5可知,脂质体的粒径随保存时间的延长逐渐增大;随着温度的升高,粒径也随之增加,但泄漏率和粒径在调查的时间和温度范围内没有大幅度增加,均在可接受的合理范围内,说明大蒜多糖长循环脂质体具有较好的稳定性。
3 结论
国内外有不少有关大蒜多糖的提取纯化工艺和生物活性等方面的研究报道。但很少有报道将大蒜多糖制备成脂质体以改善其生物利用率和疗效。常用制备脂质体的方法有逆相蒸发法、超声波分散法、冷冻干燥法、薄膜分散法、膜挤压法、注入法等。本实验选择薄膜分散法制备脂质体,是基于该方法操作简单、条件温和、适合于生物大分子脂质体的制备。实验发现经聚乙二醇(PEG)修饰的长循环脂质体形态圆整、分散均匀,平均粒径为115.4 nm,对大蒜多糖的包封率为71.94%,明显高于普通脂质体的包封率,说明PEG包覆脂质体有利于提高包封率,更好地控制药物释放和靶向性,延长在体内循环时间。本实验制备的纳米脂质体在设计的保存时间和温度范围下具有较好的稳定性,对脂质体的渗漏率和粒径变化的影响均在可接受的范围内。
[1] 李朝阳,刘魁,韩忠宵,等.大蒜多糖的酶法提取及其抗氧化性研究[J].食品科学,2008,29(1):117-120
[2] 杨静,王洋,孔祥智,等.辛烯基琥珀酸大蒜多糖酯的制备[J].食品研究与开发,2008,29(6):184-189
[3] 刘燕琼,黄雪松.大蒜多糖的粘度性质[J].食品研究与开发,2007,28(12):14-16
[4] 黄雪松.大蒜多糖的提取分离与分析[J].食品科学,2005,26(9):48-51
[5] 陈能煜,伍睿,陈丽,等.大蒜研究进展[J].天然产物研究与开发,2000,12(2):67-74
[6] 张灵芝.脂质体制备及其在生物医学中的应用[M].北京:北京医科大学,中国协和医科大学联合出版社,1998:57-58
[7] Makoto T,Shuntoku U,Kensaku T,et al.Evaluation of an Oral Carrier System in Rats:Bioavailability and Antioxidant Properties of Liposome-Encapsulated Curcumin[J].Journal of Agricultural and Food Chemistry,2009,57(19):9141-9146
[8] Patrícia da S M,Daniel J D,Adriano B.Food applications of liposome-encapsulated antimicrobial peptides[J].Trends in Food Science&Technology,2010,21(6):284-292
[9] Paul de V,Marijke M F,Milica S,et al.Encapsulation for preservation of functionality and targeted delivery of bioactive food components[J].International Dairy Journal,2010,20(4):292-302
[10]Seiichiro M,Kazunori I,Masawo K,et al.Application of polyethyleneglycol(PEG)-modified liposomes for oral vaccine:effect of lipid dose on systemic and mucosal immunity[J].Journal of controlled release,2003,89(2):189-197
[11]Rezler E M,Khan D R,Lauer-Fields J,et al.Targeted Drug Delivery Utilizing Protein-Like Molecular Architecture[J].Journal of the American Chemical Society,2007,129(16):4961-4972
