血清对周期性张应变作用下成骨细胞凋亡的作用及机制研究
2014-12-16王冬梅唐国华上海市口腔病防治院口腔正畸科上海0000上海交通大学机械与动力工程学院上海交通大学医学院附属第九人民医院口腔正畸科上海市口腔医学重点实验室通讯作者mailtangggraduatehkuhk
李 晅,王冬梅,沈 刚,唐国华(上海市口腔病防治院口腔正畸科,上海 0000;上海交通大学机械与动力工程学院;上海交通大学医学院附属第九人民医院口腔正畸科;上海市口腔医学重点实验室;通讯作者,E-mail:tangg@graduate.hku.hk)
细胞凋亡(apoptosis),是指有核细胞在体内外因素触发下,启动自身内部机制,通过激活内源性DNA内切酶引起细胞的自然死亡。细胞凋亡清除受损伤的或衰老无用的细胞,保持细胞死亡和增殖的平衡。成骨细胞作为骨生长改建的效应细胞,在骨改建的机制中处于“中心调控地位”。成骨细胞凋亡速度对保持骨重建的平衡有重要作用[1],研究发现在颅骨快速生长期的骨缝边缘、骨折愈合期和牵张成骨过程中均发现有成骨细胞凋亡的发生[1-3],早期出现在骨改建区域的成骨细胞中50%-70%无法分化为成熟的骨细胞参与成骨[4]。体外研究发现,去血清培养可以诱导成骨细胞凋亡,在此基础上施加周期性张应变,不同大小和持续时间的周期性张应变对成骨细胞凋亡有不同的影响[4-7]。然而目前血清对周期性张应变作用下体外培养的成骨细胞凋亡的影响的研究结果尚不明了,也缺乏相应调控机制的研究。
本研究通过不同血清培养状态下使用Flexcell 4000TM细胞应变加载系统对大鼠颅顶骨成骨细胞施加周期性张应变,研究血清对周期性张应变作用下体外培养的成骨细胞凋亡的影响,评价血清对成骨细胞凋亡的作用,并从其对细胞凋亡相关基因caspase的影响分析其中机制。
1 材料与方法
1.1 原代成骨细胞体外分离和检测
取<24 h新生SD大鼠,无菌条件下获取颅顶骨,采用次序性酶消化法分离成骨细胞,加入含10%FBS(V/V)的MEM培养基,接种于75 cm2培养瓶,次日吸去残留骨片后隔日换液,细胞90%汇合时传为P1代。取P2代细胞,培养l周后多数细胞表现为碱性磷酸酶染色阳性;经含β-甘油磷酸钠和抗坏血酸的培养基培养,2周后可形成明显的矿化结节,茜素红染色为鲜红色,证实所获成骨细胞具有体外成骨功能。本实验采用P2-P4代的成骨细胞作为研究对象。
1.2 成骨细胞培养和周期性张应变加载
采用Flexcell 4000TM细胞应变加载系统(Flexcell公司,美国)培养和加载成骨细胞。将同一代次的成骨细胞以1×105/孔接种于细胞加力板,培养4 d后,更换培养液,施加变形率为6%或12%的周期性张应变,频率为0.5 Hz,连续加载72 h。根据加力时使用培养液中血清含量分为血清组(+serum)和无血清组(-serum)。对照组采用相同培养方式,但不加力。
1.3 流式细胞仪检测成骨细胞凋亡
细胞加力后即刻收获细胞,运用AnnexinⅤ-FITC/PI(BD Pharmingen,美国)双染色法及流式细胞技术检测成骨细胞早期凋亡。将无血清对照组的凋亡率作为1,分别计算其余各组的凋亡比率。
1.4 ELISA法检测caspase-3表达
细胞加力后即刻收获细胞,用1 ml RIPA(上海博彩生物科技有限公司,中国)与100μl苯甲基磺酰氟(PMSF,sigma,美国)混合液于冰上裂解细胞。裂解后细胞蛋白液运用大鼠caspase-3 ELISA试剂盒(R&D Systems,美国)描绘标准曲线并检测,使用酶标仪(Safire2,瑞士)在450 nm处测吸光值。根据样品OD值在已描绘的标准曲线图上查出相应caspase-3含量。
1.5 real time PCR 法检测 caspase-8,9表达
细胞加力后即刻收获细胞,采用TRIZOL(Invitrogen,美国)法提取细胞总RNA,采用QuantiTect Rev.Transcription Kits试剂盒(Qiagen,德国)逆转录合成 cDNA,采用 QuantiTect SYBR Green PCR Kits(Qiagen,德国)于 ABI PRISM 7900实时定量 PCR系统(Applied Biosystems,美国)进行目的基因(caspase-8,9)real-time PCR定量分析。引物序列见表1,实验操作按试剂盒说明进行,计算各测试基因与内参基因GAPDH比值,作相对量分析。

表1 real time RT-PCR引物序列Table 1 Primer sequences used for RT-PCR
1.6 统计学分析
以上所有试验均作3次重复,应用SAS 6.0软件进行统计学分析,数据以±s表示,进行独立样本t检验。
2 结果
2.1 成骨细胞受周期性张应变作用后早期细胞凋亡分析
在含血清的培养液中,对照组成骨细胞与周期性张应变作用的成骨细胞均呈现较低水平的细胞凋亡,并且周期性张应变对成骨细胞凋亡的影响不显著。在无血清的培养液中,对照组成骨细胞就呈现一定的凋亡比率,并与血清组成骨细胞凋亡比率有显著差异(P<0.01),无血清组细胞在6%的周期性张应变作用72 h后,成骨细胞凋亡率为对照组的49%,两者有显著差异(P<0.05)。而在12%的周期性张应变作用下,成骨细胞凋亡有显著增加(P<0.01),为对照组的292%。在相同加力条件下,无血清组成骨细胞的凋亡比率较血清组有显著增加,分别为 132%(6%周期性张应变,P<0.05)和912%(12%周期性张应变,P <0.01,见图1)。
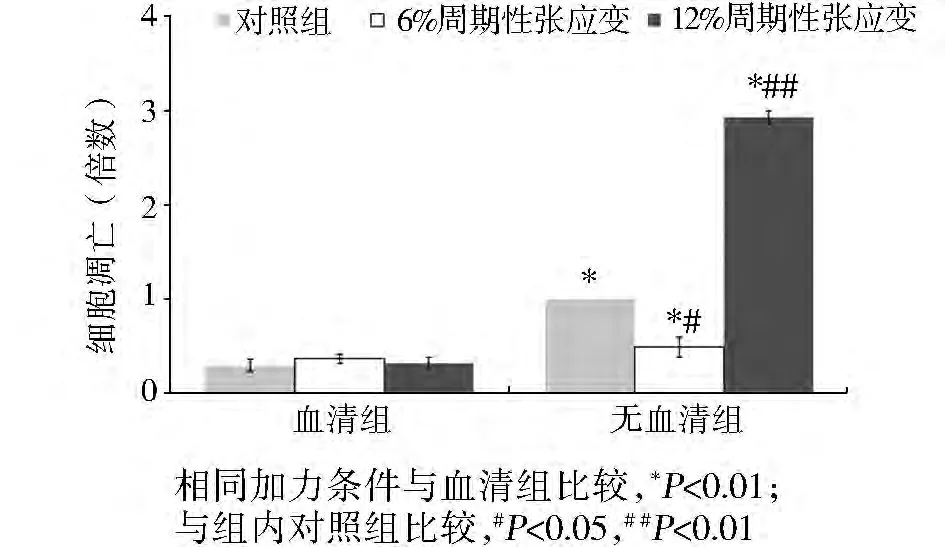
图1 周期性应变力作用下大鼠成骨细胞凋亡的定量分析Figure 1 Apoptosis of rat osteoblast after 72 h stretch loading
2.2 成骨细胞受周期性张应变作用后caspase-3的活性表达
在含血清的培养液中,对照组成骨细胞与周期性张应变作用的成骨细胞均呈现较低水平的caspase-3活性表达,并且周期性张应变对成骨细胞caspase-3表达的影响不显著。在无血清的培养液中,对照组成骨细胞就呈现一定的caspase-3活性表达,并与血清组成骨细胞凋亡比率有显著差异(P<0.01),无血清组细胞在6%的周期性张应变作用72 h后,成骨细胞 caspase-3活性表达为对照组的66%,两者有显著差异(P<0.05)。而在12%的周期性张应变作用下,成骨细胞caspase-3活性有显著增加(P<0.01),为对照组的156%。在相同加力条件下,无血清组成骨细胞较血清组的caspase-3活性有显著增加(P<0.01,见图2),分别为374%(6%周期性张应变)和777%(12%周期性张应变)。

图2 周期性应变力作用下大鼠成骨细胞caspase-3活性表达分析Figure 2 Caspase-3 activity of rat osteoblast after 72 h of stretch loading
2.3 成骨细胞受周期性张应变作用后caspase-8,9的基因表达
成骨细胞在周期性张应变作用下,血清组和无血清组细胞的caspase-8表达呈现相似趋势,6%的周期性张应变作用72 h后,成骨细胞caspase-8表达分别下调46%(血清组)和48%(无血清组),与对照组差异显著(P<0.05)。在12%的周期性张应变作用下,成骨细胞caspase-8表达显著增加(P<0.05),分别为对照组的1 006%(血清组)和768%(无血清组)。而相同加力条件下,血清组和无血清组成骨细胞caspase-8表达无显著差异(图3 A)。
血清组和无血清组成骨细胞在周期性张应变作用下,caspase-9组内表达无明显差异。而在相同加力条件下,血清组成骨细胞较无血清组的caspase-9活性有显著降低(P<0.05,图3B),分别为51%(6%应变力)和43%(12%应变力)。
3 讨论
在外界机械力刺激下,成骨细胞的反应是骨组织发生适应性改建的基础[8]。成骨细胞体外应力加载为研究成骨细胞对机械力的生物学反应提供了可能。目前发现,不同的加力方式(如加载装置,力值大小、加力时间、加力频率等)会导致研究结果大相径庭[9-12]。在相同的力学加载条件下,不同级别的机械牵张刺激—高(21%)、中(14%)和低(7%)—对成骨细胞分化水平影响有所不同[13],且无血清培养条件中成骨细胞无法承受超过15%的周期性张应变作用,而不足24 h的力学刺激对成骨细胞凋亡作用不明确,另外1 Hz以上的作用频率会增加张应变作用过程中的流体剪切效应[14]。综合以上前人研究结果并根据原代成骨细胞的生长曲线,本研究选用对数生长期的结束时间点(4 d)的细胞进行力学加载分析。使用Flexcell 4000TM细胞应变加载系统,对成骨细胞施加均匀的等轴牵张力。采用了6%和12%两个张应变参数,以0.5 Hz的频率对细胞加载72 h的周期性张应变。根据加力时细胞培养液中是否含有血清分为血清组和无血清组。

图3 周期性应变力作用下大鼠成骨细胞caspase-8(A)和caspase-9(B)的基因表达分析Figure 3 Gene expression of caspase-8(A)and 9(B)in rat osteoblasts after 72 h stretch loading
本研究结果显示,在含血清的培养液中,成骨细胞均呈现较低水平的细胞凋亡,且周期性张应变对细胞凋亡的影响不显著。在无血清的培养液中,对照组成骨细胞已呈现一定的凋亡比率,且明显高于血清组(P<0.01),应力条件下,6%的周期性张应变抑制成骨细胞的凋亡,而12%的周期性张应变则促进成骨细胞的凋亡(图1)。提示无血清状态下,周期性张应变可以调控成骨细胞凋亡的发生,其中力值大小起重要作用,这与以往研究结果一致[7,12]。而血清的存在使得周期性张应变对成骨细胞凋亡的调控作用明显减弱。而这一趋势在caspase-3的活性检测中也得到相似结果(见图2)。目前在动物细胞培养中,血清起到很重要的作用,它能够提供细胞生长必需的基本营养物质;提供激素和各种生长因子;提供结合蛋白携带重要的低分子量物质,在细胞代谢过程中起重要作用;提供促接触和伸展因子使细胞贴壁免受机械损伤;对培养中的细胞起到某些保护作用;提供酸碱缓冲物质,调节培养基pH值;影响培养系统中的某些物理特性如:剪切力、黏度、渗透压和气体传递速度等[15]。研究证实,血清的存在与否对细胞凋亡表达水平有显著影响,并且这种影响在不同种类细胞中呈现相似性[16-18]。
我们的研究结果还显示,成骨细胞在周期性张应变作用下,血清组和无血清组细胞的caspase-8表达呈现相似趋势,即6%的周期性张应变下调其表达而12%的周期性张应变促进其表达。而血清组和无血清组成骨细胞在周期性张应变作用下,caspase-9组内表达无明显差异,但是在相同加力条件下,血清组成骨细胞较无血清组的caspase-9活性显著降低(见图3),提示caspase-8表达与应力相关而Caspase9表达主要受血清影响。在caspase-家族中,与细胞凋亡相关的caspase-主要分为起始和执行 caspase-两大类[18,19],当细胞发生凋亡时,起始caspase-在外来蛋白信号的作用下被切割激活后,它对执行caspase进行切割并使之激活,被激活的执行者caspase通过对 caspase-靶蛋白的水解,形成caspase 级联反应,促发细胞凋亡[20,21]。caspase 级联反应主要涉及死亡受体途径和线粒体途径两条途径。死亡受体途径主要由肿瘤坏死因子受体超家族激活caspase-8从而激活caspase级联反应。而线粒体途径则是细胞内部线粒体内分泌的细胞色素C诱发刺激激活caspase-9从而激活caspase级联反应。而我们的研究结果提示,血清对成骨细胞凋亡比率的下调作用与caspase-级联反应有关。根据结果,caspase-8的表达与血清的存在无相关性,而caspase-9和caspase-3的表达都因血清的存在而下调,说明血清主要是通过caspase-9/3的途径对成骨细胞凋亡产生影响。而caspase-9/caspase-3的途径则主要涉及细胞内部线粒体内分泌的细胞色素C,由此可推得血清对成骨细胞凋亡的保护作用主要是通过抑制细胞内线粒体分泌细胞色素C从而下调caspase-9的表达。
综上所述,无血清状态下周期性张应变对成骨细胞的凋亡有影响,血清对周期性应变力影响的成骨细胞的凋亡有减弱作用。由此提示,成骨细胞的凋亡在应力介导的骨改建中发挥着重要作用。阐明成骨细胞凋亡的生物学机制,将有助于充分认识临床上骨重建的过程和指导骨质疏松、骨折愈合的综合治疗。通过细胞因子、基因诱导等方法调控成骨细胞的凋亡,可能成为将来治疗骨骼疾病和促进骨重建修复的一条有效途径。
[1]董玉峰,戴克戎.细胞凋亡与骨重建[J].中国矫形外科杂志,2000,7(9):894-895.
[2]Greenwald JA,Mehrara BJ,Spector JA,et al.In vivo modulation of FGF biological activity alters cranial suture fate[J].Am J Pathol,2001,158(2):441-452.
[3]Mehrara BJ,Mackool RJ,McCarthy JG,et al.Immunolocalization of basic fibroblast growth factor and fibroblast growth factor receptor-1 and receptor-2 in rat cranial sutures[J].Plast Reconstr Surg,1998,102(6):1805-1820.
[4]Jilka RL,Weinstein RS,Bellido T,et al.Osteoblast programmed cell death(apoptosis):modulation by growth factors and cytokines[J].J Bone Miner Res,1998,13(5):793-802.
[5]Liang M,Russell G,Hulley PA.Bim,Bak,and Bax regulate osteoblast survival[J].J Bone Miner Res,2008,23(5):610-620.
[6]Rippo MR,Villanova F,Tomassoni Ardori F,et al.Dexamethasone affects Fas and serum deprivation-induced cell death of human osteoblastic cells through survivin regulation[J].Int J Immunopathol Pharmacol,2010,23(4):1153-1165.
[7]Li X,Zhang XL,Shen G,et al.Effects of tensile forces on serum deprivation-induced osteoblast apoptosis:expression analysis of caspases,Bcl-2,and Bax[J].Chin Med J(Engl),2012,125(14):2568-2573.
[8]戴尅戎.力学生物学在骨与软骨研究中的应用[J].中华骨科杂志,2006,26(6):429-431.
[9]Visconti LA,Yen EH,Johnson RB.Effect of strain on bone nodule formation by rat osteogenic cells in vitro[J].Arch Oral Biol,2004,49(6):485-492.
[10]Motokawa M,Kaku M,Tohma Y,et al.Effects of cyclic tensile forces on the expression of vascular endothelial growth factor(VEGF)and macrophage-colony-stimulating factor(MCSF)in murine osteoblastic MC3T3-E1 cells[J].J Dent Res,2005,84(5):422-427.
[11]Tang L,Lin Z,Li YM.Effects of different magnitudes of mechanical strain on Osteoblasts in vitro[J].Biochem Biophys Res Commun,2006,344(1):122-128.
[12]Weyts FA,Bosmans B,Niesing R,et al.Mechanical control of human osteoblast apoptosis and proliferation in relation to differentiation[J].Calcif Tissue Int,2003,72(4):505-512.
[13]刘大为,傅民魁,李盛琳,等.机械牵张作用对UMR-106细胞骨桥蛋白mRNA和TGF-β1 mRNA表达的影响[J].中华口腔医学杂志,2000,35(1):27-31.
[14]李晅,张晓玲,沈刚,等.周期性张应变作用下成骨细胞凋亡的体外研究[J].医用生物力学,2009,24(3):223-227.
[15]司徒镇强,吴军正.细胞培养[M].西安:世界图书出版公司,2007:25-26.
[16]赵崇山,刘顺爱,王琦,等.NS5ATP9抑制血清饥饿诱导的HepG2细胞凋亡[J].中华实验和临床感染病杂志:电子版,2012,6(2):88-92.
[17]唐孝明,裴福兴,沈彬,等.雌激素对血清饥饿诱导成骨细胞凋亡的影响[J].中国康复理论与实践,2006,12(2):123-125.
[18]张凤秋,杨战国.血清浓度及饥饿时间在HeLa细胞G0/G1期同步化中的影响[J].细胞与分子免疫学杂志,2008,24(9):928-929.
[19]吕翠仙,樊廷俊,胡国斌,等.凋亡诱导因子与细胞凋亡[J].生物化学与生物物理学报,2003,35(10):881-885.
[20]Shi Y.Mechanisms of caspase activation and inhibition during apoptosis[J].Mol Cell,2002,9(3):459-470.
[21]Chowdhury I,Tharakan B,Bhat GK.Caspases-an update[J].Comp Biochem Physiol B Biochem Mol Biol,2008,151(1):10-27.
