TaqMan探针荧光定量PCR检测金黄色葡萄球菌肠毒素D
2014-12-16刘继超姜铁民张咚咚陈历俊
刘继超,姜铁民,刘 丰,岳 华,张咚咚,陈历俊
(北京三元食品股份有限公司,北京100163)
金黄色葡萄球菌是引起人类感染和食物中毒最常见的病原菌之一,其分泌的肠毒素则是引起金黄色葡萄球菌食物中毒的主要原因,根据其血清学特性,可分为 5 型(SEA、SEB、SEC、SED 和 SEE)[1-2],肠毒素D(SED)基因位于质粒上[3],是引起食物中毒事件中常见肠毒素之一,因此灵敏、快速、简便的检测肠毒素方法成为研究的热点。传统肠毒素检测方法主要有动物实验和免疫学方法,易产生假阳性,特异性不强[4-5]。随着分子生物学检测技术的进步,荧光定量PCR技术在食品、疾控等检测领域中扮演越来越重要的角色,例如刘生峰等利用TaqMan探针荧光PCR建立肠出血性大肠埃希菌O157∶H7的检测方法[6]。该技术具有灵敏度高、特异性强、能实现多重反应和实时性等优点,又可克服现有免疫学检测方法(如ELISA)不足,并且已成功应用于食品中致病菌的检测[7]。
本研究以快速筛查金黄色葡萄球菌肠毒素D为目的,建立了一种快速定量、灵敏、特异地检测金黄色葡萄球菌肠毒素D的TaqMan探针荧光定量PCR方法,对保障乳制品的安全具有重要意义。
1 材料与方法
1.1 材料与仪器
标准菌株金黄色葡萄球菌肠毒素A(ATCC-13565)、金黄色葡萄球菌肠毒素B(ATCC-14458)、金黄色葡萄球菌肠毒素C(ATCC-19095)、金黄色葡萄球菌肠毒素D(ATCC-23235)、金黄色葡萄球菌肠毒素E(ATCC-27664)、金黄色葡萄球菌肠毒素H(ATCC-51811)、单增李斯特菌(ATCC-15313)、大肠杆菌(ATCC-25922)、金黄色葡萄球菌(CGMCC-1.0128)、沙门氏菌(CGMCC-1.1552)以及表皮葡萄球菌(CGMCC-1.2429)分别购自中国药品生物制品检定所菌种保藏中心、中国微生物菌种保藏中心、中国兽医药品监察所和美国模式培养物集存库(ATCC)。
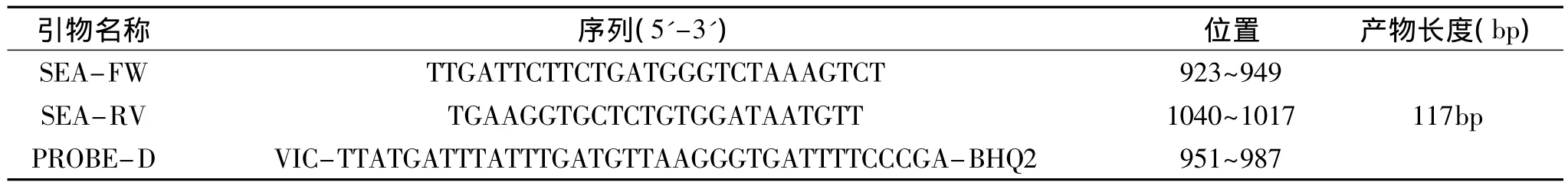
表1 金黄色葡萄球菌肠毒素D的引物与探针Table 1 Oligonucleotide primers sequences and probe of SED
荧光定量PCR扩增仪7500 美国ABI公司;荧光定量PCR反应体系中各试剂均购自宝生物工程(大连)有限公司,原料乳样品来自三元牛场。
1.2 实验方法
1.2.1 引物和探针设计 从Genebank公布的核酸序列库中筛选SEA基因保守片段,设计荧光定量PCR引物和探针,其序列如表2,由宝生物工程(大连)有限公司合成。
1.2.2 模板DNA的提取 使用培养好的菌液进行金黄色葡萄球菌肠毒素D基因组DNA的提取,提取菌体DNA方法见参考文献[8-9]。
1.2.3 反应体系与反应参数 本实验所采用的荧光定量PCR反应体系为20μL,分别为:Premix Ex Taq(Probe qPCR)10μL,上下游两个引物(10μmol)各0.4μL,探针0.8μL,ROX Reference Dye Ⅱ0.2μL,模板DNA 2μL,加水至 20μL。Applied Biosystems7500 实时荧光定量PCR仪反应参数:95℃变性30s,以95℃5s,60℃ 34s,扩增40个循环,在60℃结束开始收集荧光信号。
1.2.4 标准阳性模板的制备 以金黄色葡萄球菌肠毒素D菌株的基因组为模板,利用设计的引物扩增目的基因片段。反应体系为:模板1μL,上游引物0.5μL(25μmol/L),下游引物 0.5μL(25μmol/L),10× 扩增反应缓冲液 2μL,PCR 染料 2μL,dNTPs 0.5μL,Taq DNA 聚合酶 0.5μL,无菌超纯水 13μL,总体积为20μL,离心混匀后置PCR仪上进行自动化扩增反应,循环参数为95℃预变性3min,95℃变性30s,55℃退火 30s,72℃ 延伸 1min,共 35 个循环,最后72℃延伸10min。扩增产物1.0%琼脂糖凝胶电泳,TaKaRa琼脂糖凝胶回收试剂盒回收条带,连接到pGM19-T载体上,并导入到JM109感受态细胞中,37℃培养过夜,进行蓝白筛选,挑取阳性克隆,由宝生物工程(大连)有限公司进行测序,对测序结果进行验证[10]。采用质粒试剂盒抽提重组质粒,按一定倍数稀释后用紫外分光光度计检测260nm下的OD值,计算其拷贝数(copies/mL)。拷贝数=50(g/mL)×10-6×OD×6.02×1023/660(g)×扩增碱基数。
1.2.5 标准曲线建立及灵敏度的确定 将制备的标准模板,按10倍递增稀释,分别用本实验建立的荧光定量PCR检测体系进行检测,以模板的拷贝数为横坐标,以其对应的Ct值为纵坐标,建立标准曲线,并确定其灵敏度。
1.2.6 特异性实验分析 以大肠杆菌、沙门氏菌、表皮葡萄球菌、单增李斯特菌、金黄色葡萄球菌以及肠毒素A、B、C、E、H为对照菌,利用上述所建立的荧光定量PCR方法进行特异性验证。
1.2.7 人工污染模拟检测 将金黄色葡萄球肠毒素D菌液人工污染于乳中,使用灭菌生理盐水进行10倍梯度的稀释,根据平板计数选取3个稀释梯度,提取不同浓度乳中金黄色葡萄球菌的DNA,再将提取的DNA作为模板进行荧光定量PCR扩增,确定本检测方法应用于乳中检测的下限,对灵敏性进行评价。
2 结果与分析
2.1 重组质粒的制备
对SED引物进行普通PCR扩增目的片段进行切胶后(图1),利用TaKaRa琼脂凝胶提取试剂盒对目的片段进行回收,以回收的目的片段为模板进行克隆,进行蓝白筛选,液体培养提取质粒送宝生物工程(大连)有限公司进行测序验证,结果证明扩增片段与数据库中序列完全相符。使用紫外分光光度计测定提取的质粒稀释400倍后在260nm下的吸光值为0.2347,经计算后其拷贝数为4.0×1012copies/mL。
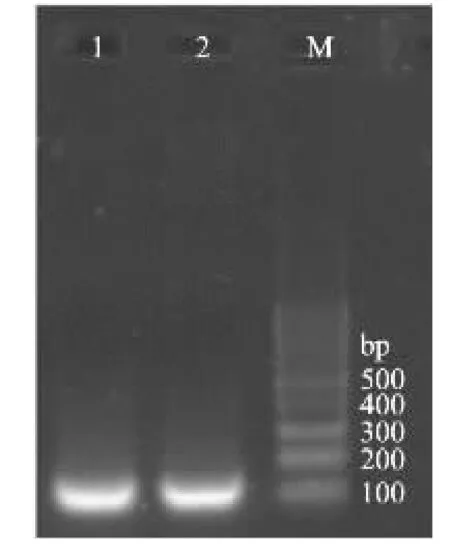
图1 PCR扩增SED的结果Fig.1 Results of PCR amplification of SED
2.2 标准曲线的建立及灵敏度的确定
将标准模板按10倍依次稀释,采用本实验所建立的荧光定量PCR扩增体系进行扩增,以各标准模板的拷贝数为横坐标,以其对应的Ct值为纵坐标,建立的标准曲线见图 2,y=-4.207x+36.429,R2=0.999,扩增效率为96.052%,得出该方法的灵敏度为40copies/mL。
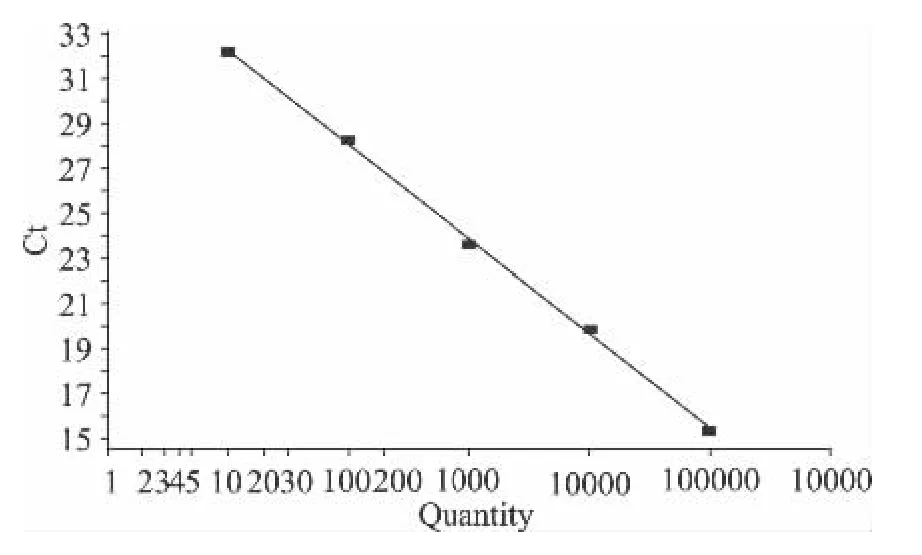
图2 SED标准曲线Fig.2 Amplification plots corresponding to standard curves
2.3 特异性分析
以不同菌株基因组模板进行荧光定量分析,结果显示只有金黄色葡萄球菌肠毒素D基因组模板有典型的荧光扩增曲线,大肠杆菌、沙门氏菌、表皮葡萄球菌、单增李斯特菌、金黄色葡萄球菌以及肠毒素A、B、C、E、H与阴性对照均无荧光扩增曲线,如图3所示,表明该法检测金黄色葡萄球菌肠毒素D具有良好的特异性。
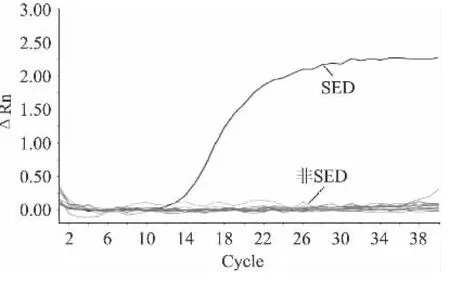
图3 特异性分析结果图Fig.3 Specificity analysis of the real-time PCR
2.4 模拟检测结果分析
使用1.2.7的方法选取稀释度为10-6和10-7的稀释梯度进行平板计数,稀释度10-6为107个菌落、稀释度10-7为10菌落。按1.2.2提取方法分别提取不同梯度浓度乳中金黄色葡萄球菌肠毒素D菌的DNA,作为模板进行荧光定量PCR扩增,结果见图4,表明1.0×103、1.0 ×102CFU/mL 均为有效扩增,所以判定本方法检测乳中金黄色葡萄球菌肠毒素D菌的灵敏度为1.0×102CFU/mL。
3 结论与讨论
本研究建立的TaqMan探针实时荧光PCR方法检测金黄色葡萄球菌肠毒素D具有特异性强、敏感性高的优点。对人工染菌的乳品样品的检测表明,该方法在检测乳品中金黄色葡萄球菌肠毒素D的污染方面具有较高的应用价值,对保障乳制品的质量安全具有重要意义,在应对细菌性食物中毒等突发公共卫生事件中具有实际应用价值。
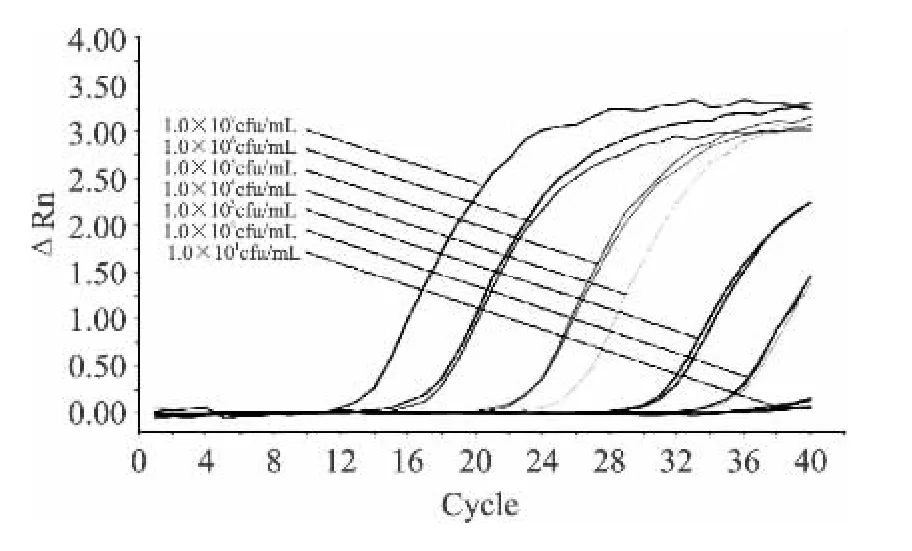
图4 TaqMan探针法检测乳中金黄色葡萄球菌肠毒素D菌的灵敏度Fig.4 TaqMan probe sensitivity tests of SED in milk samples
目前,食品中金黄色葡萄球菌的检测方法主要依靠细菌分离、培养和鉴定,该方法虽然准确,但存在耗时长、成本高及灵敏度低等问题[11]。随着分子生物学技术的发展,尤其是20世纪80年代出现的PCR方法给整个生物检测带来了新希望,以标记特异性荧光探针为特点的荧光定量PCR技术,实行完全闭管式操作,不仅能大大减少扩增产物的污染机会,提高检测的特异性,且可通过计算机自动分析对扩增产物进行精确定量提高检测的灵敏度,完全克服了普通PCR的缺点[12],而且这种方法操作简便、节省时间,适用于大样本量的筛查[13]。从本实验结果表明,TaqMan探针实时荧光PCR检测金黄色葡萄球菌肠毒素D的方法具有极强特异性,以标准模板的拷贝数为横坐标,对应的Ct值为纵坐标,建立了标准曲线 y=-4.207x+36.429,R2=0.999,扩增效率为96.052,得出该方法的灵敏度为40copies/mL,检测乳中金黄色葡萄球菌肠毒素D菌的灵敏度为1.0×102CFU/mL,表明本研究建立的金黄色葡萄球菌肠毒素D的TaqMan探针实时荧光定量PCR方法具有灵敏度高、特异性强等特点。该方法在检测乳品中金黄色葡萄球菌肠毒素D的污染方面具有较高的应用价值,对保障乳制品的质量安全方面具有重要意义。
[1]Zschock M,Kloppert B,Wolter W,et al.Pattern of enterotoxin genes seg,seh,sei and sej positive Staphylococcus aureus isolated from bovine mastitis[J].Vet Microbiol,2005,108:243-249.
[2]Dinges M M,Orwin P M,Schlievert P M.Exotoxins of Staphylococcus aureus[J].Clin Microbiol Rev,2000,13(1):16-34.
[3]Zhang S,Iandolo J J,Stewart GC.The enterotoxin D plasmid of Staphylococcus aureus encodes a second enterotoxin determinant(sej)[J].FEMS Microbiol Lett,1998,168(2):227-233.
[4]彭国,胡主花,薛琳,等.食物中毒样品中金黄色葡萄球菌及肠毒素检测[J].现代预防医学,2008,35(20):3943-3945.[5]许一平,成炜,邵彦春,等.沙门菌、大肠杆菌和金黄色葡萄球菌的多重 PCR检测[J].微生物学通报,2006,33(6):89-94.
[6]刘生峰,肖进文,刘利成,等.TaqMan探针荧光PCR检测肠出血性大肠埃希菌O157∶H7方法的建立[J].微生物学杂志,2012,32(5):6-10.
[7]向阳.食品中金黄色葡萄球菌及其肠毒素的检测方法[J].中国食品学报,2002,2(2):57-61.
[8]J S Moon,A R Lee,H M Kang,et al.Antibiogram and Coagulase Diversity in Staphylococcal Enterotoxin-Producing Staphylococcus aureus from Bovine Mastitis[J].Journal of Dairy Science,2007,90(4):1716-1724.
[9]刘继超,姜铁民,姜阿赤,等.多重PCR检测金黄色葡萄球菌六型肠毒素基因的研究[J].食品科技,2012,37(6):304-307.
[10]罗勇军,刘昕.实时荧光定量PCR标准品的制备及应用[J].重庆医学,2005,34(3):414-415.
[11]姜毓君,李一松,相丽,等.RT-PCR检测金黄色葡萄球菌肠毒素A基因[J].东北农业大学学报,2009,40(2):94-97.
[12]温冬青,赵锦荣,白玉杰,等.新型TaqMan2MGB探针法检测耐甲氧西林金黄色葡萄球菌[J].中华医院感染学杂志,2006,16(6):608-611.
[13]张红河,范建中,董晓勤,等.实时荧光聚合酶链反应检测粪便标本中的金黄色葡萄球菌肠毒素A、D[J].中国卫生检验杂志,2007,17(2):204-205,218.
