奶牛场中乳房炎相关致病菌的分离与鉴定
2021-06-06唐俊妮赵燕英朱成林
唐俊妮,屈 云,赵燕英,陈 娟,朱成林,刘 骥
(1.西南民族大学食品科学与技术学院,四川 成都 610041;2.西南民族大学青藏高原动物遗传资源保护与利用教育部重点实验室,四川 成都 610041;3.西南民族大学畜牧兽医学院;四川 成都 610041)
奶牛乳房炎是奶牛养殖业常见的疾病,其发病率高,约为40%~70%[1],且危害严重.奶牛乳房炎的高发、频发给奶牛养殖业带来了重大的经济损失,制约着奶牛养殖业的发展,我国每年由奶牛乳房炎造成的经济损失约在150-450亿人民币之间[2].奶牛乳房炎常引起奶牛乳腺管堵塞,泌乳大幅减少,甚至停止泌乳,使牛奶产量大幅度降低[3].也会对奶牛乳腺分泌细胞造成损伤,影响乳区渗透压,使血液中某些成分渗透到乳汁中,改变乳汁中蛋白质、乳糖、脂肪、矿物质等营养物质含量,造成生鲜乳品质下降,对消费者的健康也会造成影响[4-5].
导致奶牛乳房炎发生的因素很多,病原微生物感染是其主要病因,致病菌入侵机体后会引起乳腺内组织的免疫反应,引起一系列炎症发生.首先是病原微生物入侵奶牛乳房并黏附于上皮细胞,导致乳房局部感染,最终乳腺组织引发炎性反应[6].根据病原体感染方式的不同,又可分为接触性病原和环境性病原.接触性病原微生物主要有葡萄球菌属、链球菌属等;环境性病原通常是指存在于空气、粪便、污水等环境中的细菌,如肺炎克雷伯氏菌、大肠埃希氏菌等大部分革兰氏阴性菌[7];此外,部分乳房炎致病微生物虽不常见,但也会给牛群带来安全隐患,如:化脓隐秘杆菌、绿脓杆菌等[8].
葡萄球菌、链球菌、大肠埃希氏菌和支原体等引发的奶牛乳房炎占总发病率的90%以上[9-10].其中,葡萄球菌被认为是引起奶牛乳房炎的主要致病菌,根据葡萄球菌是否能够合成血浆凝固酶,又将其分为凝固酶阴性葡萄球菌(Coagulase-NegativeStaphylococci,CNS)和凝固酶阳性葡萄球菌(Coagulase-PositiveStaphylococci,CPS)[11].目前为止,已发现的葡萄球菌涵盖49个种、26个亚种[12].其中,凝固酶阳性葡萄球菌CPS多见于临床奶牛乳房炎,凝固酶阴性葡萄球菌CNS与隐性乳房炎关联性更强[13-14].Persson[15]对瑞典奶牛乳房炎病原菌调查发现,乳房炎病原菌中19%为金黄色葡萄球菌、16%为凝固酶阴性葡萄球菌、9%为停乳链球菌、8%为乳房链球菌.唐程[16]等在从江苏某奶牛场1 430份乳房炎样品中分离出1 414份致病菌,其中,凝固酶阴性葡萄球菌占比54.1%,金黄色葡萄球菌占比3.1%.可见,葡萄球菌确实是目前研究较多,也是奶牛乳房炎发生最重要的致病菌之一[17-18].葡萄球菌通常来源于患牛乳汁,可以通过挤奶员工的手臂、挤奶器之间进行交叉传播,易感染奶牛乳头或破损的上皮组织,如果在奶牛乳房中定殖,会引起乳腺组织深层次的感染及炎症,造成产奶量下降及乳腺病变[19-20].
随着消费者食品安全意识的提高,相关部门采取了一系列防控措施对金黄色葡萄球菌进行干预,奶牛乳房炎致病菌种类和数量也发生了一定的变化.越来越多的报道指出CNS与奶牛乳房炎紧密相关.如李托[21]等从89份乳房炎奶样中分离得到23株CNS,林伟东[22]等从610份奶样中分离的得到217株CNS.可见,由CNS引起的隐性乳房炎发病率处于上升趋势,成为包括我国在内的许多国家及地区引起奶牛隐形乳房炎的主要原因.由CNS引起的乳房炎具有隐蔽、持久等特点,给防治工作带来了很大的困难[20-24].CNS感染奶牛发生乳房炎后,会导致分泌乳汁中体细胞数和细菌数量明显上升,乳汁中的营养成分遭到破坏,牛乳的品质下降,患病奶牛分泌的乳汁还很容易发生酸败变质.
因此,对奶牛群潜在的致病菌进行识别与调查具有重要意义.本研究针对成都市某奶牛场引起乳腺炎相关疾病的潜在病原菌进行调查,为奶牛场病原菌的控制和牧场管理提供参考.
1 材料与方法
1.1 材料与仪器
Baird-Parker琼脂培养基、1%亚碲酸钾卵黄增菌液、胰蛋白胨大豆肉汤(TSB)培养基(青岛高科园海博生物技术有限公司);无水乙醇(成都海兴化学试剂厂);SDS(成都市科龙工试剂厂);1×TE缓冲液;胰蛋白胨、酵母粉(Oxoid Limited公司);Taq 1.1×T3 Super PCR Mix、DL2000 Marker(成都擎科梓熙生物技术有限公司);PCR引物(上海生物工程有限公司).
PTC-200PCR仪(Bio-Rad公司);5804R离心机(Eppendorf中国有限公司);BSC-1000A2生物安全柜(上海博迅实业有限公司医疗设备厂);HZQX160恒温振荡培养箱(江苏省太仓市实验设备厂);MLS-3020电热自动灭菌锅(日本SANYO公司);AK-RO-UP-500艾柯超纯水机(成都唐氏康宁科技发展有限公司);GHP-9080恒温隔水式培养箱(上海齐欣科学仪器有限公司).
1.2 实验方法
1.2.1 样品采集
2019年4月~2020年8月于成都市某规模奶牛场及生产车间采集样本共计1000份.其中,奶样460份(乳房炎奶样280份、正常奶样180份);奶牛乳头拭子155份(病牛乳头25份、正常牛乳头130份);挤奶器拭子85份;奶牛皮毛拭子130份;环境样品拭子(垫料、草料、乳头擦拭毛巾、工作人员手套等)170份.
1.2.2 葡萄球菌的初步分离及纯化
参照《GB 4789.10-2016食品安全国家标准食品微生物学检验金黄色葡萄球菌检验》[25]对采集样品进行菌株初步分离.取适量样品均质于7.5%氯化钠肉汤中,37℃培养18~24 h,培养物划线接种至BP平板培养18~24 h,从平板上挑取形态较好的单菌落于TSB培养基中增殖,并保菌用于后续鉴定.
1.2.3 分离菌株的DNA提取及16S rDNA序列测序
将纯化的菌株接种到LB培养基中,37℃震荡培养18~24 h,采用文献报道的酚-氯仿-异戊醇法提取细菌DNA[26].以细菌的通用引物16S rDNA进行PCR扩增.引物序列:16S-27-F:5’-AGAGTTTGATCCTGGCTCAG-3’,16S-1492-R:5’-GGTTACCTTGTTACGACTT-3’.
PCR反应体系:Taq 1.1×T3 Super PCR Mix 17μL;上下游引物各1μL;DNA模板1μL,共计20 μL.反应程序:98℃预变性2 min;98℃变性20 s;55℃退火10 s;72℃延伸30 s;变性-退火-延伸过程设置35个循环,72℃再延伸2 min.将16S rDNA PCR产物送至上海生工有限公司进行测序,测序结果于NCBI网站进行BLAST比对分析,确认分离菌株的种属.
1.3 数据处理
数据采用Microsoft Excel软件进行分析处理.
2 结果与分析
2.1 样品采集及分菌结果
本研究采集样品共计1 000份,其中,乳房炎奶样280份,正常奶样180份;病牛乳头拭子25份,正常牛乳头拭子130份;挤奶器拭子85份;奶牛皮毛拭子130份;环境样品拭子170份.经纯化得到疑似葡萄球菌分离菌株494株,细菌的总分离率为49.40%.其中,从乳房炎奶样分离出147株,分离率为29.76%(147/494);正常奶样分离出62株,分离率为12.55%(62/494);病牛乳头分离出17株,分离率为3.44%(17/494);正常牛乳头分离出73株,分离率为14.78%(73/494);挤奶器分离出46株,分离率为9.31%(46/494);奶牛皮毛分离出78株,分离率为15.79%(78/494);环境样品分离出71株,分离率为14.37%(71/494).分离菌株的来源及分布详见图1.
2.2 分离菌株的鉴定结果
从奶牛场样品中分离得到的494份菌株,通过采用16S rDNA基因测序,并比对分析,发现494株分离菌共包含13类细菌.其中,葡萄球菌(Staphylococcus)有318株(64.37%)、粪肠球菌(Enterococcus faecalis)有144株(29.15%)、变形杆菌(Proteus vulgaris)12株(2.43%)、大肠杆菌(Escherichia coli)6株(1.21%)、蜡状芽孢杆菌(Bacillus cereus)3株(0.61%)、谷氨酸棒杆菌(Corynebacteriumglutamicum)2株(0.40%)、海氏肠球菌(Enterococcus hirae)2株(0.40%)、乳棒状杆菌(Corynebacteriumlactis)2株(0.40%)、克雷伯氏菌(Klebsiella)1株(0.20%)、浅绿气球菌(Aerococcusviridans)1株(0.20%)、猪粪细菌(Swine manure baccterium)1株(0.20%)、尿链球菌(Aerococcusurinaeequi)1株(0.20%)、格氏乳球菌(Lactococcusgarvieae)1株(0.20%),不同分离细菌的鉴定结果和比例分布详见图2.

图1 分离菌株的来源分布图Fig.1 The source distribution of all isolated strains

图2 分离菌株种属鉴定及比例分布Fig.2 Identification and proportion distribution of isolated strains
进一步针对分离得到的318株葡萄球菌进行比对分析,共鉴定出18个种.其中,107株为阿尔莱特葡萄球菌(Staphylococcus arlettae)(33.65%),41株为腐生葡萄球菌(S.saprophyticus)(12.89%),38株为溶血葡萄球菌(S.haemolyticus)(11.95%),17株木糖葡萄球菌(S.xylosus)(5.35%),17株鸡葡萄球菌(S.gallinarum)(5.35%),16株金黄色葡萄球菌(S.aureus)(5.03%),16株松鼠葡萄球菌(S.sciuri)(5.03%),16株产色葡萄球菌(S.chromogenes)(5.03%),9株科氏葡萄球菌(S.cohnii)(2.83%),7株阿格尼丝氏葡萄球菌(S.agnetis)(2.20%),7株巴氏葡萄球菌(S.pasteuri)(2.20%),5株表皮葡萄球菌(S.epidermidis)(1.57%),5株沃氏葡萄球菌(S.warneri)(1.57%),5株土壤葡萄球菌(S.edaphicus)(1.57%),4株人葡萄球菌(S.hominis)(1.26%),4株模仿葡萄球菌(S.simulans)(1.26%),3株玫瑰色葡萄球菌(S.rostri)(0.94%),以及1株猪葡萄球菌(S.hyicus)(0.31%),详见图3.

图3 葡萄球菌分类及分布比例Fig.3 Staphylococcus classification and proportion
2.3 不同样品来源中菌株的分离情况
通过分析,从乳房炎奶样品中(280份)一共筛选鉴定出的22种细菌,共147株,检出最多为粪肠球菌(24/147),其次为阿尔莱特葡萄球菌(17/147)、腐生葡萄球菌(17/147)、溶血葡萄球菌(16/147),金黄色葡萄球菌(14/147),余下17类分别检出1-10株不等;从病牛乳头拭子(25份)中共筛选出8种细菌,共17株,主要分离菌为阿尔莱特葡萄球菌和腐生葡萄球菌(4/17);从正常牛乳头拭子(130份)中筛选出12种细菌,共73株,主要包括阿尔莱特葡萄球菌(35/73)、粪肠球菌(12/73)和腐生葡萄球菌(10/73);从正常奶样(180份)中筛选出13种细菌,共62株,检出最多为粪肠球菌(23/62),其次为鸡葡萄球菌(8/62);从奶牛皮毛拭子(130份)样品筛选出17种细菌,共78株,其中粪肠球菌分离最多(27/78),阿尔莱特葡萄球菌(18/78)在该类样品中也有较多的检出;从挤奶器样品(85份)中筛选出11种细菌,共46株,主要优势菌为粪肠球菌(17/46)和阿尔莱特葡萄球菌(11/46),并且有2株金黄色葡萄球菌;从环境样品(170份)中筛选出10种细菌,共71株,主要优势菌为粪肠球菌(40/71)和阿尔莱特葡萄球菌(15/71).具体各不同来源样品中分离的细菌种类和数量详见表1.只在乳房炎奶样检出14株金黄色葡萄球菌,以及挤奶器样本中检出2株金黄色葡萄球菌,其他样本中未检出金黄色葡萄球菌,推测金黄色葡萄球菌可能是引起奶牛乳腺炎主要原因.
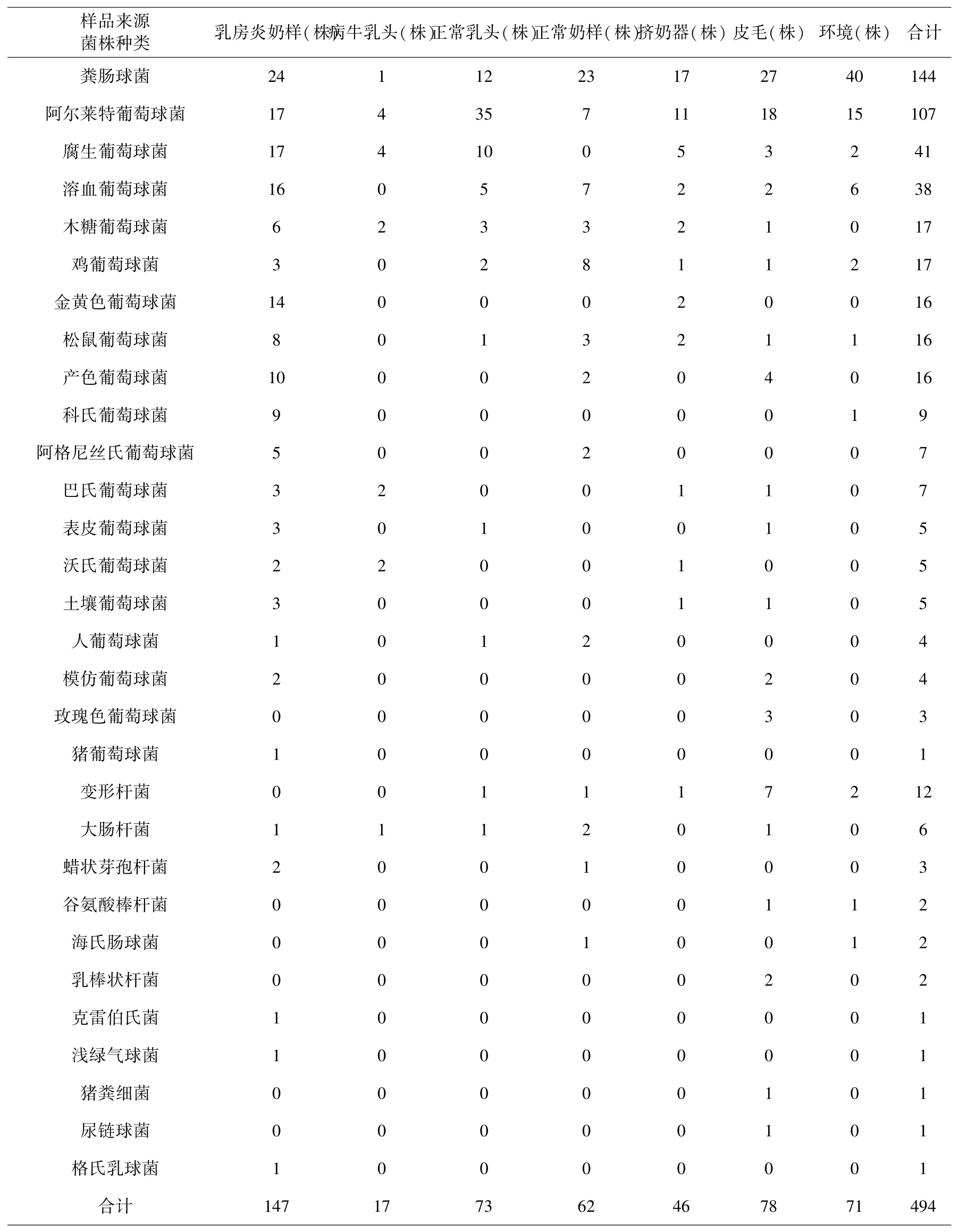
表1 不同样品中分离鉴定的细菌种类和数量Table 1 Types andnumbers of isolated strains in different samples
针对不同采样来源,细菌的具体检出率详见图4,乳房炎奶样的检出率52.50%(147/280);正常奶样的检出率为34.44%(62/180);病牛乳头的检出率为68.00%(17/25);正常牛乳头的检出率为56.15%(73/130);挤奶器的检出率为54.12%(46/85);奶牛皮毛的检出率为60%(78/130);环境样本的检出率为41.76%(71/170)

图4 各采样来源细菌的检出率Fig.4 The bacteria detection rate of each sampling source
3 讨论
奶牛乳房炎对奶牛业的发展影响极大,造成产奶量下降、奶品质降低、病牛淘汰等[27].本研究从奶牛场乳房炎奶样等不同环节相关样本中一共分离了494株菌,64.37%鉴定为葡萄球菌,阿尔莱特葡萄球菌、腐生葡萄球菌和溶血葡萄球菌为成都市奶牛场的主要优势葡萄球菌.其中,阿尔莱特葡萄球菌在7类样品中均有较高的检出率,说明其污染范围广;腐生葡萄球菌主要来源于乳房炎奶样和正常乳头拭子,正常奶样中未有检出;溶血葡萄球菌主要来源为乳房炎奶样和正常奶样,在乳房炎奶样中检出率为5.71%,正常奶样中检出率为3.89%,两类样本检出率差异不大.Bernier等[28]对奶山羊乳房感染凝固酶阴性葡萄球菌CNS进行调查也发现阿尔莱特葡萄球菌、模仿葡萄球菌及表皮葡萄球菌为优势菌株.蒋梦娜[29]等对重庆市18个奶牛养殖厂流行葡萄球菌进行调查,共发现20种葡萄球菌,引起重庆地区奶牛乳房炎的葡萄球菌流行优势菌为表皮葡萄球菌、溶血葡萄球菌及阿尔莱特葡萄球菌.郝俊玺等[30]针对高寒地区奶牛乳房炎凝固酶阴性致病葡萄球菌分离时,发现溶血葡萄球菌和琥珀葡萄球菌为呼伦贝尔地区的优势CNS.这些研究结果与本研究结论有一定的类似性,也有一定的差别,推测可能是各个地区奶牛饲养环境和气候不同所造成的.
本研究中,从280份乳房炎奶样共筛选出147株细菌,其中,金黄色葡萄球菌存在乳房炎奶样中,一共检出14株,另外,在挤奶器样本中检出了2株,而其他样本均未检出,这也说明了金黄色葡萄球菌与临床奶牛乳房炎的关系最为密切.文献也表明金黄色葡萄球菌是引起奶牛乳房炎最重要的致病菌,其感染率可达50%以上.金黄色葡萄球菌侵入奶牛乳腺组织后,定殖和黏附于乳腺上皮细胞,损害乳腺上皮细胞和腺泡功能,从而出现乳腺脓肿、硬化或瘘管,严重者会出现乳腺的坏死和脱落,一旦感染很难治愈[31].这一点也得到其他学者的普遍认可[32-34].
目前关于凝固酶阴性葡萄球菌中哪些类别更容易引起奶牛乳房炎还未有定论.本研究中,阿尔莱特葡萄球菌除在乳房炎奶样检出外,余下的6类样品中检出率均较高,推测其分布范围虽广,但致病力可能不强.相比而言,科氏葡萄球菌及猪葡萄球菌在本研究中虽然检出率不高,但都来源于乳房炎奶样中.很少有学者研究奶牛乳房炎与科氏葡萄球菌和猪葡萄球菌之间的关系,关于科氏葡萄球菌的报道也多与临床[35-36],或是貂源[37],猪源有关[38],猪葡萄球菌的相关报道也多为猪源[39-40].这方面在未来还需做更深入的探讨.
本研究还检出了大量的粪肠球菌,主要来源于正常奶样、乳头拭子及挤奶器.通常认为粪肠球菌对动物或人无害,是人或动物肠道的正常优势菌群[41].它可以分泌多种生物活性物质如甲酸、乙酸、乳酸、过氧化氢以及细菌素等使环境微酸化,从而抑制其他微生物的生长和繁殖[42-43].事实上,粪肠球菌具有“益生性”与“致病性”双面性,人们往往因其具有“益生性”而忽视其“致病性”.王晓禹[44]等对牛源粪肠球菌进行筛查发现其携带多种致病基因,并将携带致病基因的粪肠球菌注入小鼠,可在72 h内致小鼠死亡.另外,牛乳源粪肠球菌在市售牛乳中的分离率也极高,往往也携带多种毒力基因,对消费者造成潜在健康威胁[45-46].在以往的报道中,粪肠球菌、肠杆菌以及凝固酶阴性葡萄球菌等主要来源于垫料、粪便等环境样品[47-48].本研究中除了上述来源外,在挤奶车间擦拭清洗乳头的毛巾、水、奶牛乳头、皮毛等样品中也检出了大量的凝固酶阴性葡萄球菌和粪肠细菌.因此,奶牛场应予以重视环境卫生消毒,加强防范,尽量避免在挤奶过程中引起病原菌的交叉感染.
综上,本研究从奶牛场分离得到494株细菌,其中,葡萄球菌和粪肠球菌为奶牛场主要流行优势菌.在葡萄球菌中,阿尔莱特葡萄球菌、腐生葡萄球菌和溶血葡萄球菌为优势葡萄球菌.金黄色葡萄球菌只在乳房炎奶样和挤奶器样本中检出,推测其是引起奶牛乳腺炎的主要原因,应进一步加强对奶牛场生产环节相关致病菌的监测与防控,预防奶牛乳房炎的发生.
