蚕蛹蛋白肠内营养制剂干预2型糖尿病小鼠代谢特性的研究
2014-12-16赵清波吴文惠朱长林陈佳捷张朝燕
赵清波,吴文惠,周 喻,朱长林,陈佳捷,张朝燕,包 斌,*
(1.上海海洋大学食品学院,上海201306;2.上海市第六人民医院,上海201306;3.上海海洋大学海洋药物与健康食品研究中心,上海201306)
蚕蛹(Silkworm pupa)为蚕蛾科昆虫家蚕蛾(Bombyx moil L.)的蛹,其资源丰富,蛋白营养全面均衡,干蚕蛹中含55%~60% 的粗蛋白[1]。蚕蛹蛋白(silkworm pupae protein,SPP)是一种较为理想的优质纯天然全价蛋白质,含有18种氨基酸,占蚕蛹总氨基酸质量分数的35%,其中8种人体必需氨基酸含量高达42.20%,必需氨基酸与非必需氨基酸质量比优于WHO/FAO提出的氨基酸参考模式[2-3],除此以外还富含核黄素、尼克酸、锌、铁、铜等营养素[4]。SPP是一种很好的药用原料,现代医学证明,SPP具有提高免疫力[5]、抗肿瘤[6]、抗疲劳[7]、降血压[8]、降血糖[2]和降血脂[9]等功效,已上市的 SPP 类药品有20多种,如血脂康、地奥血脂康等,其中瑞福康胶囊是中国第一个利用家蚕生产的基因工程口服蛋白质药物[10]。SPP经酶水解、精制后所得到的蚕蛹肽能够参与人体心脑血管系统的代谢,可有效清除血液中多余的胆固醇及脂类物质,达到软化血管、降低血压的作用[11]。蚕蛹肽还可应用于食品工业,作为食品添加剂改善观感,调节口味,如用于氨基酸饮料中[12],并作为食品营养强化剂在营养强化食品中使用[13]。作为宝贵的药膳同源性昆虫蛋白资源,近年来,国内外在SPP利用方面的研究也取得了突破性的进展[2]。鉴于SPP具有降血压,降血糖、降低胆固醇等功效和免疫调节作用,其在特殊医学用途食品的开发领域中也备受人们重视,为此,本实验根据糖尿病人肠内营养(enteral nutrition,EN)制剂的配制要求和质量指标,将蚕蛹蛋白和蚕蛹短肽(silkworm pupae peptide,SPP)作为EN制剂的蛋白质来源,配制成糖尿病人专用的EN制剂,用于观察该制剂干预2型糖尿病(Type 2 Diabetes mellitus,T2DM)小鼠代谢特性的影响。
1 材料与方法
1.1 材料与仪器
SPF级雄性昆明小鼠 购自上海斯莱克实验动物有限公司(Slac laboratory animal),体重在8~11g。动物合格证号:SCXK(沪)2012-0002。
高脂饲料 于上海斯莱克实验动物有限公司定制,配方:猪油10%,蛋黄粉10%,胆固醇1%,猪胆盐 0.2% ,普通饲料 78.8%[14]。
链脲佐菌素(STZ) 购于美国 Sigma公司,-20℃保存,用 0.1mol/L,pH4.2~4.5 的柠檬酸-柠檬酸钠缓冲液于冰中避光配制成2%的STZ溶液,0.2μm微孔滤膜过滤灭菌,现配现用。
蚕蛹蛋白质粉剂 由江苏省南通福尔生物制品有限公司提供,生产批号:20130322。分为短肽1型、短肽2型和整蛋白型三种,其中短肽1型、2型样品是根据邱英华等[15]双酶法水解蚕蛹蛋白的方法,由脱脂蚕蛹粉末通过双酶法(碱性蛋白酶和中性蛋白酶)水解得到蚕蛹短肽样品,分子量为701.50u,整蛋白型样品根据朱新鹏等[16]介绍的碱法提取蚕蛹蛋白的工艺制得白色无味蛋白质粉末,分子量为19586.03u,三种样品的氨基酸组成分析见表 1[17]。
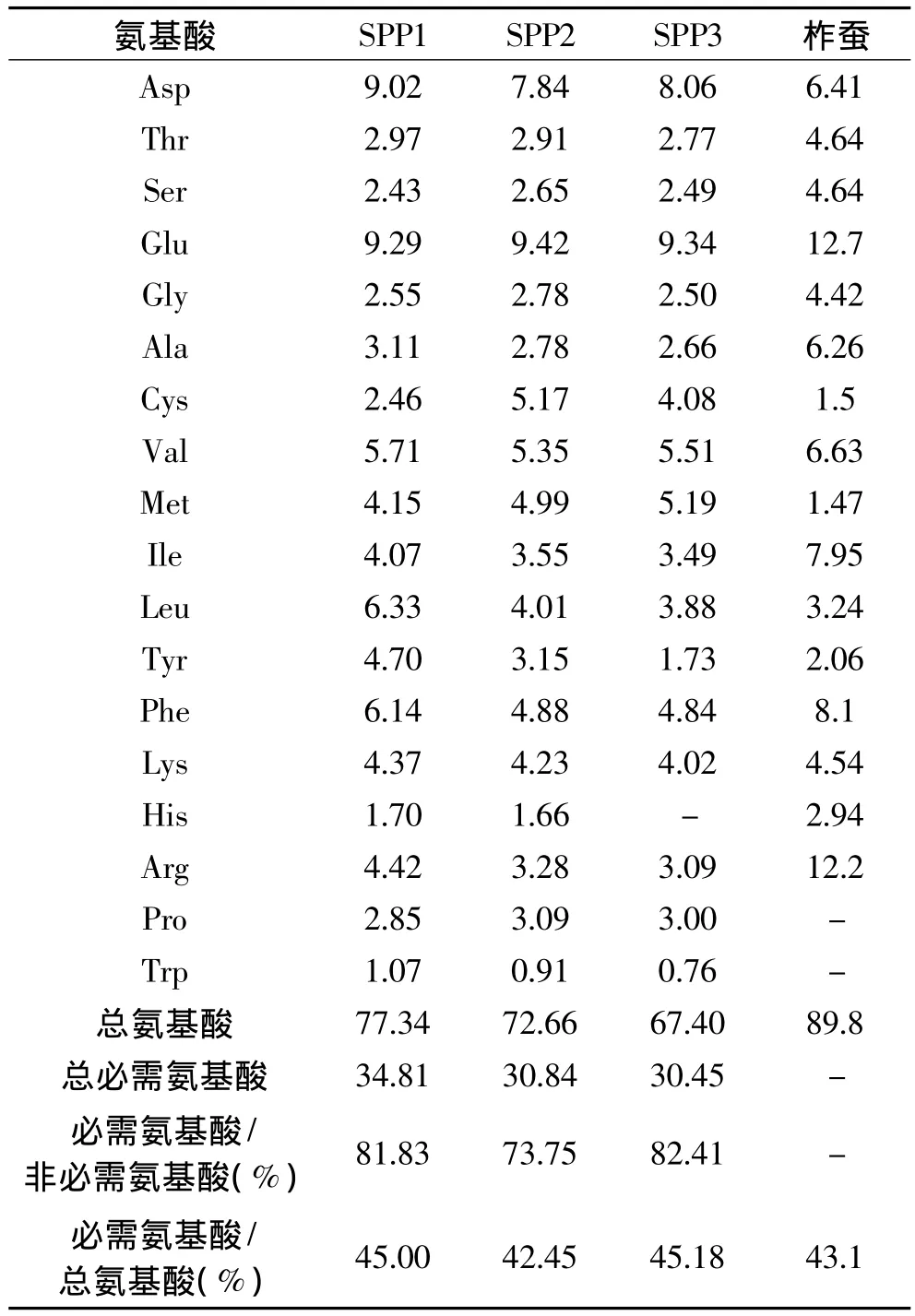
表1 蚕蛹蛋白和蚕蛹短肽样品的氨基酸组成(g/100g)Table 1 Amino acid composition(g/100g)of three silkworm pupae protein and peptide samples(g/100g)
以SPP粉为蛋白源的自制EN制剂,每100g所含热量为1968.42kJ,其中蛋白质供能比为20%、脂肪供能比为32.6%、碳水化合物供能比为45.7%,含膳食纤维9g(表2)。
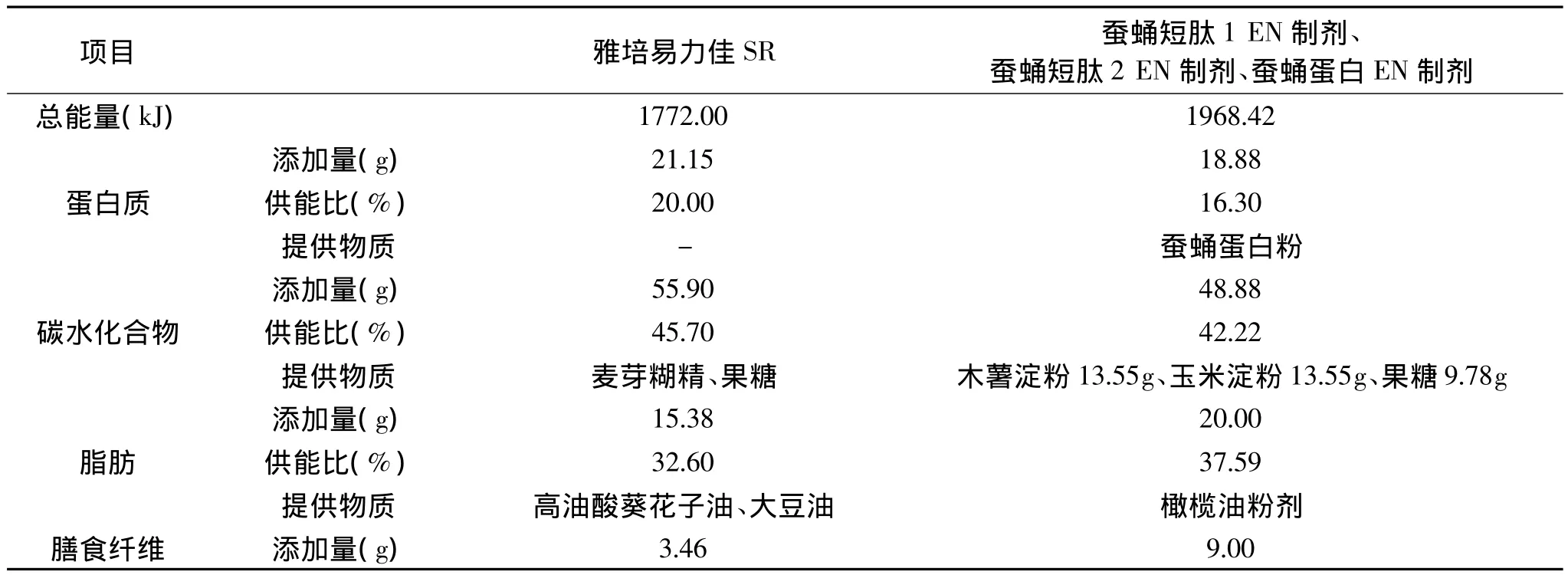
表2 雅培益力佳SR与自制肠内营养粉剂主要营养成分比较(100g)Table 2 The comparison of main ingredient between Abbott Glucerna SR and SPP Enteral Formula(100g)
雅培益力佳SR营养配方粉 由雅培贸易(上海)有限公司生产,批号:6932904708741。每100g粉剂含424kcal(1772kJ)能量,其中蛋白质供能比为16.30%、脂肪供能比为37.59%、碳水化合物供能比为 42.22% 、含膳食纤维 3.46g。
京都GT-1640快速血糖测定仪 日本ARKRAY Factory,inc生产企业;京都GT-1640血糖试纸 日本国德岛县美马市胁町大字猪尻字西上野110,生产批号:3H5A4S;压片机 由Rimek公司提供,型号:Mini PRESS-ⅡSF;AU5800全自动生化分析仪 贝克曼库尔特;水冲式笼具型号:M-5型(去底) 购自南京便诊生物有限公司;其余设备均为实验室常用仪器。
1.2 实验方法
1.2.1 蚕蛹蛋白源肠内营养片剂的制备 将自制(分别以短肽1、短肽2和整蛋白型为蛋白源)肠内营养粉剂与市售雅培益力佳粉剂采用压片机压成中心厚度为5~7mm、质量约1g左右的片剂。
1.2.2 糖尿病小鼠模型建立 小鼠适应性饲养一周后,随机选出10只作为对照组,普通饲料喂养,其余小鼠改用高脂饲料喂养,所有小鼠继续喂养3周。第3周末禁食12h(晚9:00开始禁食,自由饮水)过夜左下腹腔注射STZ 40mg/kg BW,正常组注射等体积的0.1mol/L柠檬酸-柠檬酸钠缓冲液,各组小鼠同等条件每天注射一次,连续注射3d。第4周末小鼠再次禁食12h(只禁食不禁水),尾静脉取血用快速血糖仪测定空腹血糖值。
1.2.3 实验小鼠分组及肠内营养支持 记录小鼠摄食量、饮水量,挑选具有多饮、多食、体质量下降、血糖值≥11.1mmol/L 的小鼠确定为实验小鼠[18-20],共50只,随机分为5组,每组10只,分别为A组:空白组;B组:益力佳组,投与以雅培益力佳为蛋白源的EN片剂,每只/片/d;C组:短肽1组,投与蚕蛹短肽1蛋白源EN片剂,每只/片/d;D组:短肽2组,投与蚕蛹短肽2蛋白源EN片剂,每只/片/d及E组:蚕蛹蛋白组,投与以蚕蛹蛋白为蛋白源的EN片剂,每只/片/d,将包括F组(对照组)在内的所有小鼠均移至水冲式笼具喂养,小鼠均饮用足量去离子水,保持其环境干燥、清洁。
各组小鼠采用普通饲料继续喂养4周,B、C、D、E四组每天早上9:00点投与对应EN片剂一次,其余时间自由饮水、摄食。
1.2.4 小鼠体重及空腹血糖值(FBG)测定 小鼠连续喂养28d,在给予EN片剂前(0d),给片剂后7、14、21d和28d将对照组(F组)和糖尿病小鼠组(ABCDE)禁食过夜,只禁食不禁水。于次日早上9:00尾静脉取血用快速血糖仪测定各组小鼠空腹血糖值(Fasting Blood Glucose,FBG),并于禁食前一天称量记录小鼠体质量。
1.2.5 口服葡萄糖耐量(OGTT)实验 糖尿病小鼠在EN片剂支持21d后,将A-F组小鼠禁食过夜,于第二天早上9:00投与EN片剂(空白组给予普通饲料),60min后再灌胃给予50mmol/kg葡萄糖,用快速血糖测定仪测定小鼠灌胃前(0min)、灌胃后30、60和120min的血糖值,并计算葡萄糖耐量曲线下面积(Area Under Curve,AUC)(AUC=1/4(0min 血糖值)+1/2(30min血糖值)+3/4(60min血糖值)+1/2(120min血糖值))。
1.2.6 血清生化指标的测定 小鼠在EN片剂支持28d后,将各组小鼠禁食(自由饮水)过夜,于次日早上10:00用乙醚迷晕小鼠后背部大动脉取血,加入3.8%柠檬酸钠溶液抗凝,3000r/min离心5min,取上清液送至上海市第六人民医院(东院)用于血清生化指标的测定,使用贝克曼库尔特AU5800全自动生化分析仪检测包括血清总胆固醇(Total Cholesterol,TC)、甘油三酯(Triglyceride,TG)、高密度脂蛋白(High Density Lipoprotein Cholesterol,HDL)及低密度脂蛋白(Low Density Lipoprotein Cholesterol,LDL)含量,并计算HDL/TC值。
1.2.7 统计学处理 采用SPSS软件(19.0版)对数据进行处理,所有计量资料采用均数±标准差(±s)表示,利用LSD法检验每组间的显著性差异,p<0.05为差异具有统计学意义。
2 结果与分析
2.1 蚕蛹蛋白肠内营养制剂对糖尿病小鼠生活状态的影响
对照组小鼠毛色光亮,活动频繁,饮水摄食量正常;糖尿病小鼠毛发枯黄、光泽度下降,精神萎靡,出现多饮、多尿和体重下降,尿液粘度大,粪便呈稀溏状,下腹部侵湿;食用SPP肠内营养片剂支持的 DM小鼠较食用益力佳EN片剂的DM小鼠毛色光泽度高,小鼠活动更为频繁,垫料相对更为干燥。
2.2 蚕蛹蛋白肠内营养制剂对糖尿病小鼠空腹血糖(FBG)的影响
与对照组相比,空白组小鼠FBG水平显著升高(p<0.01),且均高于 11.1mmol/L,说明 STZ 和高脂饲料诱导的小鼠T2DM造模成功。EN制剂支持前后DM小鼠FBG值变化见图1。
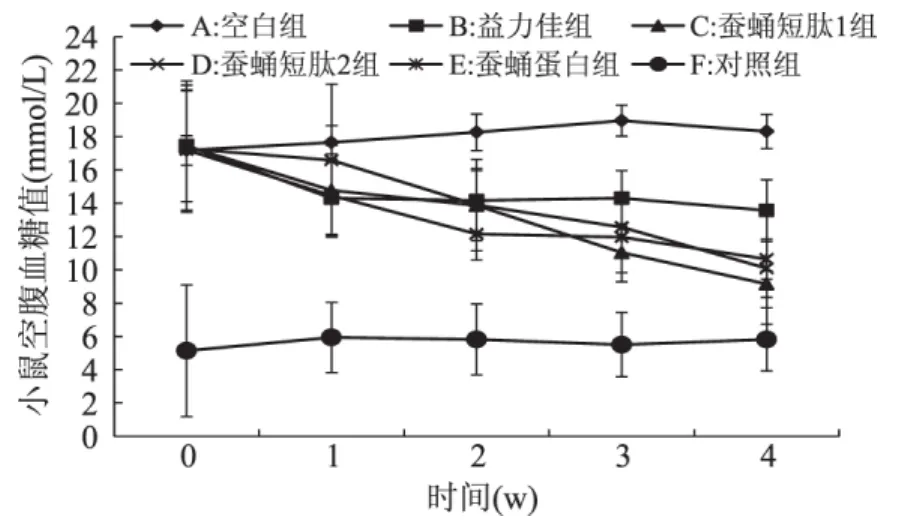
图1 肠内营养制剂支持前后糖尿病小鼠空腹血糖值(FBG)变化Fig.1 Effect of silkworm pupa protein Enteral Formula support on T2DM mice FBG index
空白组小鼠在最初的21d内FBG值仍持续缓慢升高,而实验组小鼠在对应EN片剂支持后FBG值开始下降,短肽1组小鼠在EN支持一周后FBG值明显下降(p<0.05),两周后下降达极其显著水平(p<0.01),在第四周小鼠血糖下降至9mmol/L,但各组数据组内差异较大。益力佳组小鼠血糖在最初一周也有小幅下降,但不显著且一周后血糖值基本稳定在14mmol/L而无下降趋势。其中,C、D、E 组 FBG 水 平 分 别 降 低 了 47.47%、38.14% 和41.52%,而 B 组仅下降了 22.38%,这表明以 SPP为蛋白源的EN制剂对DM小鼠降血糖功效较市售雅培益力佳更有效,且以短肽1型蛋白源EN制剂效果最为明显。
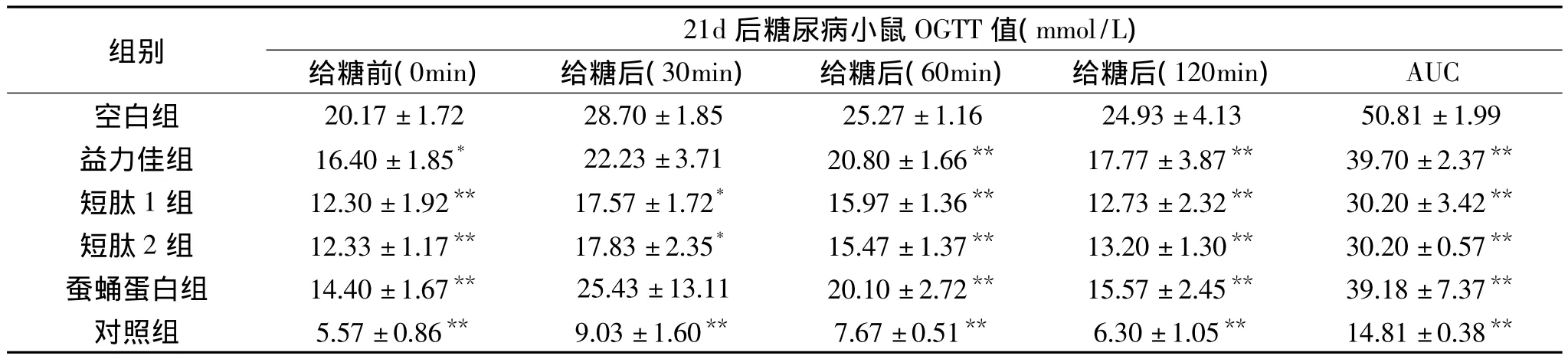
表3 EN支持前后糖尿病小鼠口服葡萄糖耐量(OGTT)变化Table 3 Effect of SPP Enteral Formula support on mice OGTT index
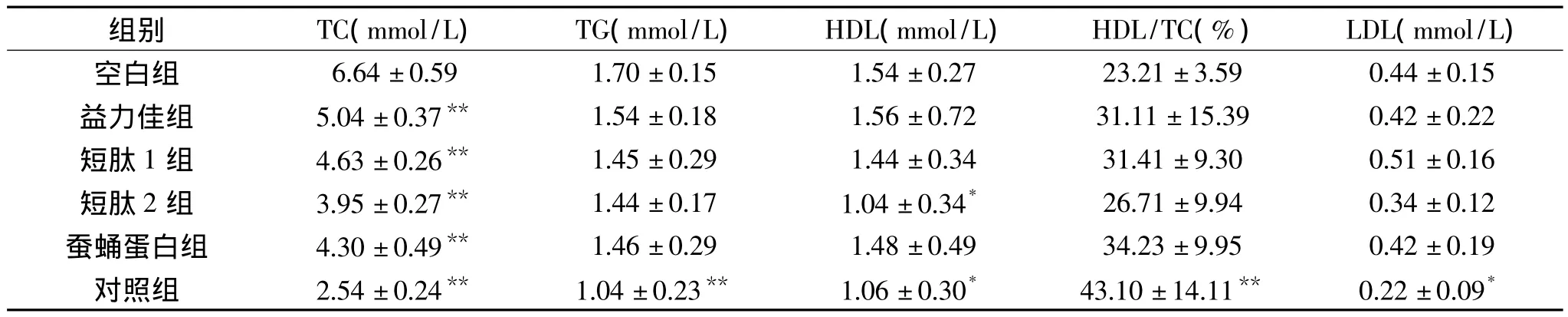
表4 蚕蛹蛋白肠内营养制剂对糖尿病小鼠血清指标的影响Table 4 Effect of SPP Enteral Formula support on T2DM mice Serum biochemical parameters
2.3 蚕蛹蛋白肠内营养制剂对糖尿病小鼠口服葡萄糖耐量(OGTT)的影响
在EN片剂支持21d后,各组小鼠口服葡萄糖耐量实验结果显示(表3),对照组小鼠在灌胃给予50mmol/kg葡萄糖溶液后,其OGTT值在最初30min内暂时上升至约9.0mmol/L,30min后血糖值开始下降,直至2h后血糖基本恢复至灌胃前水平。
与对照组相比,空白组小鼠在灌胃葡萄糖后30min的血糖值大幅升高,且在后续时间内恢复较慢,在120min时血糖仍远远高于灌胃前血糖值,食用短肽型EN片剂的小鼠较空白组小鼠血糖升高平缓,在灌胃30min后FBG值下降显著(p<0.05),灌胃2h后血糖值基本恢复至灌胃前血糖值。益力佳组小鼠血糖值在较高水平上也有所下降,但灌胃30min后未出现显著性,1h后血糖值下降显著。
2.4 蚕蛹蛋白肠内营养制剂对糖尿病小鼠脂代谢的影响
蚕蛹蛋白EN制剂对DM小鼠脂代谢的影响见表4。
以SPP为蛋白源的实验组在EN制剂支持4周后,TC值显著降低(p<0.01),TG 与 LDL较空白组也有所降低,但无显著性差异,其中短肽2组表现尤为明显,该组数据在各指标中均最小,而益力佳组小鼠各指标较空白组除TC外变化均不明显。HDL在短肽2组中有所下降(表4),但相对TC的下降幅度要小。
3 结论与讨论
糖尿病是严重危害人类健康的重大疾病,是遗传因素与环境因素长期共同作用而导致的一种慢性、全身性、内分泌代谢性疾病[21]。当今世界已有DM患者2.46亿,中国占有1亿患者,居世界之首,患者中以T2DM占主导[22]。胰岛素抵抗是T2DM发病的重要始因,本实验结合国内外小鼠T2DM造模方法[23,18],选用高脂饲料模拟肥胖 T2DM 患者发病初期的胰岛素抵抗状态,再通过多次小剂量注射STZ破坏胰岛β细胞功能,加速DM的发生,最后诱发出高血糖症。这种建模方式成膜率较高(70%),但多次注射后小鼠各指标个体差异较大,以致分组后组内数据差异较大。
由于高血糖是T2DM的重要特点,长期以来对DM的治疗以控制血糖为主要目标,本实验FBG测定结果显示,使用以SPP为蛋白源的EN制剂支持1周后即能显著降低FBG值,持续EN支持四周后小鼠血糖值可下降至9~10mmol/L,但实验组小鼠血糖值仍远远高于对照组,这源于本实验在使用EN支持的同时,并未给小鼠胰岛素注射或使用降血糖的药物,EN支持制剂只能起到有效控制餐后或空腹血糖值、调节血脂代谢的效果,只是辅助营养治疗而并不能代替药物起到治疗DM的作用。
近年来随着对DM认识的深化,发现葡萄糖耐量实验对于临床诊断DM十分重要,是否改善糖耐量是评价药物药效的一个重要手段[24]。本实验中口服葡萄糖耐量(OGTT)测量结果表明:给予以蚕蛹短肽1或蚕蛹短肽2为蛋白源EN制剂的小鼠在灌胃30min后血糖有小幅上升,而后显著下降,在灌胃2h后小鼠血糖值基本恢复到灌胃前,这较益力佳组有更好的葡萄糖耐受度。
T2DM患者还常伴有脂代谢紊乱,表现为TG升高、HDL-C降低、LDL-C升高或正常,为此血脂代谢状况也是评价T2DM病人病情的重要指标[21]。本实验中,DM空白组小鼠即出现了高血脂症及血脂代谢紊乱。实验结果显示,SPP蛋白源EN制剂明显降低了糖尿病小鼠的TC、TG及LDL水平。但本实验使用的外源性引起的T2DM小鼠高血脂模型与人类内源性DM高血脂模型存在一定的差异,因此本实验中自制EN制剂对血脂不同成分的影响及机理需要进一步研究。
[1]Ji K M,Zhan Z K,Chen J J,et al.Anaphylactic shock caused by silkworm pupa consumption in China[J].Allergy,2008,63(10):1407-1408.
[2]Yang Y,Tang L,Tong L,et al.Silkworms culture as a source of protein for humans in space[J].Advances in Space Research,2009,43(8):1236-1242.
[3]FAO/WHO.Energy and Protein Requirements[R].FAO/WHO,Rome,Italy.1973.
[4]Zhou J,Han D.Proximate,amino acid and mineral composition of pupae of the silkworm.Antheraea pernyi in China[J].Journal of food composition and analysis,2006,19(8):850-853.
[5]Xu H,Hao W,He D,et al.Smt3 is required for the immune response of silkworm,Bombyx mori[J].Biochimie,2010,92(10):1306-1314.
[6]Hu D,Liu Q,Cui H,et al.Effects of amino acids from selenium-rich silkworm pupas on human hepatoma cells[J].Life sciences,2005,77(17):2098-2110.
[7]Wen H,Chang Y,Cao B.Anti-fatigue function of silkworm pupa protein polypeptides[J].Food Science,2009,30(19):291-293.
[8]Igarashi K,Yoshioka K,Mizutani K,et al.Blood pressuredepressing activity of a peptide derived from silkworm fibroin in spontaneously hypertensive rats[J].Bioscience,biotechnology,and biochemistry,2006,70(2):517-520.
[9]Sheng S,Zhou J,Shen Y,et al.Effect of Honeybee Pupae Peptide-rich Protein Powder on Immune Function,Blood Glucose and Blood Lipid in Rats[J].Food Science,2010,3:057.
[10]Hong-xin W.Progress in the study on bioactive ingredient of silkworm pupa[J].Qilu Pharmaceutical Affairs,2007,6:022.
[11]陈静,郑明珠,王浩.蚕蛹蛋白肽的制备及其运动饮料研制[J].食品科学,2009(14):318-320.
[12]于小磊,耿丽晶,郭雪松,等.双酶水解蚕蛹蛋白制备氨基酸饮料的研究[J].中国农学通报,2013,29(27):195-199.
[13]Zhou J,Han D.Safety evaluation of protein of silkworm(Antheraea pernyi)pupae[J].Food and chemical toxicology,2006,44(7):1123-1130.
[14]Luo J,Quan J,Tsai J,et al.Nongenetic mouse models of non-insulin-dependent diabetes mellitus[J].Metabolism,1998,47(6):663-668.
[15]朱新鹏,张恒瑞.蚕蛹蛋白双酶法水解工艺优化[J].湖北农业科学,2012,51(5):2081-2084.
[16]邱英华,孙卫东,王玉海,等.蚕蛹蛋白提取与脱臭工艺研究[J].中国食品添加剂,2012,3:133-136.
[17]陈佳捷,吴文惠,倪玲,等.蚕蛹蛋白和蚕蛹短肽的模拟胃/肠道消化特性研究[J].食品工业科技,2014,35(1):333-337.
[18]Gilbert E R,Fu Z,Liu D.Development of a nongenetic mouse model of type 2 diabetes[J].Experimental diabetes research,2011,2011:1-12.
[19]杨强.白藜芦醇减轻2型糖尿病小鼠心肌缺血/再灌注损伤及机制[D].西安:第四军医大学,2012:1-66.
[20]Fu Z,Zhang W,Zhen W,et al.Genistein induces pancreatic β-cell proliferation through activation of multiple signaling pathways and prevents insulin-deficient diabetes in mice[J].Endocrinology,2010,151(7):3026-3037.
[21]顾景范,杜寿玢,郭长江.现代临床营养学.北京:科学出版社,2009:529-543.
[22]鲁琳:“世界糖尿病日:20岁以上患病率为9.7% 年轻人比 例 上 升 ”.http://sh.eastday.com/m/20131114/u1a7774399.html(2013/11/14)
[23]王彤,周国用,汤秀群,等.链脲佐菌素和高脂肪饲料诱导的实验性2型糖尿病小鼠模型[J].中国糖尿病杂志,2000,8(2):111-112.
[24]Herman G A,Bergman A,Stevens C,et al.Effect of single oral doses of sitagliptin,a dipeptidyl peptidase-4 inhibitor,on incretin and plasma glucose levels after an oral glucose tolerance test in patients with type 2 diabetes[J].Journal of Clinical Endocrinology & Metabolism,2006,91(11):4612-4619.
