盐度对大菱鲆幼鱼肌肉氨基酸和脂肪酸组成的影响
2014-12-15雷霁霖洪万树艾春香
曾 霖 , 雷霁霖 , 刘 滨 , 洪万树 , 艾春香
(1.厦门大学 海洋与地球学院, 福建 厦门 361021; 2.中国水产科学研究院 黄海水产研究所, 山东 青岛266071)
鱼类对环境盐度变化的适应主要通过调节渗透压相关的酶和转运体蛋白的生物合成和功能发挥来实现的, 这些过程均需要消耗大量的能量[1], 能量主要由糖类、脂类、蛋白质等三大营养物质通过机体新陈代谢提供。研究表明, 盐度变化会影响鱼类机体的氨基酸和脂肪酸组成和含量。高渗透胁迫可以改变红点鲑(Salvelinus alpinus)和金头鲷(Sparus auratus)机体内非必需脂肪酸(NEFA)总量[2-4]; 攀鲈(Anabas testudineus)在盐度30水体中驯化6 h后, 其肌肉中天冬氨酸和丙氨酸含量显著升高[5]; 经过5 d的海水驯化后, 虹鳟(Oncorhynchus mykiss)肌肉中亮氨酸、异亮氨酸、缬氨酸等 3种支链氨基酸总量显著增加[6]; 乌鳢(Channa argus)肌肉中氨基酸总量和呈味氨基酸总量随盐度的上升而增加[7]; 盐度也可以改变鱼类肌肉中高度不饱和脂肪酸的总量[8]; 鲈鱼(Lateohtbrax japonicus)稚鱼肌肉中多不饱和脂肪酸总量尤其是EPA和DHA总量随盐度的降低而增加,而对饱和脂肪酸总量影响不显著[9]。此外, 有些氨基酸在鱼类渗透压调节过程中可以充当“细胞溶质”,如红点鲑、比目鱼(Platichthys flesusL.)、罗非鱼(Oreochromis mossambicus)等机体内的牛磺酸、甘氨酸可以被动员起来参与渗透节调节[4,10-11]。
大菱鲆(Scophthal musmaximus)作为海水工厂化养殖以及向内陆地区推广的一种优质鱼类日益受到人们的关注。目前, 中国大菱鲆工厂化养殖主要以北方为主, 大多采用地下井水, 也有采用地下井水和自然海水调配使用。地下井水水温稳定, 这使得大菱鲆能够顺利渡过夏季和冬季的不利环境, 特别是冬季可以大大降低越冬成本。然而, 不同井间的海水盐度存在较大差异[12]。此外, 为了扩大大菱鲆的养殖范围, 使之由沿海向半咸水域延伸。不同区域间海水盐度也存在明显差异。盐度作为影响鱼类肌肉品质的重要环境因子, 目前的研究主要集中在盐度变化对鱼类肌肉常规营养成分如粗脂肪、粗蛋白、水分等的影响, 而有关盐度对鱼类肌肉中氨基酸和脂肪酸组成和含量影响的研究较少。迄今, 有关盐度对大菱鲆肌肉品质的影响尚未见报道。本实验将大菱鲆幼鱼分别饲养在盐度为 12、18、24、30和 36等 5种水体中, 以探讨盐度对大菱鲆幼鱼肌肉中氨基酸和脂肪酸组成和含量的影响, 为揭示鱼类渗透压调节的能量代谢机制及肌肉营养品质的环境调节机理积累基础资料。
1 材料与方法
1.1 实验动物及驯化
实验用大菱鲆幼鱼取自山东省烟台天源水产有限公司, 初始体质量为(7.16±0.07) g, 健康活泼。幼鱼运输到实验基地后, 分别投放在容积为240 L的钢化玻璃桶中暂养1周, 26尾/桶, 盛水140 L, 养殖用水为深井过滤海水, 盐度为30(30组, 对照组)。高盐度和低盐度由深井过滤海水与海水晶或淡水调配而成, 采用每天盐度升降1~2.5分别调至12(12组) 、18 (18组)、24(24组)、36(36组)等 4个盐度梯度, 每盐度组设3个重复组, 实验期间水温为14.2~19.9℃,pH为7.67~8.04, 溶解氧为6.55~8.61 mg/L, 总氨氮低于 0.17 mg/L, 自然光照, 连续充气。大菱鲆幼鱼在预定的盐度环境中适应 1周后正式开始实验。采取饱食投喂方式投喂, 每天投食2次(08: 30和16: 30),每天早上投饵1 h后, 虹吸法吸去残余饵料和排泄物,换水率为100%, 实验为期60 d。
1.2 样品采集和分析
饲养大菱鲆幼鱼60 d后, 每桶随机捞取16尾幼鱼, 称质量后取下幼鱼的所有肌肉混合匀浆, 真空冷冻干燥机(25superES3, VIRTIS美国)冷冻干燥后,采用高效液相色谱仪和气相色谱仪分别测定大菱鲆幼鱼肌肉中氨基酸和脂肪酸的含量。
1.2.1 氨基酸测量方法及步骤
参照 GB/T 5009.124-2003《食品中氨基酸的测定》的方法进行样品处理。然后使用高效液相色谱仪测量肌肉氨基酸组成, 具体步骤如下:
准确称取样品20 mg放置于安培瓶中, 加入10 mL浓度为 6 mol/L盐酸, 充氮气后封管, 放置于110℃烘箱中水解24 h后减压蒸干, 然后用0.02 mol/L盐酸定容至10 mL。
采用异硫氰酸苯酯柱前衍生法: 量取制备好的样品200 μL, 转移到1mL离心管中, 加入100 μL三乙胺溶液和100 μL异硫氰酸苯酯, 混匀, 室温放置1 h,然后加入400 mL正己烷振摇后放置10 min, 取下层溶液, 用0.45 μm膜过滤上高效液相色谱仪。
仪器: Waters alliance高效液相色谱仪; 色谱柱:Venusil-AA 氨基酸分析柱(4.6 m×250 mm×5 μm); 柱温: 40℃; 检测波长: 254 nm; 流动相A: 0.1mol醋酸钠(含7%乙腈); 流动相B: 80%乙腈; 流速: 1mL/min 梯度洗脱。
1.2.2 脂肪酸测量方法及步骤
参照GB/T 9695.2—2008《肉与肉制品脂肪酸测定》的方法进行样品处理。然后, 样品脂肪酸在催化剂作用下与甲醇反应生成脂肪酸甲酯, 进气相色谱仪, 采用面积归一化法对其组成进行分析。具体步骤如下:
1.2.2.1 脂肪的提取
用石油醚提取, 用旋转蒸发仪除去溶剂, 得到脂肪提取物。
1.2.2.2 脂肪酸甲脂制备
采用三氟化硼法, 对样品进行处理: 100 mg脂肪酸提取物放置50 mL烧瓶中, 加入0.5 mol/L的氢氧化钠甲醇溶液4 mL, 加热回流10 min进行脂肪的皂化; 再加入适量的 14%的三氟化硼甲醇溶液, 回流3 min, 进行脂肪的甲酯化。然后, 加入适量的异辛烷, 加入20 mL饱和NaCl溶液, 摇匀, 静置10 min,再用移液管取出2 mL上层的异辛烷层转移到试管中,加入适量的无水硫酸钠脱水后, 进行气相色谱分析。
1.2.2.3 上机
脂肪酸分析采用毛细管气相色谱法。用 Agilent 7890A型气相色谱仪(美国安捷公司)和 DB-FFAP弹性石英毛细管柱(30 m×0.25 mm×0.25 μm)进行分析。采用自动进样系统, 进样体积为1.0 μL, 进样口温度为 220℃, 载气为高纯氮气, 柱头压为 35.5 kPa, 流速为1.0 mL/min, 分流方式进样, 分流比为10∶1。柱温采用程序升温法: 100℃保持3 min, 然后每分钟升高10℃, 升到230℃后, 保持15 min。火焰离子化检测器(FID)温度为280℃。37种脂肪酸混合标准品(47885-U)由美国 Supelco公司提供。对各脂肪酸的测定是在相同色谱条件下, 依据标准脂肪酸的保留时间来确定, 采用面积归一化法计算各脂肪酸的质量分数。
1.3 肌肉蛋白质营养价值评价参数
分别采用必需氨基酸指数(EAAI)、化学分(CS)和氨基酸分(AAS)作为评价盐度对大菱鲆幼鱼肌肉蛋白质营养价值的影响指标, 计算公式分别为:

CS=待评样品蛋白质氨基酸含量(mg/g蛋白质)/鸡蛋蛋白质氨基酸含量(mg/g蛋白质)
AAS=待评样品蛋白质氨基酸含量(mg/g蛋白质)/(WHO/FAO评分模式氨基酸含量)(mg/g蛋白质)
其中,n为比较的氨基酸数,t为待评的蛋白质;s为标准蛋白质, WHO为世界卫生组织, FAO为世界粮油组织。
1.4 数据处理与统计分析
实验所得数据用平均数±标准差(means±SD)表示, 采用 SPSS l6.0软件进行单因素方差统计分析(one-way ANOVA), 当差异显著(P<0.05)时, 再进行student-Newman-Keuls多重比较分析。
2 结果
2.1 盐度对大菱鲆幼鱼肌肉中氨基酸组成的影响
饲养60 d后, 各盐度组的大菱鲆幼鱼肌肉中氨基酸组成见表1。除色氨酸在酸水解过程中被破坏和半胱氨酸含量极低, 未检测出来外, 共检测出 16种氨基酸, 其中谷氨酸含量最高, 脯氨酸和组氨酸含量较低。天冬氨酸在5.25%±0.09%~6.03%±0.30%, 36组显著高于 24组(P<0.05); 谷氨酸在 10.74%±0.80%~12.31%±0.65%, 12组和36组显著高于24组(P<0.05); 甘氨酸在 3.64%±0.21%~3.86%±0.13%, 各盐度组间差异不显著(P>0.05); 丙氨酸在 4.44%±0.06%~4.81%±0.14%, 36组显著高于12组、18组和24组(P<0.05)。氨基酸总量(TAA)、必需氨基酸(EAA)总量、非必需氨基酸(NEAA)总量和呈味氨基酸(FAA)总量分别在69.25%±0.37%~74.85%±1.26%、31.70%±0.11%~33.74%±0.28%、31.29%±0.44%~34.60%±1.26%和24.20%±0.66%~26.98%±1.02%, 从高到低依次为 36组>30组>12组>18组>24组, 36组均显著高于24组(P<0.05)。支链氨基酸(BCAA)总量、EAA/TAA、EAA/NEAA和 FAA/TAA分别在 14.94%± 0.34%~15.37%±0.18%、44.57%±1.20%~45.78%±0.26%、80.40%±3.93%~84.42%±0.89%和 34.95%±0.70%~36.41%±1.33%, 各盐度组间均无显著性差异(P>0.05)。
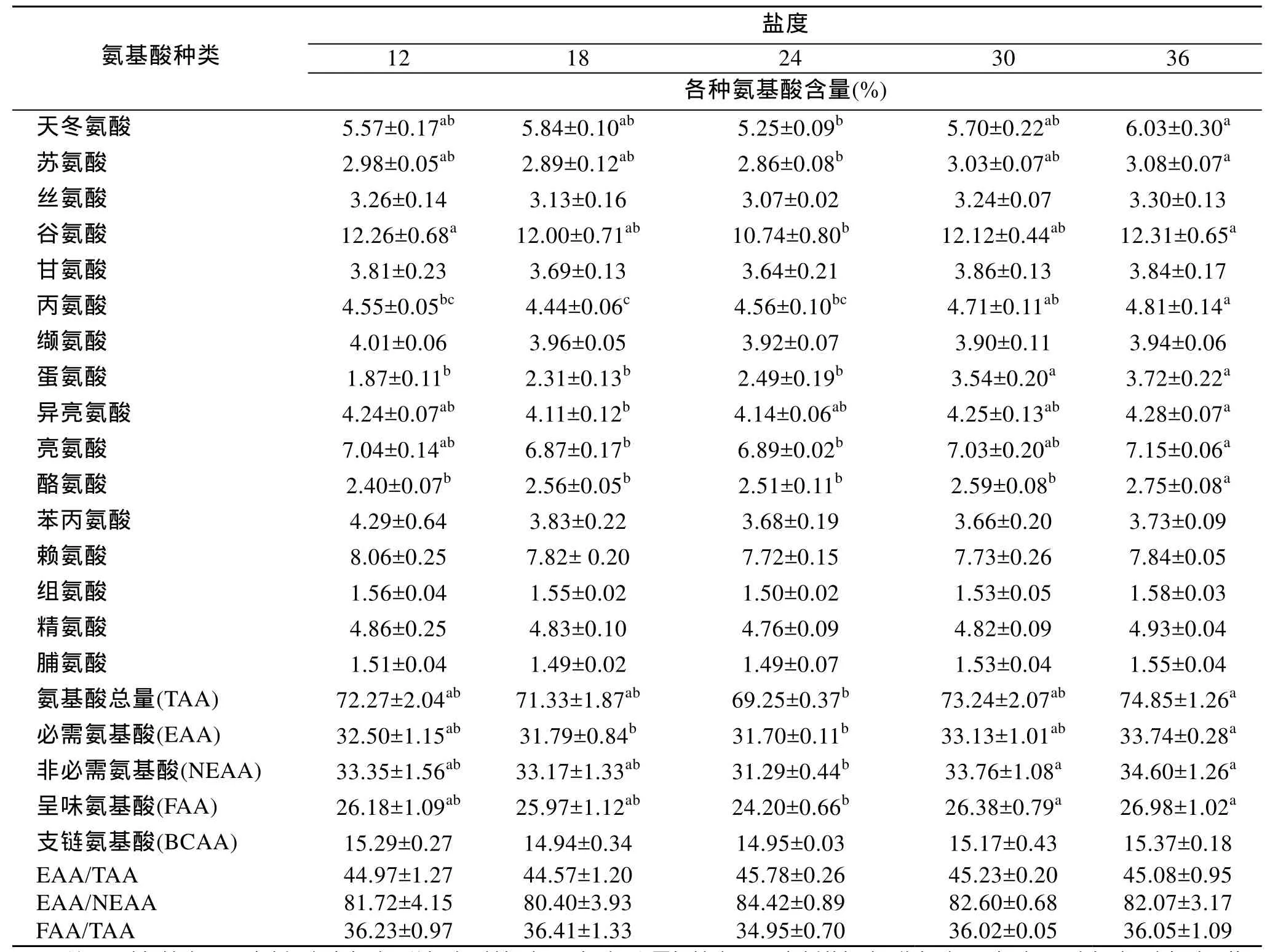
表1 盐度对大菱鲆幼鱼肌肉氨基酸组成的影响(%)(平均值±标准差, n=3)Tab.1 Effect of different salinities on amino acid composition (%) in muscle of juvenile turbot (S.maximus) (means ± SD, n=3)
饲养60 d后, 各盐度下大菱鲆幼鱼肌肉的必需氨基酸指数在40.41±1.23~44.46±0.54, 其中, 36组最大, 12组最小, 30组和36组显著大于其他3个盐度组(P<0.05), EAAI值随盐度的升高而增大(表2)。
饲养60 d后, 各盐度下的大菱鲆幼鱼肌肉蛋白质的化学分见表3。从表3中得知, (蛋氨酸+半胱氨酸)得分最低, 其分值随盐度的升高而增大, 其次是苏氨酸。因此, 各盐度组的第一限制氨基酸为(蛋氨酸+半胱氨酸), 第二限制氨基酸为苏氨酸。
饲养60 d后, 各盐度下的大菱鲆幼鱼肌肉蛋白质的氨基酸分见表4。从表4中可以看出, 除了苏氨酸和(蛋氨酸+半胱氨酸)稍低外, 其他氨基酸分AAS均接近或者大于1。其中, 赖氨酸的氨基酸分AAS最高, 接近或大于2。
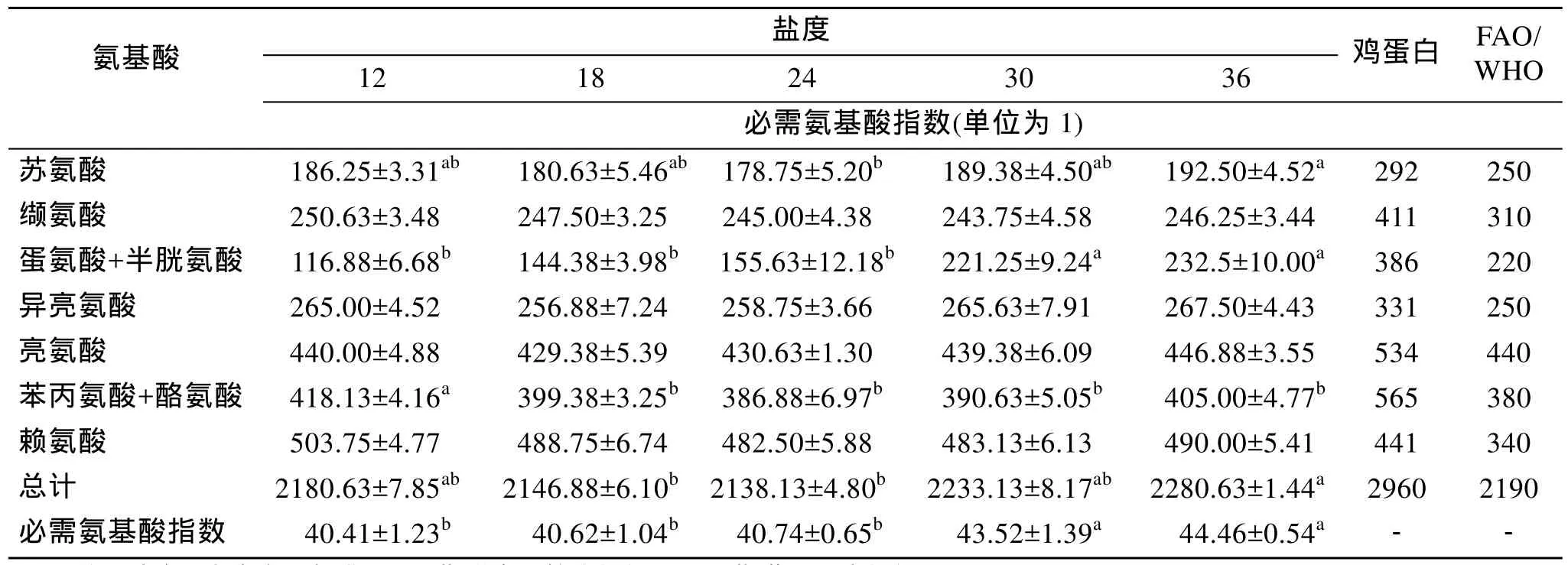
表2 不同盐度下大菱鲆幼鱼肌肉蛋白的必需氨基酸指数(EAAI)(平均值±标准差, n=3)Tab.2 EAAI of muscle protein in juvenile turbot (S.maximus) reared at different salinities (means ± SD, n=3)

表3 不同盐度下大菱鲆幼鱼肌肉蛋白质的化学分(CS)(平均值±标准差, n=3)Tab.3 CS of muscle protein in juvenile turbot (S.maximus) reared at different salinities (means ± SD, n=3)

表4 不同盐度下大菱鲆幼鱼肌肉蛋白质的氨基酸分(AAS)(平均值±标准差, n=3)Tab.4 AAS of muscle protein in juvenile turbot (S.maximus) reared at different salinities (means ± SD, n=3)
由此可知, 盐度越高, 大菱鲆幼鱼肌肉中的氨基酸越符合 FAO/WHO中的必需氨基酸指数评分标准; 大菱鲆幼鱼肌肉中的限制性氨基酸主要是苏氨酸和(蛋氨酸+半胱氨酸)。
2.2 盐度对大菱鲆幼鱼肌肉中脂肪酸组成的影响
饲养60 d后, 各盐度下大菱鲆幼鱼肌肉中脂肪酸组成见表5。从表5可知, 共检测出23种脂肪酸,其中, 饱和脂肪酸(SFA)为 4种, 单不饱和脂肪酸(MUFA)为6种, 多不饱和脂肪酸(PUFAS)为13种。脂肪酸总量(TFA)在 88.65%±0.68%~89.66%±0.32%,其中, 12组最高, 18组最低, 18组显著低于12组和30组(P<0.05)。必需脂肪酸总量(EFA)在 3.28%±0.04%~3.58%±0.10%, 其中, 24组最高, 12组最低,各盐度组间差异不显著(P>0.05)。非必需脂肪酸总量(NEFA)在 85.11%±0.78%~86.38%±0.37%, 其中, 12组最高, 18组最低, 12组和 30组显著高于 18组(P<0.05)。SFA总量在27.51%±0.37%~29.83%±0.35%, 其中, 12组最高, 36组最低, 12组显著高于36组(P<0.05),总体上, SFA总量随盐度的升高而降低。EPA+DHA和PUFAS总量分别在 23.53%±1.30%~25.74%±0.25%和34.95%±1.01%~36.88%±0.64%, 各盐度组间均无显著性差异(P>0.05), 其含量从高到低依次为 36组>30组>24组>12组>18组, 总体上随盐度的升高而增大。
3 讨论
鱼类体液中的离子组成和浓度与其外围水环境中的差别很大[13], 必须通过渗透压调节来维持内环境稳定, 这一过程需要消耗大量的能量。与碳水化合物相比, 氨基酸和脂肪酸可以充当氧化底物为渗透压调节提供能量通常更容易被忽略[1]。目前, 仅有少量研究综合讨论了海水驯化过程中机体内氨基酸和脂肪酸含量的变化[2-7]。研究表明: 脂肪酸尤其是非必需脂肪酸作为鱼类主要的贮能物质[14], 可以为渗透压调节提供大量的能量[2,4], 同时, 氨基酸也可以通过以下几条途径产生能量: (1)非必需氨基酸如天冬氨酸、丙氨酸通过联合脱氨基作用产生能量[5];(2) 天冬氨酸和丙氨基被各自的氨基酸转移酶氧化后, 体内谷氨酸含量在没有谷氨酸脱氢酶脱氨基的情况下增加[4], 谷氨酸是渗透压调节过程中另外一种能量来源; (3)支链氨基酸(如亮氨酸、异亮氨酸、缬氨酸)通过支链氨基酸转移酶氧化产生谷氨酸。本研究表明, 36组的支链氨基酸总量、天冬氨酸、丙氨酸和谷氨酸含量均高于对照组, 非必需脂肪酸总量低于对照组; 18组和24组的非必需脂肪酸总量、丙氨酸、支链氨基酸和谷氨酸含量均低于对照组; 12组的支链氨基酸总量、非必需脂肪酸总量和谷氨酸含量高于对照组, 天冬氨酸和丙氨酸含量低于对照组。甘氨酸作为渗透压调节的“细胞溶质”, 各盐度组间均差异不显著。由此可见, 水环境中的盐度可以通过改变新陈代谢途径来影响大菱鲆幼鱼肌肉中的氨基酸和脂肪酸含量, 从而为渗透压调节提供能量。至于能量主要由糖类、脂类还是蛋白质供给, 及通过哪些代谢途径提供, 需要测定鱼类的氧氮比(O/N)[15], 同时对血液和组织中能量代谢相关酶的活性及其基因表达水平等进行更深入的研究。
蛋白质是评价肌肉品质最重要的指标之一, 而蛋白质是由氨基酸组成的。因此, 氨基酸组成是一项非常重要的肌肉品质评价指标。根据WHO/FAO理想模式, 质量较好的蛋白质其必需氨基酸总量与氨基酸总量之比(EAA/TAA)为 40%左右, 必需氨基酸总量与非必需氨基酸总量之比(EAA/NEAA)为60%以上[16]。各盐度组幼鱼肌肉中的EAA/TAA、EAA/NEAA 分别在 44.57%±1.20%~45.78%±0.26% 、80.40%±3.93%~84.42%±0.89%, 均符合 WHO/FAO理想模式要求, 说明大菱鲆肌肉是一种优质的蛋白质来源。各盐度组间幼鱼肌肉的氨基酸总量、必需氨基酸总量、非必需氨基酸总量和呈味氨基酸总量等均存在差异, 四者数值从高到低依次为36组> 30组> 12组> 18组> 24组, 且24组均显著低于36组,这与乌鳢(Channa argus)肌肉中氨基酸总量和呈味氨基酸总量随盐度的升高而增加的研究结果不一致[11],其主要原因可能是鱼的种类、盐度的变幅、驯化时间及饲养管理等不同。必需氨基酸指数(EAAI)是评价食物蛋白质营养的常用指标之一, 它是以鸡蛋蛋白质必需氨基酸为评价标准。EAAI值随盐度的升高而增大, 30组和36组显著高于其他盐度组。因此, 升高盐度(36组)可以增加大菱鲆幼鱼肌肉中氨基酸总量、必需氨基酸总量、非必需氨基酸总量等, 并增强其风味, 从而提高其氨基酸质量, 降低盐度则刚好相反。根据化学分CS和氨基酸分AAS可知(表3, 表4), (蛋氨酸+胱氨酸)和苏氨酸是大菱鲆幼鱼肌肉中最主要的限制性氨基酸, 其值随盐度的降低而减少。

表5 盐度对大菱鲆幼鱼肌肉脂肪酸组成的影响(%) (平均值±标准差, n=3)Tab.5 Effect of the different salinities on fatty acid composition (%) in muscle of juvenile turbot (S.maximus) (means ±SD, n=3)
在鱼类中, 脂类主要是由多不饱和脂肪酸(PUFAS)所构成[17]。其中包括 n-3PUFAS、EPA+DHA, 它们具有降血压、降血脂、抑制血小板聚集、抗肿瘤、消炎和免疫调节等多种功效[18]。36组幼鱼肌肉脂肪酸组成和含量的分析结果表明, 脂肪酸总量(TFA)和SFA总量略低于对照组, 而必需脂肪酸总量(EFA)、PUFAS和EPA+DHA均高于对照组(表5)。对于18组和24组而言, TFA、PUFAS和EPA+DHA均低于对照组, 而EFA和SFA总量均高于对照组。对于12组而言, TFA和SFA总量高于对照组, 而EFA、PUFAS和EPA+DHA均低于对照组, 即与36组相好相反。因此,提高养殖盐度有利于增加EFA、PUFAS和EPA+DHA等脂肪酸含量, 同时降低TFA和SFA总量等。与王艳等[12]有关盐度对鲈鱼脂肪酸影响的结论刚好相反。其主要原因可能与鱼的种类、盐度驯化的强度和时间及饲养管理等密切相关, 其机理有待进一步研究。
4 小结
养殖水体的盐度发生变化时, 大菱鲆幼鱼通过调整新陈代谢途径来获取渗透压调节所需求的能量,从而显著影响肌肉中的氨基酸和脂肪酸含量。本研究表明, 与对照组(30组)相比, 提高水体盐度(36组),有利于提高大菱鲆幼鱼肌肉中TAA、EAA、NEAA、FAA、EFA、PUFAS和EPA+DHA等含量, 同时降低SFA总量, 从而提高了氨基酸和脂肪酸的质量, 而降低盐度则刚好相反。因此, 在一定范围内, 提高盐度有利于改善蛋白质和脂肪酸的质量。本研究为阐明大菱鲆渗透压调节的能量代谢机制及肌肉营养品质的环境调节机理积累了基础资料。
[1]Tseng Y C, Hwang P P.Some insights into energy metabolism for osmoregulation in fish [J].Comp Biochem Physiol C, 2008, 148 (4): 419-429.
[2]Sangiao-Alvarellos S, Laiz-Carrión R, Guzmán J M, et al.Acclimation ofS.auratato various salinities alters energy metabolism of osmoregulatory and nonosmoregulatory organs[J].Am J Physiol Regul Integr Comp Physiol, 2003, 285(4): R897-907.
[3]Sangiao-Alvarellos S, Arjona F J, Martín del Río M P,et al.Time course of osmoregulatory and metabolic changes during osmotic acclimation inSparus auratus[J].J Exp Biol, 2005, 208(22): 4291-4304.
[4]Bystriansky J S, Frick N T, Ballantyne J S.Intermediary metabolism of Arctic charSalvelinus alpinusduring short-term salinity exposure[J].J Exp Biol, 2007,210(11): 1971-1985.
[5]Chang E W, Loong A M, Wong W P, et al.Changes in tissue free amino acid contents, branchial Na+/K+-ATPase activity and bimodal breathing pattern in the freshwater climbing perch,Anabas testudineus(Bloch),during seawater acclimation[J].J Exp Zool A Ecol Genet Physiol, 2007, 307(12): 708-723.
[6]Walton M J, Cowey C B.Aspects of intermediary metabolism in salmonid fish[J].Comp Biochem Physiol B, 1982, 73: 59-79.
[7]李小勤, 刘贤敏, 冷向军, 等.盐度对乌鳢(Channa argus)生长和肌肉品质的影响[J].海洋与湖沼, 2008,39(5): 504-510.
[8]谢帝芝, 王树启, 游翠红, 等.鱼类高度不饱和脂肪酸合成的影响因素及其机理[J].中国水产科学, 2013,20(2): 456-466.
[9]王艳, 胡先成, 罗颖.盐度对鲈鱼稚鱼的生长及脂肪酸组成的影响[J].重庆师范大学学报(自然科学版),2007, 24(2): 62-66.
[10]Fugelli K, Zachariassen K E.The distribution of taurine,gamma-aminobutyric acid and inorganic ions between plasma and erythrocytes in flounder (Platichthys flesus)at different plasma osmolarities [J].Comp Biochem Physiol A, 1976, 55(2a): 173-177.
[11]Fiess J C, Kunkel-Patterson A, Mathias L, et al.Effects of environmental salinity and temperature on osmoregulatory ability, organic osmolytes, and plasma hormone profiles in the Mozambique tilapia (Oreochromis mossambicus) [J].Comp Biochem Physiol A, 2007, 146(2): 252-264.
[12]国家鲆鲽类产业技术研发中心.国家鲆鲽类产业技术体系年度报告(2011)[M].青岛: 中国海洋大学出版社, 2011.
[13]雷霁霖.海水鱼类养殖理论与技术[M].北京: 中国农业出版社, 2005: 40-41.
[14]Rabeh I, Telahigue K, Gazali N, et al.Time course of changes in fatty acid composition in the osmoregulatory organs of the thicklip grey mullet (Chelon labrosus) during acclimation to low salinity [J].Marine and Freshwater Behaviour and Physiology, 2013, 46(2):59-73.
[15]Mayzaud P.Respiration and nitrogen excretion of zooplankton.IV.The influence of starvation on the metabolism and the biochemical composition of some species[J].Marine Biology, 1976, 37(1): 47-58.
[16]梁萌青, 雷霁霖, 吴新颖, 等.3种主养鲆鲽类的营养成分分析及品质比较研究[J].渔业科学进展, 2010,31(4): 113-119.
[17]Mourente G, Tocher D R.The in vivo incorporation and metabolism of [1-14C]linolenate (18: 3n-3) in liver,brain and eyes of juveniles of rainbow troutOncorhynchus mykissL.and gilthead sea breamSparus aurata L.[J].Fish Physiol Biochem, 1998, 18(2):149-165.
[18]雷霁霖, 梁萌青, 刘新富, 等.大菱鲆营养成分与食用价值研究概述[J].海洋水产研究, 2008, 29(4): 112-115.
