地塞米松和过氧化氢对合浦珠母贝珍珠层结构及基质蛋白表达的影响
2014-12-15苏境坦王洪钟张贵友谢莉萍张荣庆
陈 鹏, 苏境坦, 孔 玮, 王洪钟, 张贵友, 谢莉萍, 张荣庆
(清华大学 生命科学学院, 北京 100084)
生物矿化在生物界中广泛存在, 也是贝类钙代谢的重要内容。生物矿化是生物有机体把溶液中的离子转化成固体矿物的过程, 这个过程受到诸多因子的调控。TGFβ信号通路在脊椎动物骨形成过程中发挥重要且复杂的调控作用[1-2], NF-кB信号通路除了免疫系统, 也参与到脊椎动物骨骼的稳态维持系统之中[3], 而骨骼的生成维持是矿化过程的一个典型代表, 表明脊椎动物中TGFβ和NF-кB信号通路与矿化有着紧密关系。在贝壳形成过程中, 基质蛋白都被认为发挥了重要作用[4-6]。合浦珠母贝(Pinctada fucata)中已被鉴定的基质蛋白达数十种, 它们参与贝壳和珍珠形成的过程。因此, 研究贝中信号通路对基质蛋白表达的调控作用, 对软体动物生物矿化分子机制的研究具有重要意义。
目前, 已从合浦珠母贝体内克隆获得多个TGFβ超家族成员, 如pf-Smad3、pf-ALR1等和NF-кB信号通路中的一些关键因子pf-IKK、poIκB以及pf-Rel[7-11]。周玉娟研究发现特异性抑制pf-Smad3的mRNA表达水平可导致基质蛋白KRMP的mRNA表达水平显著降低[12]。崔雨、王泽实等报导了核因子Pf-rel可以直接与基质蛋白Nacrein的启动子相结合调控Nacrein的表达, 而pf-IKK可以通过调节pf-Rel的入核来调控Nacrein的表达[13-14]。可以推测, 在合浦珠母贝中,TGFβ和NF-кB信号通路也对矿化系统有着重要的调控功能。
在脊椎动物中, DEX可以抑制TGFβ和NF-кB信号通路, 而H2O2可以激活这两个信号通路[15-20]。本研究尝试用这两种药物分别作用于合浦珠母贝, 通过实时定量PCR检测TGFβ和NF-кB信号通路中关键因子pf-smad3、sox9、pif-BMP2、pf-rel、pf-IKK和基质蛋白Nacrein、N19、N16、ACCBP的表达变化, 运用扫描电镜观察贝壳珍珠层结构的改变和利用体外碳酸钙结晶实验研究间液蛋白对碳酸钙晶体生长的影响, 以期揭示TGFβ和NF-кB信号通路对贝矿化系统、尤其是珍珠层形成的调控功能。
1 材料与方法
1.1 实验动物、试剂
1.1.1 实验动物
合浦珠母贝(Pinctada fucata)取自广西壮族自治区北海市国发珍珠养殖场。
1.1.2 实验试剂
引物均合成于Invitrogen公司; 地塞米松购于Whatman公司; 牛血清白蛋白(BSA)、H2O2购于Sigma公司; SYBR Premix Ex Taq试剂盒购于Takara公司; 其他试剂为国产分析纯。
1.2 方法
1.2.1 对合浦珠母贝的药物刺激
选取大小均匀的健康合浦珠母贝120只, 分成3组(各40只), 分别为DEX处理组、H2O2处理组以及生理盐水处理对照组。用0.5 mm直径注射器于每日下午固定时间分别注射4 μL药物或生理盐水至相应组贝的闭壳肌中。连续注射14 d。DEX终浓度为10–7mol/L,H2O2终浓度为10–4mol/L, NaCl则与海水浓度一致。
药物刺激3、7、14 d后, 分别提取健康个体间液蛋白、外套膜组织及贝壳作后续实验材料。
1.2.2 体外碳酸钙结晶实验
参考方东的方法[21], 将饱和Ca(HCO3)2溶液, 与不同浓度的间液蛋白或BSA混合, 滴于硅化盖玻片上, 每滴溶液为25 μL, 玻片旁放置50 μL 1 mol/L的NaOH溶液吸收CO2。封闭环境下室温结晶24 h。
1.2.3 碳酸钙结晶速率的测定
参考Suzuki的方法[22], 在96孔板中每孔依次加入100 μL 100 mmol/L 的 NaHCO3溶液、10 μL 4 μmol/L间液蛋白或BSA和100 μL 100 mmol/L 的CaCl2溶液, 通过分光光度计连续测定570 nm处吸光值, 每组重复5次。
1.2.4 扫描电镜观察
将贝壳珍珠层清水洗净处理成小片, 然后在表面喷金。喷金60s后, 置于电镜观测台正中, 标记好方向, 于高真空模式下观测。使用仪器为FEI Quanta 200扫描电镜, 工作电压为15 kV。
碳酸钙晶型观察采取类似的方法, 用无水酒精冲洗体外碳酸钙结晶实验后的玻片, 清洗杂质, 之后晾干脱水。
1.2.5 拉曼光谱鉴定碳酸钙晶型
分析使用RM2000光谱仪, 激光波长为514 nm,扫描波长范围为100~1 200 cm–1, 功率为4.6 mW, 每个样品重复扫描6~10次。
1.2.6 总RNA的提取和cDNA第一链的合成
同周玉娟的方法[12]。
1.2.7 实时定量聚合酶链式反应PCR
实时定量PCR反应的特异性引物设计见附件1。
采用 SYBR Green I 试剂盒(Takara)、Mx3000PTM RT-PCR System(Stratagene)。反应体系和实验步骤同参考文献[12]。
2 结果与讨论
2.1 药物刺激对贝壳珍珠层结构的影响
利用扫描电镜观察贝壳珍珠层的结构。正常的珍珠层由梯形排列的六边形文石小片组成, 小片边缘整齐清晰, 表面光滑平整(图1C)。经DEX处理后,珍珠层六边形小片表面变得粗糙, 呈现散碎条带状(图1D)。推测有可能是新形成的六边形文石小片在生长的过程中失去了 c-轴方向的严格调控。由于 c-轴方向的过度生长致使文石小片的厚度增加。这与RNAi抑制Nacrein后所形成的珍珠层的结构类似[23]。此外, 有些区域珍珠层文石有过度增生和紊乱覆盖现象(图1G、H、I), 可能是由于珍珠层文石片层生长速度过快, 且失去精确调控, 从而导致珍珠层表面连成整片结构, 失去原有梯形生长模式的结构布局。
在H2O2处理组, 珍珠层中既有正常的文石小片,也有零碎的异常的文石小片(图1J、K、L)。异常的文石小片无明显的六边形边界, 呈碎片化, 但表面平整。它们可能是处于分解状态而非合成状态。
珍珠层与棱柱层的生长过渡区的观察显示, 相比对照组(图2A、B、C), DEX组珍珠层生长前沿在有机基底膜(organic matrix, 图2C、F、I短箭头所示区域)上的生长加快, 到达基底膜前沿(图2D、E、F)。而 H2O2组珍珠层前沿出现孔隙和裂痕(图2I), 前端生长呈现停滞或减缓(图2G、H)。初步推测DEX可加速珍珠层的生长, H2O2则可延缓珍珠层的生长。
2.2 间液蛋白对体外碳酸钙晶型的影响
本实验通过在体外模拟碳酸钙结晶过程来检测贝壳间液蛋白对碳酸钙结晶的晶貌和晶型的作用,进而对比不同实验组间液蛋白在碳酸钙结晶的调控功能上的差异。
实验在方解石结晶体系中进行, 分别加入不同浓度的经DEX和H2O2处理14 d后提取的合浦珠母贝间液蛋白和 BSA。BSA对照组中, 结晶都为典型方解石形态。间液蛋白组生成晶体主要呈现两种形态, 一类为方晶形, 形态接近对照组, 边缘有不同程度钝化; 另一类呈哑铃状形态。
在光学显微镜下统计不同实验组所获的碳酸钙晶体的比例见表1。从中可以看出, 在相同的实验组,随着加入间液蛋白浓度的升高, 结晶体系中的哑铃形晶形比例呈升高趋势。其中, DEX组促进哑铃形晶体生成的趋势最强, 对照组次之。进一步利用拉曼光谱仪分析三种晶体的晶型, 结果表明, 方晶形晶体为方解石, 哑铃状晶体为文石(图3)。

图1 药物刺激对贝壳珍珠层的影响Fig.1 The effect of DEX and H2O2 on nacre of shells
以上结果表明, 随着间液蛋白浓度的升高, 碳酸钙的结晶形态从方解石晶型向文石晶型转变,DEX处理组间液蛋白加强了该趋势, H2O2处理组则减弱此趋势。推测经DEX处理后, 促进文石生成的相关基质蛋白的表达量提高或者抑制文石生成的相关基质蛋白表达量降低, 使总体效果为加强文石的生成。H2O2处理组则总体效果相反。
2.3 间液蛋白对体外碳酸钙结晶速率的影响
为了进一步研究不同药物处理组的间液蛋白在碳酸钙结晶过程中的作用, 我们进行了体外碳酸钙结晶速率实验。
结果显示(图4),与 BSA对照组相比, 加入间液蛋白的反应体系在经历相同时间后, 570 nm的吸光度值(A570nm)都明显升高, 而570 nm的吸光度值正反映了此时溶液中碳酸钙晶体的多少, 这说明间液蛋白能够提高碳酸钙晶体的生成速率。而在相同蛋白浓度下, DEX处理组间液蛋白对碳酸钙结晶速率的促进作用最强, H2O2处理组比DEX处理组的促进作用稍弱。
2.4 药物刺激对信号通路和基质蛋白表达水平的影响
外套膜为两片位于贝壳内侧, 包裹覆盖整个软体部的膜状结构, 软体动物的贝壳是由外套膜分泌的物质沉积而成[24]。本次实验通过实时定量PCR, 检测了药物刺激下合浦珠母贝的外套膜组织中, TGFβ和NF-кB信号通路相关基因和珍珠层形成相关的基质蛋白Nacrein、N19、N16、ACCBP的mRNA表达水平的变化, actin作为内参。

表1 间液基质蛋白浓度对体外碳酸钙结晶的影响Tab.1 The effect of extrapallial fluid matrix protein on Calcium carbonate Crystallization in vitro
首先考察TGFβ信号通路和NF-кB信号通路相关基因的变化。结果(图5)显示, DEX处理组14 d样品中, TGFβ信号通路的pf-Smad3、pif-BMP2、sox9表达水平下降约13%、13%、17%, NF-кB通路的pf-rel和 pf-IKK分别下降约 20%和 29%。H2O2处理组,Pf-Smad3, pif-BMP2, Sox9表达水平上升63%、71%、80%, pf-rel和 pf-IKK分别上升 25%和 14%。表明DEX 下调 TGFβ和 NF-кB 信号通路表达水平, 而H2O2则上调 TGFβ和 NF-кB信号通路表达水平, 并且TGFβ和NF-кB信号通路间表现出一致性变化。
与珍珠层矿化相关基质蛋白表达水平的变化如图6所示。Nacrein、N16、N19的总体表达水平在DEX 作用下都有所降低(图6B、C、D), 而在 H2O2作用下明显升高。pf-smad3、Nacrein、N19的变化趋势存在着相对一致性(图6A、B、C)。其中, Nacrein在珍珠层形成过程中能调节晶型和生长速度, 抑制文石生成, N19能抑制碳酸钙结晶。所以该结果有助于解释2.1—2.3的实验现象。而随着时间变化显示药物的抑制和促进效果都有减弱趋势, 这可能是因为生物体常见的适应性调整。N16的变化(见图6D、DEX组3 d稍上升, 7 d表达下降)滞后于pf-smad3, 考虑到N16的功能是诱导文石生成, 此处N16的下调可能是机体对于珍珠层生长速度的拮抗性负调控。ACCBP能诱导和转化无定形碳酸钙, 结果显示, 在不同药物处理和不同时间条件下都只有小的表达水平的波动(图6E), 不具有统计学差异显著性, 推测ACCBP可能不受TGFβ和NF-кB信号通路的调控。
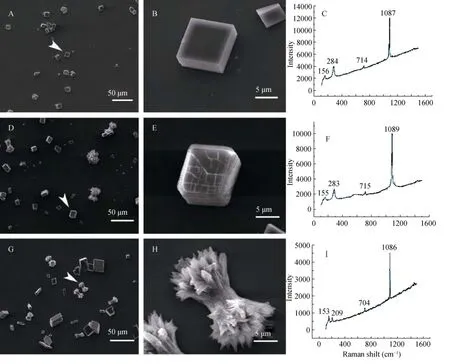
图3 间液基质蛋白调控体外碳酸钙结晶Fig.3 Regulation of extrapallial fluid matrix protein on Calcium carbonate Crystallization in vitro

图4 间液基质蛋白对体外碳酸钙结晶速率的影响Fig.4 The effect of extrapallial fluid matrix protein on crystalline velocity
以上结果有助于解释药物处理导致贝壳珍珠层的变化和间液蛋白功能的变化。DEX处理组珍珠层出现紊乱加速生长和H2O2组生长放缓可能是直接因为间液蛋白组分构成发生变化。DEX处理组珍珠层生长负调控蛋白Nacrein、N19和正调控蛋白N16表达都下降, 但是总体效果为促进珍珠层的生长。H2O2组Nacrein、N19和N16表达都上升, 总体效果为抑制珍珠层的生长。同时基质蛋白表达水平的变化影响间液中各蛋白组分相对浓度, 也影响到间液对碳酸钙结晶的总体调控效果。
上述结果还显示TGFβ和NF-кB信号通路表达水平变化的一致性, 且都与基质蛋白的表达水平变化呈正相关。这提示TGFβ和 NF-кB信号通路可能协同作用调控矿化相关的基质蛋白的表达。
2.5 DEX和 H2O2调控基质蛋白表达的可能机制和意义
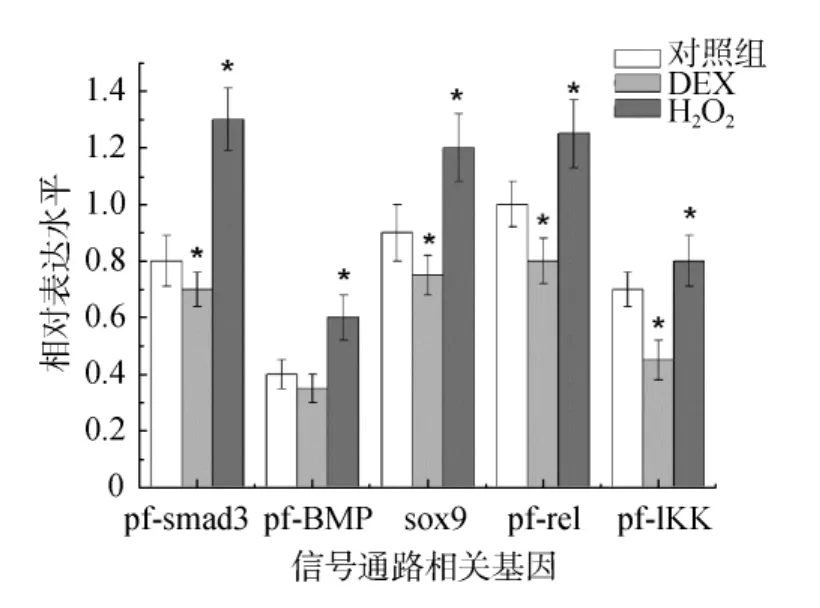
图5 药物刺激对TGFβ和NF-кB信号通路表达水平的影响Fig.5 The effect of drug treatment on TGFβ and NF-кB signaling pathways
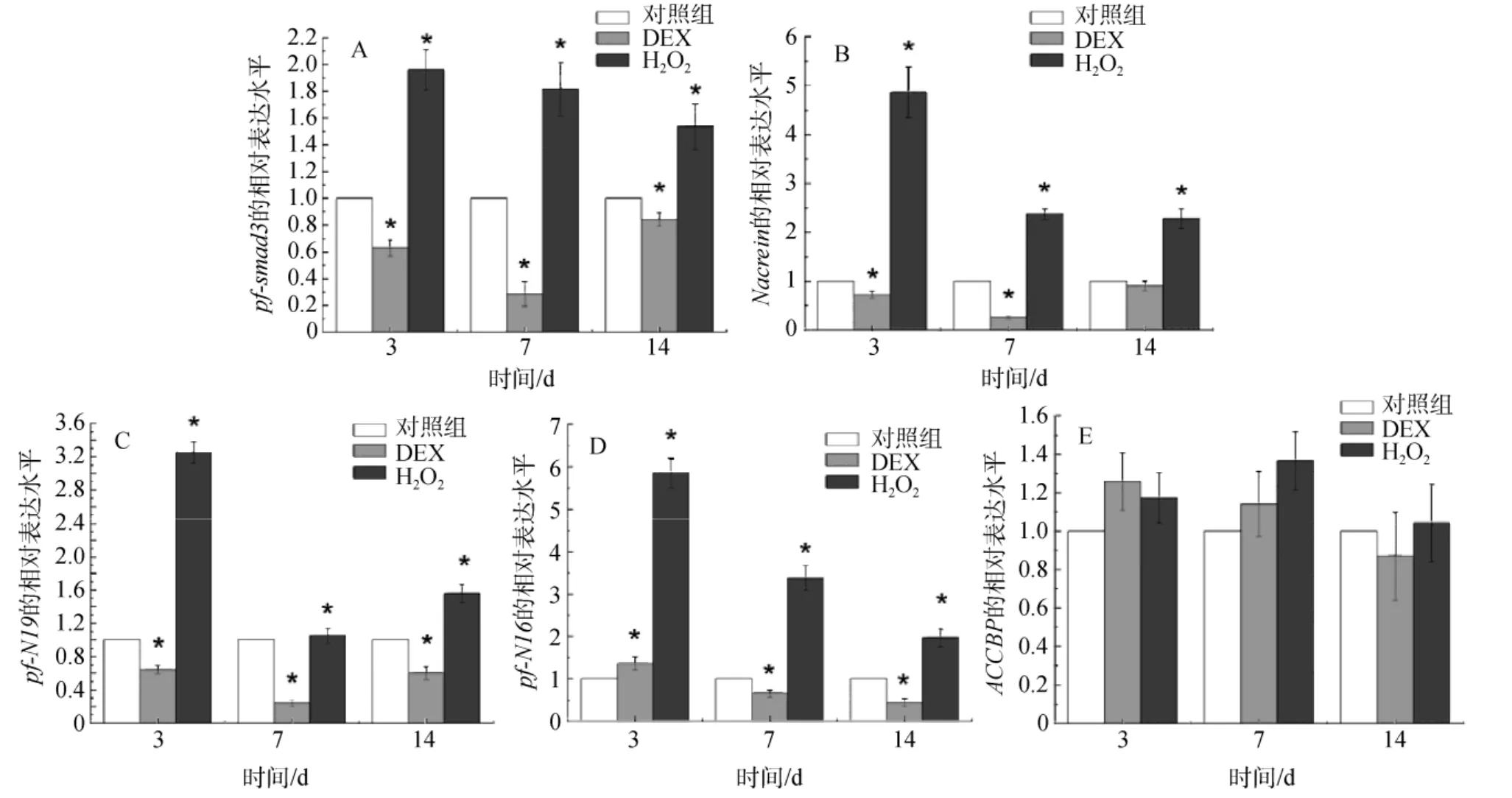
图6 药物处理对基质蛋白表达水平的影响Fig.6 The effect of drug treatment on expression level of matrix proteins
DEX和 H2O2对贝的信号通路作用的分子机制可能类似于脊椎动物中的情况。在脊椎动物体内,DEX活化糖皮质激素受体(GR), 活化的 GR在胞内直接作用于Smad3蛋白, 从而抑制TGFβ信号通路[15]。同时, DEX还可以诱导NF-кB抑制因子IκBα的表达,从而通过更多的IκBα结合NF-кB形成蛋白复合体抑制NF-кB的激活[16]。H2O2作为常见的活性氧簇(ROS),在动物细胞中能引起氧化应激反应, 直接激活TGFβ通路[17]。ROS也可促进蛋白激酶C(PKC)的激活, 活化的PKC磷酸化IκB, 导致后者与NF-кB解离而使NF-кB活化[19-20], 从而影响下游基因的表达。
已有实验表明, 在合浦珠母贝体内也存在这两个信号通路, TGFβ信号通路可能通过下游Sox9等因子与基质蛋白KRMP的启动子结合进行调控[12]。NF-кB通路能通过核因子pf-rel直接与基质蛋白Nacrein的启动子相结合进行调控[13-14]。本实验结果则表明,TGFβ和 NF-кB信号通路可能协同调控下游多个基质蛋白。但是, 由于缺乏贝类细胞系, 细胞水平实验无法开展, DEX和H2O2在合浦珠母贝中具体的作用机制以及 TGFβ和NF-кB信号通路如何具体调控基质蛋白还不明确, 仍需进一步的研究。
自从白细胞介素-1(IL-1)被认为是抗原刺激激活的免疫细胞分泌的可溶性因子, 同时也是激活破骨细胞的因子的现象被发现后[25], 不断积累的证据证明, 脊椎动物的免疫系统和骨骼系统共享一些调节因子[26-27]。同时, 脊椎动物的骨骼与免疫系统在细胞起源、空间分布、功能及调控等方面存在许多相似性。由于贝壳和珍珠都是生物矿化的产物, 与骨骼有相似的形成机制。由此推测, 免疫反应与贝壳矿化之间可能也存在密切的关系。2004年, Mount 等[28]提出了“血细胞介导贝壳矿化”的新观点, 而贝类血淋巴细胞被认为主要是履行天然免疫功能的, 暗示了贝壳的生物矿化可能与其免疫有关。
在脊椎动物体内, NF-κB信号通路最重要也是研究最透彻的作用是参与到免疫系统的信号调控之中[29]。而TGFβ信号通路也在免疫反应中起到重要作用, 炎症初期能影响非特异性免疫[30]。熊训浩克隆了贝合浦珠母贝中NF-кB信号转导相关的基因Pf-ALMP并证明该基因参与免疫应答[31]。可以推测这两个通路也参与贝的免疫反应。而本次研究显示这两信号通路协同作用, 共同调控珍珠层基质蛋白的表达, 提示了贝的免疫体系可能和矿化系统存在高度的关联, 可能共用一些细胞信号通路, 或者矿化相关蛋白有部分直接为免疫相关信号通路下游所调控。
本次实验反映的珍珠层生长与免疫相关信号通路的负相关性推测, 说明免疫系统的激活对于珍珠层的生长可能是不利的。而寻找合适的免疫抑制剂,通过下调免疫系统的水平来提高养殖珍珠的生长速度具有潜在的可行性。另外, 贝的免疫系统和矿化系统的交互调控可能具有重要的生物进化学意义。两个系统协同作用的机制有助于增强贝类对环境改变的适应性。
3 结论
本次实验通过DEX和H2O2分别抑制或激活合浦珠母贝的TGFβ和NF-кB信号通路, 从而调控与珍珠层形成相关的基质蛋白的表达, 并影响珍珠层的结构。结果显示, DEX处理使得间液蛋白促进珍珠层文石生成, 而H2O2处理则相反。实时定量PCR显示, 药物处理下TGFβ和NF-кB信号通路平行变化, 并且与基质蛋白表达变化高度相关。推测基质蛋白的表达可能同时受到这两个信号通路的调控, 暗示免疫体系和矿化系统可能共用某些细胞信号通路, 两个系统的协同作用机制具有重要的生物进化学意义。本研究结果对于如何提高和控制养殖珍珠的产量和质量也具有借鉴意义。
[1]Riley E H, Lane J M, Urist M R, et al.Bone morphogenetic protein-2: biology and applications[J].Clinical Orthopaedics and Related Research, 1996, 324:39-46.
[2]Yu Y, Yang J L, Chapman-Sheath P J, et al.TGF-beta,BMPs, and their signal transducing mediators, Smads,in rat fracture healing[J].Journal of Bone and Mineral Research, 2002, 60(3): 392-397.
[3]Teitelbaum S L, Ross F P.Genetic regulation of osteoclast development and function[J].Nat Rev Genet,2003, 4: 638-649.
[4]Weiner S, Traub W.Macromolecules in mollusc shells and their functions in biomineralization.Philosophical Transactions of the Royal Society of London[J].Series B, 1984, 304(1211): 425-433.
[5]Levi-Kalisman Y, Falini G, Addadi L, et al.Structure of the nacreous organic matrix of a bivalve mollusk shell examined in the hydrated state using Cryo-TEM[J].Journal of Structural Biology, 2001, 135(1):8-17.
[6]Addadi L, Joester D, Nudelman F, et al.Mollusk shell formation: A source of new concepts for understanding biomineralization processes[J].Chemistry-a European Journal, 2006,12(4): 981-987.
[7]Zhou Y, He Z, Li Q, et al.Cloning and expression pattern of a Smad3 homolog from the pearl oyster,Pinctada fucata[J].Acta Biochimica et Biophysica Sinica, 2008, 40(3): 244-252.
[8]Zhou Y, He Z, Huang J, et al.Cloning and characterization of the activin like receptor 1 homolog (Pf-ALR1) in the pearl oyster,Pinctada fucata.Comp Biochem Physiol[J].Part B, 2010,156: 158-167.
[9]Xiong X, Zhang R.Cloning and characterization of an IKK homologue from pearl oyster,Pinctada fucata[J].developmental and comparative immunology, 2008,32(1): 15-25.
[10]Wu X, Zhang R.Pf-Rel, a Rel/nuclear factor-kappaB homolog identified from the pearl oyster,Pinctada fucata[J].Biochemical and Biophysical Acta Sin(Shanghai), 2007, 39(7): 533-542.
[11]Zhang D, Xu X.Molecular characterization and expression analysis of the IkappaB gene from pearl oyster,Pinctada fucata[J].Fish Shellfish Immunology,2009, 26(1):84-90.
[12]周玉娟.合浦珠母贝TGFβ信号通路相关基因的克隆及功能研究[D].北京: 清华大学,2010.
[13]崔雨.合浦珠母贝 Pf-rel对 Nacrein的调控研究[D].北京: 清华大学, 2010.
[14]王泽实.合浦珠母贝Pf-IKK和poIκB对Nacrein的调控研究[D].北京: 清华大学, 2011.
[15]Song C Z, Tian X, Gelehrter T D.Glucocorticoid receptor inhibits transforming growth factor-β signaling by directly targeting the transcriptional activation function of Smad3[J].Proc Natl Acad Sci, 1999, 96(21):11776-11781.
[16]Auphan N, Donato J A, Rosette C, et al.Immunosuppression by glucocorticoids: inhibition of NF-кB activity through induction of IkB synthesis[J].Science,1995, 270(5234): 286-290.
[17]M Barcellos, T Dix.Redox-mediated activation of latent transforming growth factor-beta 1[J].Molecular Encocrinology, 1996, 10 (9): 1077-1083.
[18]Sang-Kyu Park, Jeong-a Kim, Young Seomun, et al.Hydrogen Peroxide Is a Novel Inducer of Connective Tissue Growth Factor[J].Biochemical and Biophysical Research Communications, 2001,284(4): 966-971.
[19]Berg R, Haenen G, Berg H, et al.Transcription factor NF-кB as a potential biomarker for oxidative stress[J].British Journal of Nitrition, 2001, 86(1): 121-127.
[20]Irfan R, Peter S, Gilmour, et al.Oxidative stress and TNF-α induce histone acetylation and NF-кB/AP-1 activation in alveolar epithelial cells: potential mechanism in gene transcription in lung inflammation[J].Molecular and Biochemistry, 2002, 235(1): 239-248.
[21]Fang D, Pan C, Lin H J, et al.A Novel Basic Protein,PfN23, Functions as a Key Macromolecule during Nacre Formation[J].Journal of Biological Chemistry,2012, 287: 15776-15785.
[22]Suzuki M, Murayama E, Inoue H, et al.Characterization of Prismalin-14, a novel matrix protein from the prismatic layer of the Japanese pearl oyster (Pinctada fucata) [J].Biochem J, 2004, 382: 205-213.
[23]Yu Z, Xie L, Lee S, et al.A novel carbonic anhydrase from the mantle of the pearl oyster (pinctada fucata)[J].Comp Biochem Physiol B, 2006, 143(2): 190-194.
[24]Lowenstam H A, Weiner S.On Biomineralization[M].New York: Oxford University Press, 1989.
[25]Dewhirst F E, Stashenko P P, Mole J E, et al.Purification and partial sequence of human osteoclastactivating factor: identity with interleukin 1 beta[J].J Immunol, 1985, 135: 2562-2570.
[26]Takayanagi H.Mechanistic insight into osteoclast differentiation in osteoimmunology[J].J Mol Med,2005, 83: 170-179.
[27]Walsh M, Kim N, Kadono Y, et al.Osteoimmunology:interplay between the immune system and bone metabolism[J].Annu Rev Immunol, 2006, 24: 33-63.
[28]Mount A, Wheeler P, Paradkar R, et al.Hemocytemediated shell mineralization in the eastern oyster[J].Science, 2004, 304(5668): 297-300.
[29]Ghosh S, May M J, Kopp E B.NF-КB and Rel proteins:Evolutionarily conserved mediators of immune responses[J].Annu Rev Immunol, 1998, 16: 225-260.
[30]Takayanagi H.Mechanistic insight into osteoclast differentiation in osteoimmunology[J].J Mol Med,2005, 83: 170-179.
[31]Xiong X, Chen L, Li Y, et al.Pf-ALMP, a novel astacin-like metalloproteinase with cysteine arrays, is abundant in hemocytes of pearl oysterPinctada fucata[J].BBA-Gene Struct.Expr., 2006, 1759: 526-534.
