蓝莓花色苷超声辅助提取工艺优化及组分分析
2014-12-13彭常安姜雯翔韩永斌
刘 永,王 平,吴 越,彭常安,姜雯翔,袁 晔,韩永斌*
(1.芜湖职业技术学院 生物工程系,安徽 芜湖 241006;2.南京农业大学 农业部农畜产品加工与质量控制重点开放实验室,江苏 南京 210095)
蓝莓(Blueberry)果实营养丰富,尤其是蓝莓果皮中含有的大量的花色苷(Anthocyanin)类物质.花色苷主要存在于细胞的液胞中,属水溶性黄酮多酚类化合物,是一种优良的氧自由基清除剂和脂质过氧化抑制剂[1],并且对癌症、过敏、炎症、视疲劳、心脑血管疾病等近100多种疾病具有直接或间接的预防和治疗作用.因此,蓝莓被联合国粮农组织列为人类五大健康食品之一.
花色苷的提取方法主要有溶剂法、酶法、发酵法以及超临界CO2提取[2],为提高色素得率,还可采用超声波、微波、脉冲电场及高压水法等技术破坏细胞膜和细胞壁,从而缩短提取时间.花色苷在中性和弱碱性溶液中不稳定,通常采用酸性溶剂进行提取,设备简单,但效率较低[3].超声辅助提取是利用超声波强烈的空化效应促进植物细胞壁的裂解和细胞内含物的溶出,可显著缩短提取时间,提高提取率,同时避免了高温对提取物质的影响,已大量应用于天然植物有效成份的提取[4].因此,本文采用超声辅助热水提取蓝莓果浆中的花色苷,并与酶提取工艺获得的花色苷进行提取率和组分比较,以获得最佳提取工艺参数.
1 材料与方法
1.1 试验材料与试剂
蓝莓(品种Garden blue),南京新得利食品有限公司提供,2012年7月10日采收后,装入泡沫箱中用冰块冷却,2 h内运至实验室,5℃冰柜保存3 h后进行试验;安琪果酒酵母,武汉安琪酿造有限公司;纤维素酶1 200 U/g,爱顿生物工程有限公司;乙腈 色谱纯,国药集团化学试剂有限公司;乙醇、盐酸和甲醇等均为分析纯,南京化学试剂有限公司.
1.2 仪器与设备
KQ-250B型超声清洗仪,昆山市超声仪器有限公司;Agilent 1200液相色谱仪,配有可变波长紫外检测器和安捷伦色谱工作站,美国安捷伦公司;UV-2802紫外可见分光光度计,美国尤尼克公司.
1.3 试验方法
(1)花色苷含量测定及提取率计算.准确称取3 g蓝莓果浆,加入1%HCl-甲醇溶液30 m L,35℃水浴1 h,每隔10 min搅拌1次,重复提取4次.提取液经减压蒸馏(40℃)除去甲醇后加1%HCl-H2O溶液定容至50 m L.取1 m L该提取液,加4 m L酸化乙醇(V1.5mol/LHCl∶V95%乙醇=15∶85),避光静置30 min,测定520 nm下花色苷吸光度值A.花色苷含量以矢车菊-3-葡萄糖苷为标准物按下式计算:

式中:A为吸光度值;Mw为矢车菊-3-葡萄糖苷的分子量(449.2);ε为摩尔消光系数(26 900);DF为稀释倍数.经计算标准物中花色苷含量为2 800 mg/L,花色苷提取率计算公式为:

(2)超声辅助提取单因素试验.将超声功率调至200 W,选择提取时间、提取温度、超声时间和稀释倍数4因素进行单因素分析,处理如下:①提取温度70℃、超声时间40 min和稀释倍数6倍时,考察提取时间为30 min、60 min、90 min、120 min、150 min、180 min、210和240 min时花色苷提取率的变化;②提取时间150 min,超声时间40 min和稀释倍数6倍时,考察温度为30℃、50℃、70℃和90℃时花色苷提取率的变化;③提取时间150 min、提取温度70℃和稀释倍数6倍时,考察超声时间为20 min、30 min、40 min、50 min和60 min时花色苷提取率的变化;④提取时间150 min、提取温度70℃和超声时间40 min时,考察稀释倍数为2、3、4、5、6和7时花色苷提取率的变化.
(3)Box-Behnken设计优化花色苷提取工艺原料品质分析.在单因素实验基础上运用Box-Behnken设计实验,试验结果如表1所示,采用SAS软件分析得到花色苷最佳提取工艺参数,并进行验证.
(4)传统酶法提取工艺.按5 mg/L纤维素酶加入到去离子水稀释倍数为7.8的蓝莓果浆中,50℃水浴180 min提取花色苷.以未加酶处理为对照1(CK1)和蓝莓果加同样稀释倍数的去离子水打浆,加热至90℃灭酶3 min过滤、静置180 min的蓝莓汁为对照2(CK2),上述样品冷却4℃下12 000 r/min离心10 min,取上清液,进行紫外-可见分光光度计在波长280~600 nm范围下扫描图谱和HPLC分析.
(5)花色苷组分分析.HPLC条件:Agilent TC-C18柱(4.6×250 mm,5μm);柱温30℃;流动相为甲酸、乙腈,流速0.5 m L/min;检测波长520 nm;进样量20μL;检测时间40 min.其中流动相采用梯度洗脱方法,甲酸浓度变化梯度为:0~5 min时,甲酸浓度10%~12%;5%~14 min,12%~13%;14%~16 min,13%~14%;16~18 min,14%~16%;18~19 min,16%~18%;19~22 min,18%~22%;22~35 min,22%~30%[5].
1.4 数据统计与分析
试验设3次重复,结果以ˉX±S形式表示,采用Excel和SAS软件对试验数据进行统计分析.
2 结果与分析
2.1 蓝莓果浆花色苷超声辅助提取单因素试验
(1)提取时间对蓝莓花色苷提取率的影响如图1所示.由图1可见,花色苷提取率随提取时间的延长而升高,在120 min时达到最大值38.52%;进一步延长提取时间,花色甘提取率下降.原因可能是随着提取时间的继续延长,影响花色苷的稳定性,使其部分降解,提取量下降[2].蓝莓花色苷稳定性差,较易氧化,长时间提取会大大增加其损失[3].
“星星急救”教学方式多样化,采用情景再现、模拟演示、应急演练、健康讲座等多种方式相结合的形式,为社会公众提供培训服务。太和医院提供的资料显示,小分队以情景剧开展急救知识的科普宣传活动,获得了国家知识产权保护。
(2)提取温度对蓝莓花色苷提取率的影响如图2所示.提取一方面可以促进蓝莓果实细胞壁的降解,提高出汁率,因此温度的升高有助于花色苷提取率的增加;另一方面,当温度高于60℃时,花色苷稳定性较差,其结构可能发生变化,甚至降解,使其提取量或者检测值降低[3].由图2可见,当提取温度为70℃时,花色苷提取率达最大值37.75%,但进一步升高温度导致花色苷的降解,花色苷提取率下降.
(3)超声时间对蓝莓花色苷提取率的影响如图3所示.超声提取主要是利用超声振动能量使细胞周围及胞内产生环流,提高细胞壁和细胞膜的通透性,有利于提高果浆中花色苷的提取率.由图3可见,随着超声时间的延长,游离态花色苷逐渐溶出,当超声处理40 min时,果汁中花色苷的提取率达最大值38.02%;但随着超声时间的进一步延长,其产生的热效应会导致部分花色苷发生氧化降解,花色苷提取率下降.
(4)稀释倍数对蓝莓花色苷提取率的影响如图4所示.由图4可见,随着稀释倍数的增大,提高了分子扩散速率,缩短了平衡时间,溶液传质作用的加强促进了.果浆中花色苷的溶出[6],导致其提取率升高.当稀释倍数为6时,达到最大值40.61%.随着稀释倍数进一步增大,花色苷提取率趋于稳定.

图1 提取时间对蓝莓花色苷提取率的影响

图2 提取温度对蓝莓花色苷提取率的影响

图3 超声时间对蓝莓花色苷提取率的影响
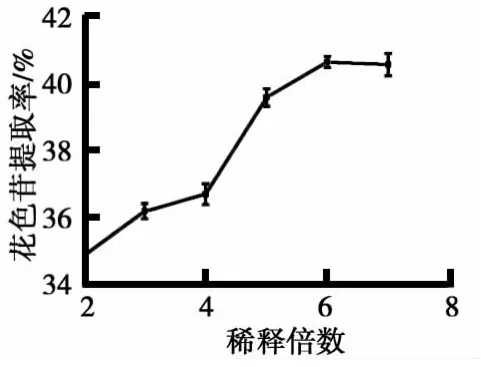
图4 稀释倍数对蓝莓花色苷提取率的影响
2.2 Box-Behnken设计试验结果及响应面优化花色苷提取工艺
Box-Behnken设计试验结果如表1所示,SAS软件分析结果如表2所示.花色苷提取率理论模型的检验P值为0.000 1,具统计学意义;决定系数为0.959 5,说明此模型拟合较好,自变量与响应值之间的线性关系显著,可用于花色苷提取率的理论预测.此外对方程的一次项、二次项和交互项进行方差分析,结果表明,方程中X1、X2以及交互项均表现不显著,但平方项表现显著(见表2).因此得到简化后的数学模型:Y式中,Y代表花色苷提取率,X1为提取时间,X2为提取温度,X3为超声时间,X4为稀释倍数.

表1 Box-Behnken实验结果

表2 回归方程方差分析表
为更好地反映稀释倍数、提取温度、提取时间和超声时间4因素对花色苷提取率的影响,运用SAS软件分析得到响应曲面图如图5所示.由图5可见,当固定任意3个因素时,花色苷提取率都随第4个因素水平的升高而升高;当达到一定值后,提取率又随之下降或者上升趋势变缓.4因素对花色苷提取率的影响大小顺序为稀释倍数>超声时间>提取时间>提取温度,这与方差分析的结果一致.
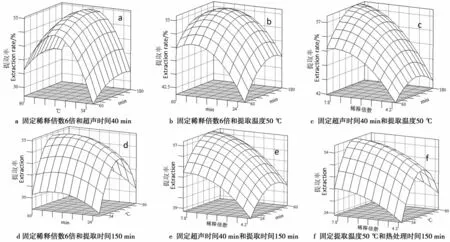
图5 花色苷提取响应曲面图
2.3 蓝莓花色苷不同提取方法比较
(1)不同提取方法对花色苷提取率的影响如图6所示.由图6可见,传统酶法提取(E)的花色苷提取率比未经酶处理样(CK1)高4.48%,比静置相同时间的蓝莓汁不同提取方法对蓝莓花色苷提取率的影响(CK2)高21.02%,这表明酶处理对花色苷溶出有一定促进作用,可能是纤维素酶破坏了细胞壁,释放出胞内物质,花色苷提取率升高.但与最优超声辅助提取工艺(S)相比,花色苷提取率低12.96%.原因可能是超声不仅导致游离花色苷的溶出,同时也导致部分与蛋白、纤维素等聚合的结合态花色苷的溶出;此外,在纤维素酶最适温度50℃条件提取,花色苷的热不稳定性是低提取率的重要原因.
(2)不同提取方法对花色苷吸收光谱的影响如图7所示.用酸化乙醇定容后扫描吸收光谱,由图7可见,蓝莓汁在紫外和可见区都有吸收,其吸收波长分别为280 nm,538 nm,且在330 nm处存在吸收肩峰,传统酶法提取物(E)对各组分的含量升高有一定作用,最优超声辅助提取工艺处理后(S)蓝莓汁的吸光度明显升高,但均没有形成新的吸收峰.
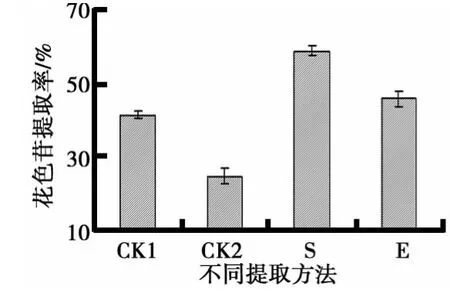
图6 不同提取方法对蓝莓花色苷提取率的影响

图7 不同提取方法对花色苷吸收光谱的影响
(3)不同提取方法花色苷组分比较如图8所示.本试验对提取前后的提取液样品分别进行HPLC分析.由图8可见,一方面提取前后花色苷组分种类大致相同,且主要洗脱峰位置无显著变化,说明提取后并没有产生新的花色苷衍生物;另一方面与未处理样品(CK1)相比,最优提取条件下获得的样品(S)中其主要组分2、3、6和7含量显著上升,而经过酶处理(E)和静置处理(CK2)样品中,其主要组分2、4和6含量均有不同程度的下降.
3 讨论
超声波用于花色苷的提取,相比传统酶法提取而言,超声提取利用超声振动能量使细胞周围及胞内产生环流,提高细胞壁和细胞膜的通透性,提高花色苷提取率12.96%.通过对静置提取、传统酶法提取和最优条件下超声辅助热水提取获得的蓝莓提取物进行全波长扫描发现没有新吸收峰出现,初步表明没有新的衍生物产生.
不同品种或不同产地蓝莓中花色苷种类无太大区别.Kaisu[7]等在相同洗脱条件下,对蓝莓品种Northblue进行HPLC-二极管阵列检测,发现了16种花色苷.本试验蓝莓原料含主要的花色苷组分12种.未处理样各 峰 的 峰 面 积的比例分别 为:tR为 6.104峰 (5.74%),10.526峰(3.28%),11.151 峰(2.46%),13.123峰(16.8%),14.725峰(11.06%),15.201峰(3.68%),17.112峰(6.56%),20.014峰(2.46%),22.989峰(14.34%),25.006峰(25.82%),26.663峰(6.56%),28.648峰(1.23%).从蓝莓未处理样色谱图分析结果看,图谱中共有12个组分的峰,这些组分峰构成蓝莓最主要的成分花青素.蓝莓花青素主要以飞燕草素、矢车菊素、矮牵牛素等为基本结构,与糖苷中的半乳糖苷、葡萄糖苷和阿拉伯糖苷在不同位点的结合,衍生出全部含有这三种糖苷而形成各种不同的组分(16种),而图谱中前11个组分峰面积百分含量占到总量的98.76%,标志着蓝莓中的花色苷98.76%的成份是由这些组分构成的.本实验检测出的12个花色苷组分可能也属于以上16种花色苷.由于花青素组分的复杂,有些组分的分子式相同,只是链接某些基团的位置不同、结构上的微小差异,导致了它们的极性、特性差别非常小.
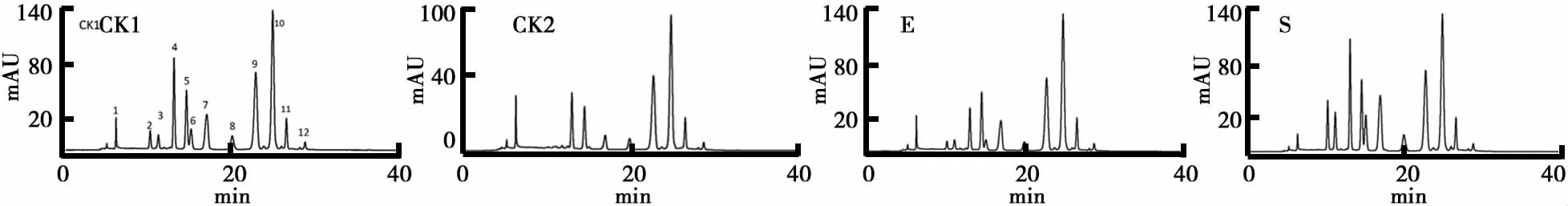
图8 不同提取方法花色苷组分比较
4 结论
本试验在单因素实验基础上,利用Box-Behnken设计确定蓝莓果浆超声辅助热水提取的最佳工艺条件为提取时间119 min,提取温度69.7℃,超声时间45 min和稀释倍数为7.8,预测最大提取率58.83±1.78%,在此最优条件下,花色苷的提取率为58.64±0.32%,相对误差仅为0.95%,模型准确度较高.最优超声辅助热水提取工艺下花色苷提取率高于传统酶法提取.HPLC分析结果表明,最优提取工艺下花色苷含量显著上升,但其主要组分并没有发生显著变化.
目前关于花色苷的提取、分离纯化及鉴定的研究方法很多.超声辅助提取蓝莓花色苷的方法是一个利用现代物理技术的试验方法,具有提取率高、工艺简单、条件温和等特点,其应用前景广阔.且通过响应曲面分析法所获得的最优工艺参数,能有效减少工艺操作的盲目性,从而为进一步试验研究奠定理论基础.
[1]孔祥强.谈蓝莓中花青素的保健功能[J].现代农业科技,2009(15):130-130.
[2]于东,陈桂星,方忠祥,等.花色苷提取、分离纯化及鉴定的研究进展[J].食品与发酵工业,2009,35(3):127-133.
[3]石光,张春枝,陈莉,等.蓝莓果实中花色苷提取工艺的研究[J].食品研究与开发,2008,29(4):7-9.
[4]徐怀德,闫宁环,陈伟,等.黑莓原花色苷超声辅助提取优化及抗氧化研究[J].农业工程学报,2008,24(2):264-269.
[5]KAISU R,LAURA J,SIRPA K,etal.Organ-specific distribution of phenolic compounds in bilberry(Vaccinium myrtillus)and'northblue'blueberry(Vaccinium corymbosum x V.angustifolium)[J].Food Chemistry,2008,110(1):156-160.
[6]师文添,扶庆权.玫瑰茄中花色苷的超声波提取工艺研究[J].食品研究与开发,2010,31(12):86-89.
[7]张学宁,高志华,刘庆忠,等.蓝莓花色苷提取工艺的优化研究[J].河北工业科技,2013,30(2):66-73.
