乳头状甲状腺癌患者中性粒细胞和淋巴细胞比值与肿瘤特征的关系
2014-12-13李培勇严佶祺梁晓飞
孟 泽 ,李培勇,严佶祺,曹 研,梁晓飞
(1.上海交通大学医学院附属瑞金医院;2.上海市仁济医院肿瘤研究所,上海 200025)
近年来,免疫评价指标中性粒细胞与淋巴细胞的比值已被发现和许多肿瘤的病理特征有关联。1990年Letomi发现术前中性粒细胞与淋巴细胞的比值(NLR1)和恶性肿瘤的进展有联系,并提出了NLR1和肿瘤预后有相关性的观点[1]。许多研究显示实体肿瘤中高的NLR1和高的致死率或者高复发率有着联系,例如胃癌,结直肠癌,胰腺癌,肝细胞癌,肾细胞癌,胆管癌[2-5]。
由于甲状腺癌是内分泌最常见的恶性肿瘤,其发生和甲状腺局部及全身炎症反应有关,而甲状腺炎可以诱导机体的免疫系统做出反应[6-7],因此,研究乳头状甲状腺癌病人免疫评价指标(NLR1)与肿瘤相关特征,对进一步了解甲状腺癌患者的免疫状态和肿瘤的生长以及预后影响有一定意义。
1 资料和方法
1.1 研究对象 2012年4月到2013年5月在本院经手术病理确诊为甲状腺癌患者41例,同时选取经脱落细胞穿刺检查确诊为良性甲状腺结节病人35例作为对照组。根据年龄平均值和取值范围,性别比例选定对照组成员。
1.2 实验方法 查询并收集病人基本信息(年龄,性别),血液检测指标(白细胞、单核细胞、淋巴细胞、中性粒细胞、血红蛋白),促甲状腺刺激激素,甲状腺球蛋白和抗甲状腺球蛋白抗体的水平;同时收集甲状腺癌病人的病理信息(是否转移,分期,肿瘤的大小);B超特征(钙化,多发);计算手术前中性粒细胞与淋巴细胞的比值。恶性肿瘤的大小以组织病理学检查中最大的一个为准,由小到大排列,按患者数平均分成3组。良性结节的大小以B超测量为依据,分别进行实验恶性肿瘤组和良性结节对照组之间各指标比较和三组间的比较。
1.3 统计学分析 连续变量用中位数或者四分位间距表示,分类变量用频数以及百分比来表示,两组连续变量的比较用t检验,两组以上的连续变量用方差分析,卡方分析用来比较分类变量之间的差异,相关性的分析运用斯皮尔曼相关性分析,多元性线性回用于分析自变量于因变量间的关系。
2 结果
2.1 良恶性组按NLR1分组各种血液指标与病理指标比较结果 良性结节的平均直径为(0.59±0.39)cm,小于恶性肿瘤(1.52 ±0.72)cm,差异有统计学意义(P=0.040)。TSH值在良、恶性结节分别是(0.94 ±0.56)和 (1.30 ±1.26)mIU·L-1,之间有显著差别(P=0.011)。良性组和恶性组患者良恶组肿瘤大小均有差异 (P=0.024,P=0.001);恶性患者组间ATA危险度的患者数有差别(P=0.035);其余指标包括各种血细胞数值,肿瘤是否多发,有无钙化和甲状腺外的转移等差异均无显著性(P >0.05)(表1,表2)。
2.2 恶性组按NLR2分组各血液指标与病理指标比较结果 手术前后的NLR无差异(P=0.085)。恶性组以术后(NLR2)大小分组,组间肿瘤大小仍有差异(P=0.029),其余指标均无差异(表3)。
2.3 多元性线性回归分析 结果显示在良恶性组中NLR对肿瘤的大小影响效果显著(P=0.036,P=0.019)。Logistic回归分析结果显示NLR对肿瘤患者的预后影响效果显著(P=0.015)(表4)。
2.4 NLR指标与肿瘤特性之间的相关性 NLR和良、恶性结节大小均呈正相关(Spearman’s rho=0.366P=0.03,Spearman’s rho=0.421P=0.006)。恶性肿瘤患者的术前NLR值还和ATA分级呈正相关(Spearman’s rho=0.446P=0.03),按 ATA 分级进行分组的三组患者间,低危组和中危及高危组的NLR值中有两组有明显差异(图1,2)。
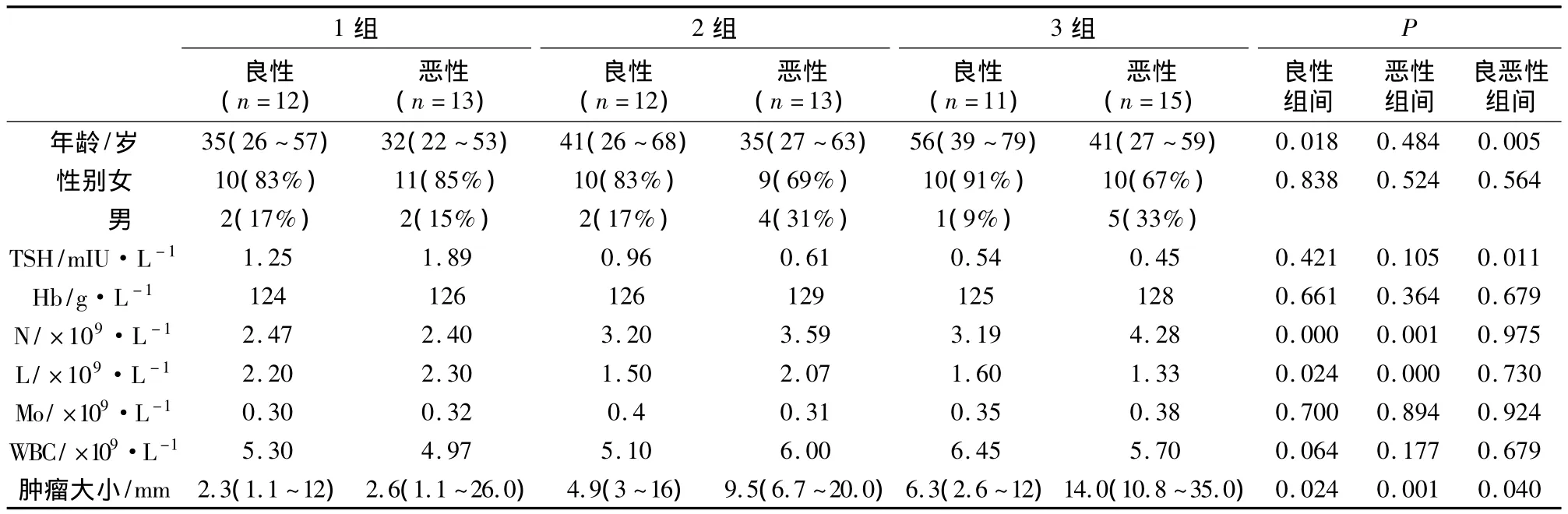
表1 良性组和恶性组分别根据NLR1分成三组进行各指标的比较
2.5 TSH水平对结节的生长的影响 以结节大小1 cm为界,甲状腺癌小于1 cm和大于1 cm的患者TSH 值分别为(0.87 ±0.52)和(1.39 ±0.96)mIU·L-1,两组患者 TSH水平有统计学差异(P=0.042),而在良性结节中不存在此差别(P=0.776)。
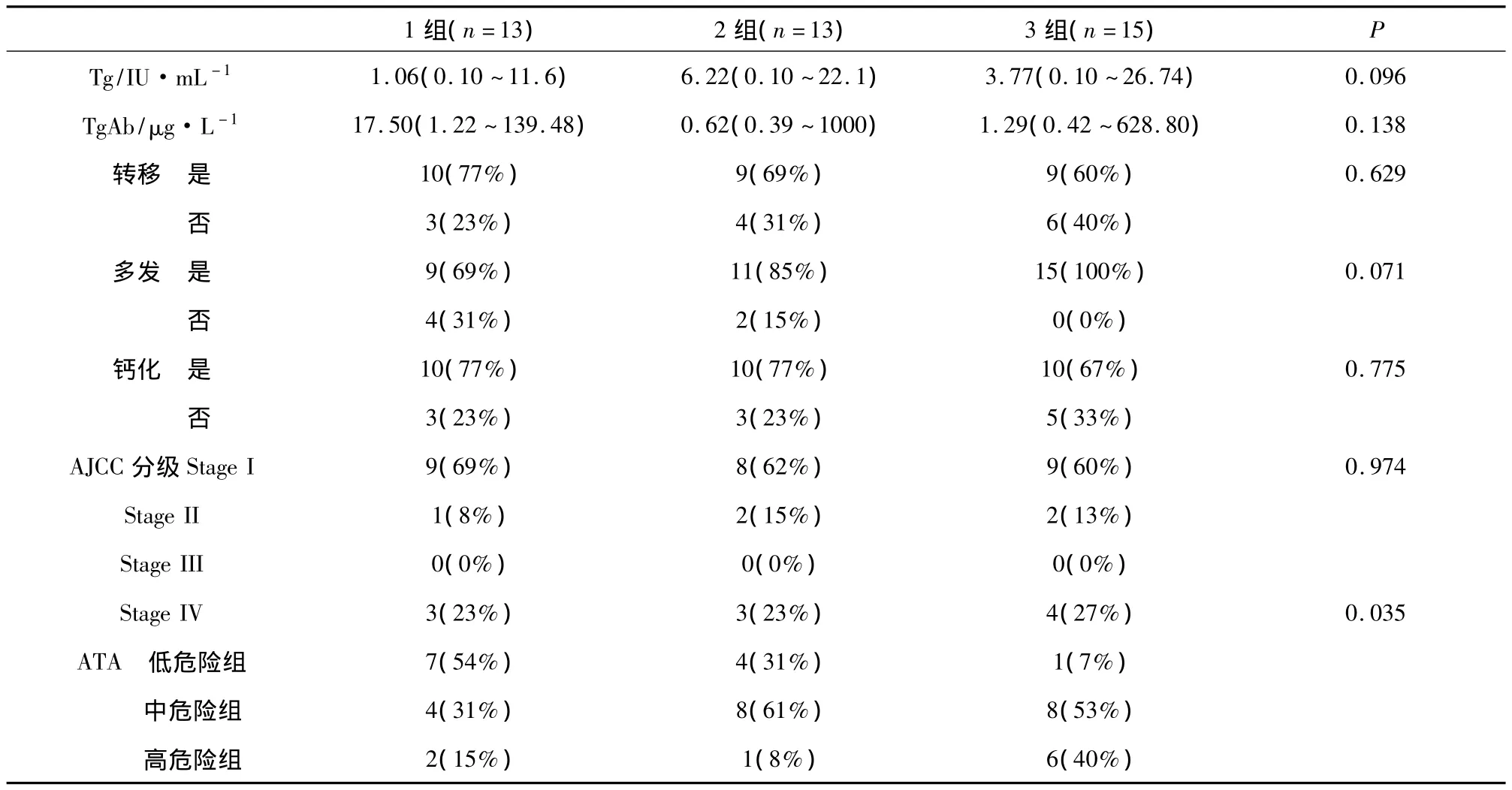
表2 恶性组根据NLR1进行各种病理指标的比较

表3 恶性组根据NLR2分成三组各指标比较
3 讨论
中性粒细胞和淋巴细胞的比值的改变会导致肿瘤的许多免疫调节不平衡,一旦这种不平衡建立了,肿瘤就很有可能失去调节从而快速增殖甚至转移到更适合的微环境中去。本文的研究显示,NLR1和甲状腺恶性肿瘤大小呈正相关,因此将直接地影响了肿瘤的TNM分期。这和已报道的其它肿瘤的相关研究结果一致。随着肿瘤增大,NLR增高,患者的免疫抗炎状态越积极,相对来说就会有一个高的中性粒细胞数值和低的淋巴细胞数值。中性粒细胞可以抑制肿瘤坏死因子-α生成和分泌促进肿瘤血管生成的血管内皮细胞生成因子(VEGF),促进肿瘤的转移和进展[10]。淋巴细胞也是肿瘤免疫的主要成分,肿瘤刺激巨细胞释放α-TNF、干扰素等细胞因子,刺激自然杀伤淋巴细胞,作用于肿瘤组织,造成肿瘤缩小[11]。淋巴细胞的减少会引起肿瘤相关的免疫降低,淋巴细胞浸润越少则预后越差[12]。因此NLR可能是一个可以促进肿瘤生长的不平衡因素,对肿瘤的发生发展和预后有着重要的作用。

表4 对照组实验组多元性线性回归及实验组Logistic回归分析

图1 肿瘤大小与NLR1散点图
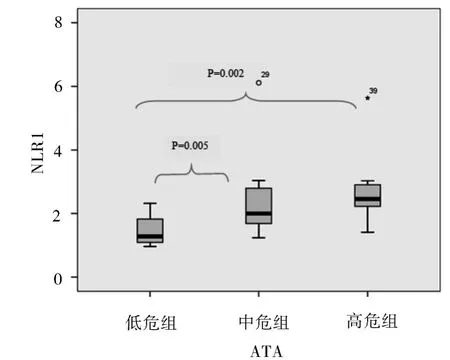
图2 ATA与NLR1盒式图
NLR反映了机体的免疫状态,这也反映在手术切除肿瘤后NLR2与与术前的NLR1并无差别(P=0.085),NLR也与良性结节的大小呈正相关。影响结节的良恶性主要和基因表达有关[13],甲状腺癌的发病与癌基因ret、ras及抑癌基因p53的突变有密切联系[14]。
除了NLR与甲状腺结节的生物学特性有关外,TSH水平可影响甲状腺结节的良恶性及甲状腺癌的生长,本研究显示,不但恶性结节的TSH水平高于良性结节,TSH水平同时还有利于恶性结节的生长。其可能的解释是乳头状甲状腺癌细胞会产生异源性的TSH-R mRNA,增强TSH受体的功能,TSH的功能是抑制肿瘤的凋亡,促进肿瘤新生血管的生成和促进甲状腺组织的不断增生,进而发生癌变[15]。因此,对TSH水平较高的甲状腺结节患者,应该密切随访。
本研究所显示,NLR不但和甲状腺癌大小呈正相关,还和其ATA危险度分层有关,反映了肿瘤的恶性程度和预后,这些结果对今后应用NLR判断甲状腺癌的预后,选择相应的治疗方法有积极意义;同时本研究也为今后从相关免疫方面入手,包括提高淋巴细胞数量来控制结节的生长提供了依据,值得进一步研究。
[1] Letomi K.A study on the role of granulocytes in carcinomabcaringhosts - G/L ratio as a new host indicator[J].Nippon Gan Chiryo Gakkai Shi,1990,25(3):662 -671.
[2] Jin H,Zhang G,Liu X,et al.Blood neutrophil-lymphocyte ratio predicts survival for stages III-IV gastric cancer treated with neoadjuvant chemotherapy[J].World J Surg Oncol,2013,11(24):112 -122.
[3] Mallappa S,Sinha A,Gupta S,et al.Preoperative neutrophil lymphocyte ratio greater than five is a prognostic factor for recurrent colorectal cancer[J].Colorectal Dis,2013,15(21):323 -328.
[4] Teo M,Mohd Sharial MS,McDonnell F,et al.Prognostic role of neutrophil-to-lymphocyte ratio in advanced pancreatic ductal adenocarcinoma:impact of baseline fluctuation and changes during chemotherapy[J].Tumori,2013,99(4):516 - 522.
[5] Mano Y,Shirabe K,Yamashita Y,et al.Preoperative neutrophil-tolymphocyte ratio is a predictor of survival after hepatectomy for hepatocellular carcinoma:A retrospective analysis[J].Ann Surg,2013,258(2):301 -305.
[6] Liotti F,Visciano C,Melillo RM.Inflammation in thyroid oncogenesis[J].Am J Cancer Res ,2012,2(3):286 -297.
[7] Kari S,Flynn JC,Zulfiqar M,et al.Enhanced autoimmunity associated with induction of tumor immunity in thyroiditis-susceptible mice[J].Thyroid ,2013,23(18):1590 -1599.
[8] Qadan M,Ma Y,Visser BC,et al.Reassessment of the Current A-merican Joint Committee on Cancer Staging System for Pancreatic Neuroendocrine Tumors[J].J Am Coll Surg,2013,6:188 -195.
[9] Chen A,Bernet V,Carty SE,et al.American Thyroid Association Statement on Optimal Surgical Management of Goiter[J].Thyroid,2013,2:111 -141.
[10] Joo SY,Kim JE,Kim JY,et al.Usefulness of circulating vascular endothelial growth factor and neutrophil elastase as diagnostic markers of disseminated intravascular coagulation in non-cancer patients[J].Korean J Hematol,2010,45(1):23 -28.
[11] 梁 虹,姚福生,赵海军,等.血液肿瘤患者化疗前后T淋巴细胞亚群检测分析[J].安徽医药,2011,15(11):1391 -1393.
[12] 许秀芳,张 颖,辛 毅,等.器官移植病人外周血淋巴细胞表面蛋白分子表达与移植器官功能和活组织病理学改变时相比较[J].安徽医药,2013,17(7):1130 -1135.
[13] Liao S,Song W,Liu Y,et al.Familial multinodular goiter syndrome with papillary thyroid carcinomas:mutational analysis of the associated genes in 5 cases from 1 Chinese family[J].BMC Endocr Disord,2013,13(1):48 -59.
[14] 丁宝忠,贾宗师,高 峰.等.甲状腺癌ret、ras、p53基因的表达及意义[J].中华内分泌外科杂志,2012,6(1):18 -20.
[15] McLeod DS,Watters KF,Carpenter AD,et al.Thyrotropin and thyroid cancer diagnosis:a systematic review and dose-response metaanalysis[J].ClinEndocrinol Metab,2012,97(8):2682 - 2692.
