G-CSF动员的HLA-Mismatched-BPSC输注联合化疗治疗恶性血液病安全性观察
2014-12-13刘媛媛鲍扬漪
牛 伶,李 坦,汪 毅,刘媛媛,鲍扬漪
(安徽省合肥市第一人民医院血液科,安徽合肥 230061)
对于急性白血病及高危组骨髓增生异常综合症患者,单纯性化疗及自体干细胞移植可提高生存率,但复发率相对较高[1-2];异基因造血干细胞移植减少了复发风险,但移植物抗宿主病(GVHD)发生率及移植相关死亡率高且费用昂贵[3]。目前郭梅等[4]报道显示活化HLA错配的外周血造血干细胞(HLA-mismatched peripheral blood stem cells;Mismatched-BPSC)输注联合化疗治疗老年白血病与单纯化疗的对照组相比显著提高了缓解率与生存率,部分有微崁合,均无GVHD。国外也有数个小样本的临床研究尝试对非移植的难治性、复发性恶性血液病患者给予供者白细胞输注治疗,其方案多样,有供者动员与非动员、输注前给予患者小剂量全身照射预处理与非照射的、HLA相合与错配的等等,取得了一定的疗效,其疗效与植入与否不一致[5-7]。
我科于2012年始对10例恶性血液病患者给予G-CSF动员的HLA-Mismatched-BPSC输注联合化疗,现将其安全性报道如下。
1 材料与方法
1.1 病例资料收集 2012年1月至2013年9月10例在我院接受Mismatched-BPSC输注联合化疗治疗的恶性血液病患者,所有患者均为初治或复发难治恶性血液系统疾病,无HLA相合的供者或因各种原因拒绝行经典造血干细胞移植、PS≤2分;同时未接受过自体或异体干细胞移植、全身照射及氟达拉滨、阿仑单抗等药物治疗;女3例,男7例,年龄28~81岁,中位年龄49岁。按2008年WHO分类、2009NCCN急性髓系白血病(AML)危险度及骨髓增生异常综合征(MDS)国际预后积分系统分组(表1)。所有参与临床试验患者均签署知情同意书,并经医院伦理委员会审查批准。
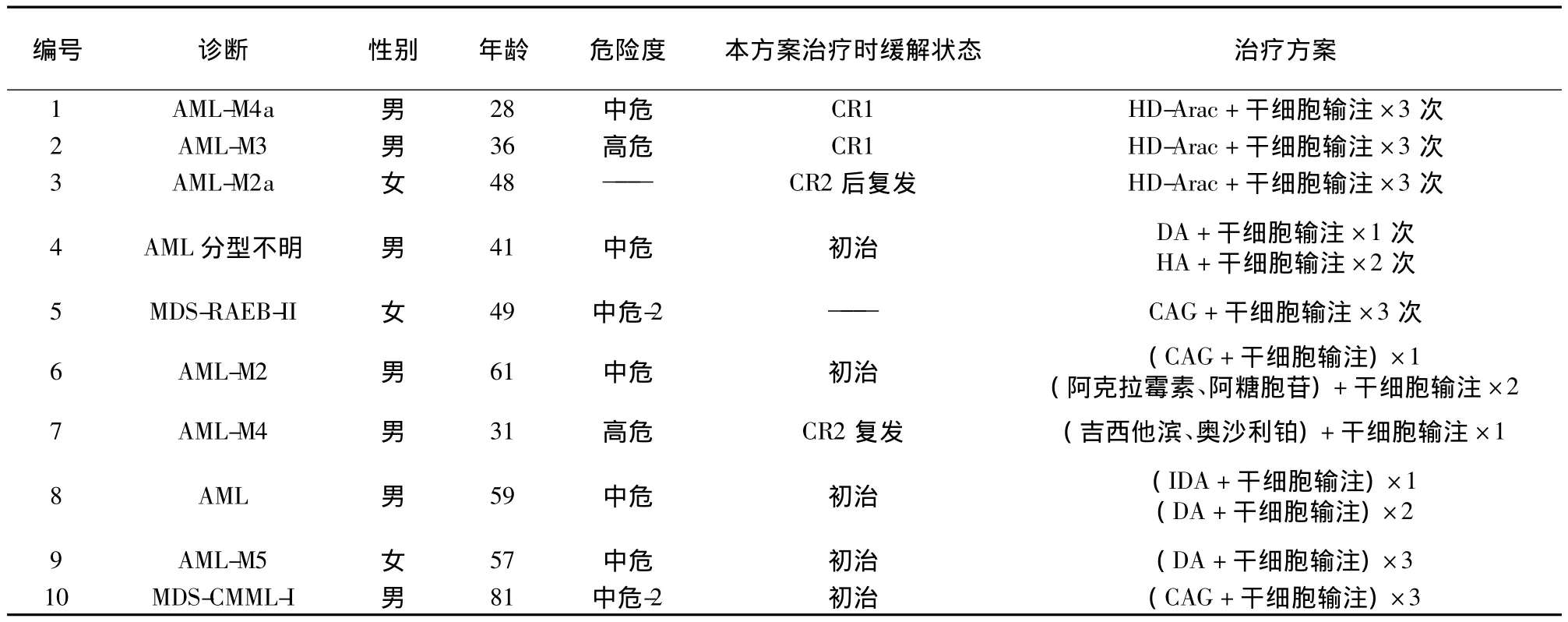
表1 入组患者基础情况及化疗方案
1.2 主要试剂 重组人G-CSF为麒麟鲲鹏(中国)生物药业有限公司生产,GT-T552无血清培养基为日本Takara生物公司生产,细胞因子检测ELISA试剂盒、LDH杀伤检测试剂盒为碧云天生物公司产品,免疫细胞表型鉴定荧光标记抗体均为美国BD Bioseience公司产品。
1.3 HLA高分辨配型、嵌合监测 化疗前入选患者及供者均经实验室行HLA配型。通过聚合酶链反应-测序分型(polymerase chain reaction sequencebased typing,PCR-SBT)对 HLA-A、HLA-B、HLA-C、HLA-DRB1、HLA-DQB1、HLA-DPB1 进行高分辨分型:首先进行位点特异性PCR扩增,以产物作为模板行测序反应。测序反应产物经纯化及变性后电泳,结果由ASSIGN软件(CONEXIO)进行HLA等位基因的分析确认。HLA-Mismatched-BPSC回输后第7天、第14天采用STR-PCR和毛细管电泳片段分析方法对供、受者进行16个STR位点基因型检测并计算嵌合率。
1.4 外周干细胞动员、采集、相关检测及回输HLA-Mismatched-BPSC采自患者健康的直系亲属,采集前供者接受重组人粒细胞集落刺激因子(GCSF)10 μg·kg-1·d-1×5 d,使用费森尤斯卡比血细胞分离机进行外周血干细胞采集,共采集两次。并对外周血干细胞行单核和细胞、CD34+细胞、CD3+细胞进行计数。除首次回输的干细胞外,将采集的剩余细胞置于-196℃液氮中冻存。
1.5 治疗方案 所有患者均未接受免疫抑制处理,HLA-Mismatched-BPSC均在化疗结束24~48 h内输注;首次化疗结束后即第一次回输的HLA-Mismatched-BPSC为新鲜的外周造血干细胞,此后每次配伍化疗回输则为首次采集后冻存的外周血干细胞。患者于回输前口服塞来昔布与地塞米松,本试验中患者接受3次HLA-Mismatched-BPSC回输(图1)。如患者接受化疗后粒细胞低于0.5×109·L-1,则予以重组人粒细胞刺激因子 300 μg·d-1,直至患者粒细胞恢复至正常值。

图1 治疗路线及相关指标检测路线图
1.6 血象恢复时间及不良反应观察 根据张之南《血液病诊断及疗效标准》对患者进行评价;血象恢复时间:中性粒细胞 >0.5 ×109·L-1连续3 d、血小板>30×109·L-1连续3 d。不良反应的评价按照美国国立癌症研究所/NCI《常见不良事件评价标准》(Common terminology criteria for adverse events,CTCAE version 4.0)进行安全评估,分为 I~V级5个级别,Ⅲ~V级不良反应视为严重不良反应。
2 结果
2.1 HLA配型、嵌合度监测 10对供受者均为HLA单倍相合:其中6对供受者在HLA-A/-B/-DR6个位点中有3个位点相合,4对有4个位点相合。例6患者在回输后第7、10天检测出20%嵌合,第14天嵌合检测为0%;其余9例未检测出嵌合。
2.2 HLA-Mismatched-BPSC的采集和回输 经治患者进行化疗的同时接受HLA-Mismatched-BPSC回输3次,平均每次回输给患者CD34+细胞为(0.9~10.2)×106·kg-1;单个核细胞数量为(1.6 ~8.9)×108·kg-1;CD3+细胞数量为(0.22 ~2.4)×108·kg-1(表2)。

表2 平均回输的单核和细胞、CD34+细胞、CD3+细胞进行计数
2.3 不良反应 10例患者在化疗联合干细胞输注治疗后24 h内均出现不同程度的发热,最高可达39.4℃,予以抗感染及激素治疗后24 h内体温恢复正常,维持3 d以上。所有经治患者均未见肝损、出血、腹泻、水肿等GVHD发生。其中5例患者接受细胞输注时 CD3+T 细胞≥1.5 ×108·kg-1,在接收细胞输注后24 h内胸、腹部及四肢出现皮疹,采用对症治疗后2 d内迅速缓解。
2.4 患者行HLA-Mismatched-BPSC输注联合化疗与自身仅化疗时血象恢复时间对比 本次入组患者有4例可进行自身对比,见表3。
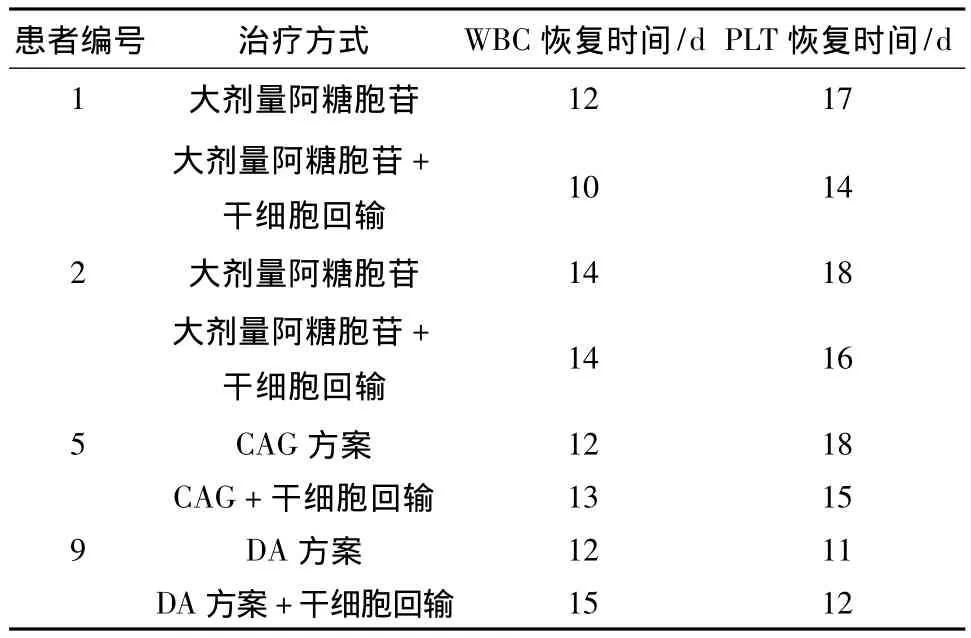
表3 患者血象恢复时间对比
2.5 疗效评价 5例外周血干细胞输注联合化疗初治患者均完全缓解,随访时间3~22个月。3例外周血干细胞输注联合化疗巩固患者均完全缓解,目前随访6~34个月。2例外周血干细胞输注联合化疗复发患者,1例髓外复发病灶短暂消失,此后失访,1例未缓解。
3 讨论
目前比较一致的观点认为异基因移植患者的免疫抑制及输注的干细胞数量是确保移植物植入及诱发GVHD重要原因。有报道对13例难治性实体肿瘤及12难治性恶性血液病行100 cGy的全身照射及非动员异基因淋巴细胞输注治疗。其中实体肿瘤患者6例接受脐血输注,7例接受同胞淋巴细胞输注;血液病患者1例接受脐血输注,11例接受同胞淋巴细胞输注;18例同胞供受者之间,17例为全相合,1例为5/6匹配。实体肿瘤患者本方法治疗前未接受高强度化疗,而恶性血液病患者治疗前均不同程度接受含免疫抑制剂的高强度化疗。实体肿瘤患者均为检测出嵌合。恶性血液病患者9例发生嵌合。范围从5%到100%,其中5例发生GVHD[5]。Colvin等报道对15例性实体肿瘤及26难治性恶性血液病行100 cGy的全身照射及半相合异基因外周干细胞输注治疗。29患者接受至少1×108·kg-1CD3+细胞输注,其中10例检测出短暂嵌合,有两例达100%嵌合,其中1死于GVHD;另外12接受较低剂量 CD3+细胞输注者未检测出嵌合[6]。提示嵌合与否决定于免疫抑制的程度及输注的干细胞数量。Strair等报道了16例自体造血干细胞移植患者接受异基因淋巴细胞输注,有4例发生GVHD,其在淋巴细胞输注前曾接受免疫抑制治疗;而其余未接受免疫抑制治疗12例患者,无此现象发生[8]。本研究中仅1例发生短暂嵌合,其余9例未观测到嵌合发生,本试验中所有患者在化疗配伍干细胞输注前均未接受过免疫抑制治疗,故推测因保留了自身的免疫功能,从而排斥移植物的植入因而未能发生嵌合;没有一例发生GVHD也可说明这一点。其中1例患者输注的较大剂量的CD34+细胞,而出现短暂嵌合,提示输注的干细胞数量对移植物的植入起一定作用。国内有报道101例大剂量化疗联合体外处理的干细胞输注治疗急性白血病,4例发生短暂嵌合,无1例发生GVHD也证明了以上推测,该报道对23例患者进行微嵌合检测,其中20例阳性[9];而本实验中是未经处理的干细胞直接输注,且未行微嵌合检测,故是否存在微嵌合有待进一步检测及研究。另一种可能是由于输注的细胞包含有造血干细胞、祖细胞、NK细胞,其能调节TH1/TH2细胞平衡,而防止GVHD发生。
目前有研究表明对难治性恶性血液病患者进行HLA-Mismatched-BPSC输注,CD3+细胞输注量不少于1×108·kg-1的患者在输注后出现发热、皮疹、腹泻及水肿等不良反应,同时检测到输注后IL-5、IL-6、IL-8 、IL-10、IFN-γ 等细胞因子明显增高;患者出现的相关症状与体征考虑与外周血干细胞输注后患者机体释放各种细胞因子引起[6]。本研究中患者无论输注的CD3+细胞量多少,接受治疗后均出现发热现象在予以包含激素的治疗后短时间内恢复正常,且维持3 d天以上,皮疹在激素治疗后迅速缓解,也提示这种类过敏现象的发生可能为机体释放各种细胞因子引起——即所谓的细胞因子风暴(cytokine storm)。值得注意的是,本实验中患者输注的HLA-Mismatched-BPSC是一群异质细胞,其中患者每次接受的干细胞中含有较多的CD3+T细胞,且其中含有一定数量的NK细胞,异体T、NK细胞注入,可能是造成患者输注后发热、皮疹等应激反应的原因。根据John L Reagan[10]的试验结果,这种过敏反应的发生往往预示着较好的应答率与治疗预期。
郭梅等[9]报道了101例大剂量化疗联合体外处理的干细胞输注治疗急性白血病的文章中,发生微嵌合的患者其血细胞恢复时间较单纯化疗对照组有所缩短。在本研究中HLA-Mismatched-BPSC输注联合化疗相对单纯化疗,患者血细胞恢复时间有缩短倾向,与上述报道一致;推测这是由于输注的细胞包含有造血干细胞、祖细胞,其能促进患者造血恢复;另一个可能即输注的干细胞与G-CSF共同促进了患者造血恢复,其机制有待进一步研究。
报道[6]显示对26例难治恶性血液病患者进行异基因血细胞输注,部分患者可重新获得缓解,其推测是由于外周血干细胞输注打破了患者对肿瘤细胞的免疫耐受,激活了患者免疫系统起到抗肿瘤作用,而非移植物抗肿瘤效应。本研究中8例为完全缓解,1例髓外复发患者病灶有短暂的消失。干细胞输注后9例无嵌合发生,故可排除移植物抗白血病效应;由于本研究为HLA-Mismatched-BPSC输注联合了化疗,缺乏仅化疗患者对照组、随访时间较短,HLA-Mismatched-BPSC输注是否具有非特异性抗肿瘤作用和其对长期生存时间的影响有待进一步对比与跟踪。
[1] Mayer RJ,Davis RB,Schiffer CA,et al.Intensive postremission chemotherapy in adults with acute myeloid leukemia[J].N Engl J Med,1994,331(14):896 -903.
[2] Cutler CS,Lee SJ,Greenberg P,et al.A decision analysis of allogeneic bone marrow transplantation for the myelodysplastic syndromes:delayed transplantation for low-risk myelodysplasia is associated with improved outcome[J].Blood,2004,104(2):579 -585.
[3] Sakamaki H,Miyawaki S,Ohtake S,et al.Allogeneic stem cell transplantation versus chemotherapy as post-remission therapy for intermediateor poor risk adult acute myeloid leukemia:Results of the JALSG AML97 study[J].Int J Hematol,2010,91(2):284 -292.
[4] Guo M,Hu KX,Yu CL,et al.Infusion of HLA-mismatched peripheral blood stem cells improves the outcome of chemotherapy for acute myeloid leukemia in elderly patients[J].Blood,2011,117(3):936-941.
[5] Ballen KK,Becker PS,Emmons RVB,et al:Low-dose total body irradiation followed by allogeneic lymphocyte infusion may induce remission in patients with refractory hematologic malignancy[J].Blood,2002,100(2):442 -450.
[6] Colvin GA,Berz D,Ramanathan M,et al.Nonengraftment haploidentical cellular immunotherapy for refractory malignancies:tumor responses without chimerism[J].Biol Blood Marrow Transplant,2009,15(4):421 - 431.
[7] Reagan JL,Fast LD,Winer ES,et al.Nonengraftment haploidentical cellular therapy for hematologic malignancies[J].Adv Hematol,2012,2012(2):784213.
[8] Strair RK,Schaar D,Medina D,et al.Antineoplastic effects of partially HLA-matched irradiated blood mononuclear cells in patients with renal cell carcinoma[J].J Clin Oncol,2003,21(20):3785 -3791.
[9] Guo M,Hu KX,Liu GX,et al.HLA-Mismatched Stem-Cell Microtransplantation As Postremission Therapy for Acute Myeloid Leukemia:long-Term Follow-Up [J].J Clin Oncol,2012,30(33):4084-4090.
[10] Reagan JL,Fast LD,Safran H,et al.Cellular immunotherapy for refractory hematological malignancies[J].Transl Med,2013,6(11):150.
