茶多酚对大鼠创伤性颅脑损伤的脑保护作用
2014-12-13朱振丹刘佰运
朱振丹,茆 翔,刘佰运,3,4
(1.安徽医科大学武警总医院临床学院;2.武警总医院神经创伤外科,北京 100039;3.北京市神经外科研究所;4.首都医科大学附属北京天坛医院,北京 100050)
目前创伤性颅脑损伤已经严重威胁到人类生存健康,据报道在人类各种创伤疾病中,颅脑创伤的发病率占第2位,死亡率占第1位,治疗起来非常棘手,在美国每年约有1 700 000人会发生颅脑创伤[1]。在国内可能由于统计样本量以及治疗条件所限,每年大约有60万人发生创伤性颅脑损伤,在这其中死亡人数约在10万人左右,造成的经济损失达100亿元以上,部分幸存者往往伴有短期或长期认知功能障碍,创伤性颅脑损伤的发生机制复杂,已经有报道称高压氧能通过提高动脉血氧分压,氧弥散率及有效弥散距离来改善脑组织的用氧代谢,减少脑水肿[2],另外氧化应激损伤被认为是导致创伤性脑水肿的重要机制。
茶多酚(Tea Polyphenols)是茶叶中酚类及其衍生物的总称,是茶叶中的主要活性成分,茶多酚的主要组分是黄烷醇类、花色苷类、黄酮醇类和黄酮类等。由于具有2-苯基苯并呲喃的基本结构,故统称为黄酮类物质,茶多酚因含酚性羟基故极易发生氧化、聚合、缩合等变化,具有较好的抗氧化、清除自由基的能力,它是目前报道的抗氧化作用最强的药物之一。茶多酚应用广泛,据文献报道茶多酚被应用于对皮肤的保护[3],茶多酚可以有效地抑制环境诱导的乳腺癌[4],抑制自身免疫性疾病[5]。
由于在颅脑创伤后所致的脑水肿中,氧化应激被认为是其中重要的机制之一,结合茶多酚的抗氧化作用,本实验拟探讨茶多酚在颅脑外伤中的脑保护作用及其作用机制。
1 材料与方法
1.1 材料 茶多酚购于 Sigma公司,美国,批号E4143。实验动物:选用成年健康雄性SD大鼠,体重为(300±30)g,由北京维通利华实验动物技术有限公司提供,动物许可证号[SCXK(京)2012-0001]。
1.2 实验分组 本实验分为三组:对照组(n=32)、模型组(n=32)和给药组(n=32)。给药组大鼠腹腔注射茶多酚(200 mg·kg-1),模型组大鼠腹腔注射等量的生理盐水,注射时间为打击后30 min,各组动物均于24 h后采用过量麻醉的方式(800 mg·kg-1)断头处死。
1.3 动物模型的建立 SD大鼠采用10%水合氯醛(400 mg·kg-1)腹腔注射麻醉。采用无菌操作程序,在不损毁硬脑膜的情况下手术小心地移去头颅帽,将大鼠放置于立体定位架内。打击头垂直于暴露的皮层表面。实验中打击器参数设置为:接触速率设置为2.0 m·s-1,打击深度设置为2.5 mm,停留时间设置为85 ms。在实验期间大鼠的核心体温保持在36~37℃。模型组和给药组均采用上述方法进行去骨瓣打击,而对照组仅开骨窗去除骨瓣而不打击。
1.4 神经功能缺损评分 神经功能缺损评分从感觉实验、横梁平衡实验、反射实验等方面对动物进行神经功能缺损评分,最高18分,分数越高表示神经功能缺损程度越重,对各组实验动物在打击24 h后进行神经功能缺损评分,各组于同等时间进行评分,采用双盲法进行。
1.5 脑含水量的测定 采用干湿重法测脑组织含水量,于打击24 h后,每组8只大鼠,过量麻醉后立即断头取脑切成左右两半,用电子天平称取病灶侧半球的重量,然后置于100℃烤箱内烤24 h,用同一天平再次称重,以[(湿重)干重)/湿重×100%]即为相对含水量。
1.6 BBB通透性测定 本实验用伊文氏蓝(evens blue,EB)测定BBB通透性。大鼠处死前2 h,自股静脉注入2%EB溶液(20 mg·kg-1),接下来的2 h用于平衡。大鼠脑组织取出后加甲酰胺溶液3 mL,之后加盖避光并于54℃水浴箱中提取1 d,在紫外分光光度计下测量提取液的光密度值(OD值),使用分光光度计(620~680 nm)测得其吸光度,计算脑组织中EB含量。
1.7 Western blot检测水肿相关蛋白 AQP4、MMP-9的表达情况 裂解的蛋白于100℃水浴10 min后,上样于10%SDS-聚丙烯酰胺凝胶中电泳,80 V、30 min 和 100 V、90 min 后,经 200 mA、120 min 将蛋白从胶上转印到孔径 0.2 μmol·L-1的硝酸纤维素膜上。将该膜浸于含50 g·L-1脱脂奶粉的1×TBST中室温轻摇60 min以封闭非特异性结合位点。1×TBST洗3次、每次5 min。加入一抗(水肿相关蛋白兔抗血清,1∶1 000;β-actin羊抗血清为内参照,1∶2 000)在室温下孵育1 h后,移去一抗,1×TBST洗3次,每次5 min。加入二抗(辣根过氧化物酶标记的抗羊和抗兔IgG,1∶5 000)在室温下作用1 h,移去二抗,1×TBST浸洗3次。按 Amer对照Pharmacia公司手册用增敏的化学发光底物(ECL)进行显影。
2 结果
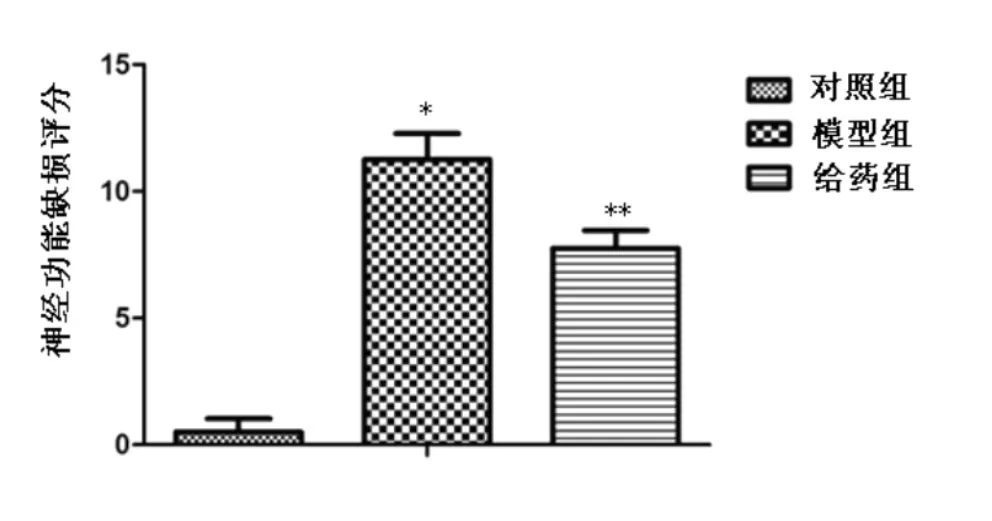
图1 神经功能缺损评分
2.1 神经功能缺损评分和脑含水量 分别见图1和图2,模型组的神经功能缺损评分和脑含水量明显高于对照组(P<0.05),表明模型制作成功。给药组的神经功能缺损评分和脑含水量高于对照组(P<0.05),给药组的神经功能缺损评分和脑含水量低于模型组(P<0.05),表明打击能够降低动物的神经功能缺损评分,但茶多酚能够提高动物的神经功能评分。
2.2 BBB通透性 从图3中可以看出模型组伊文氏蓝含量高于对照组(P<0.05),表明打击破坏了血脑屏障,增加了BBB通透性,而给药组伊文氏蓝含量明显低于模型组(P<0.05),但又明显高于对照组(P<0.05),表明给药组能够明显减少BBB的开放程度,降低其通透性。
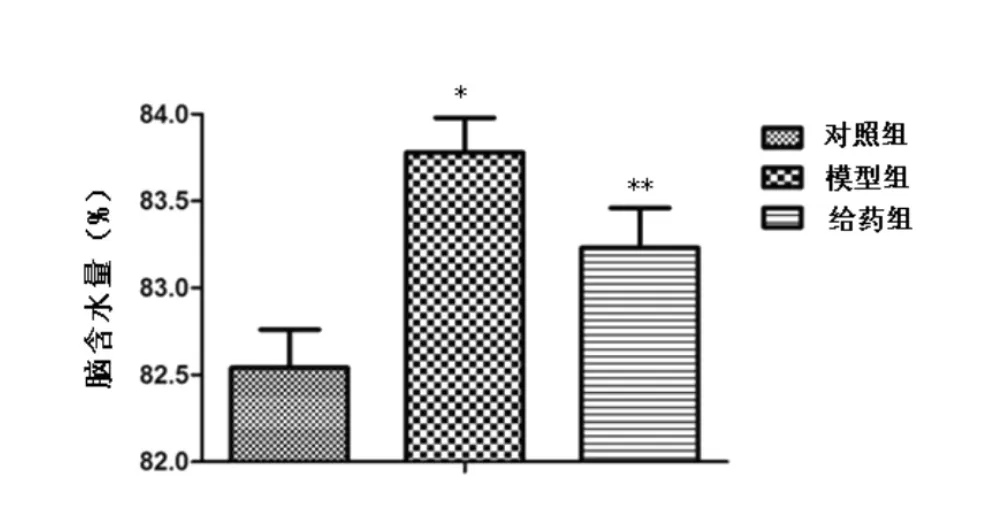
图2 脑含水量
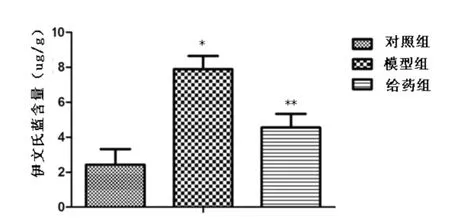
图3 伊文氏蓝含量
2.3 Western blot检测结果 与对照组比较,模型组中AQP4/MMP-9蛋白表达有相似程度的增加(P<0.05),而给药组与模型组相比AQP4/MMP-9蛋白表达减少(P<0.05)见图4和图5。另外,给药组AQP4/MMP-9蛋白表达高于对照组(P<0.05)。这显示打击使得AQP4/MMP-9蛋白表达增加,但是茶多酚能够降低AQP4/MMP-9蛋白的表达。
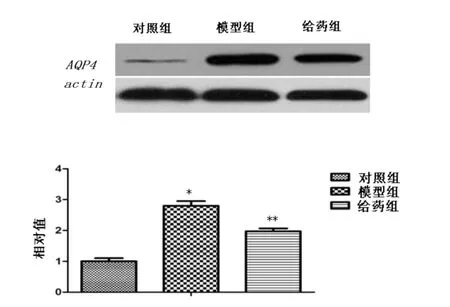
图4 Western blot检测结果

图5 Western blot检测结果
3 讨论
外伤对脑组织的损伤包括原发性损伤和继发性颅脑创伤,继发性的脑损伤包括脑出血和脑水肿,外伤后导致的脑水肿主要分为血管源性脑水肿和细胞性脑水肿。血管源性脑水肿的病理基础是血脑屏障结构与功能的损害[6],颅脑损伤后机械性损伤导致血脑屏障破坏,脑血管内皮细胞间的连续性中断和内皮细胞内的胞饮小泡增加,导致毛细血管通透性增加,这样血中大分子物质及水分就会从脑血管内渗出从而进入脑组织内,累积于脑细胞外间隙,从而导致了血管源性脑水肿,针对血管源性脑水肿的治疗能够减轻创伤对脑功能的影响[7]。
长期以来,人们一直认为水通过细胞膜的方式是通过单纯扩散实现的,没有特定的门控通道。然而随着水通道蛋白(aquaporin,AQP)的发现颠覆了以往人们对细胞性脑水肿的认识。近年来的各种研究证明,AQP4在脑水肿中起到了重要的作用[8],它主要分布于星形胶质细胞核室管膜细胞的质膜上,尤其大量分布于星形胶质细胞终突末端,参与形成围绕毛细血管的血脑屏障,AQP4的位点表明其主要参与脑实质及脑脊液于脑微血管之间的水的运输以及渗透压的调节[9]。本实验研究发现Western blot结果显示给药组AQP4的表达明显大于对照组,但是同时也明显小于模型组,与前人的实验结果基本一致。
颅脑外伤导致血管结构的改变激发了凝血机制的启动,后者导致了快速的血管内反应,进而引起了血管内凝血及外伤周围区域血流量显著下降,在脑外伤模型中,BBB对大分子量蛋白的开放对脑组织病理生理功能的改变起到主要作用,而非脑血管壁的物理性损坏。血脑屏障是机体最重要的内部屏障之一,由脑毛细血管内皮细胞、基膜和胶质细胞足突共同组成[10],血脑屏障功能的变化和紧密连接的开放与闭合有关,而紧密连接开放与否与相关蛋白表达关系密切。越来越多的证据表明matrix metalloproteinases,MMPs可以分解紧密连接复合体及降解基膜而破坏BBB的完整性,从而导致血管源性脑水肿的形成[11]大量的实验表明抑制MMP-9的表达能够减少血脑屏障的开放、减轻脑水肿[12-13]本实验的结果发现给药组的BBB破坏程度、水肿相关蛋白MMP-9明显大于对照组,但是同时也明显小于模型组。
现在的研究已经证实氧化应激在创伤性颅脑损伤所致的脑水肿中是重要的机制之一,我们推测茶多酚具有脑保护的作用可能通过其具有的强烈的抗氧化作用而产生的效果,茶多酚的抗氧化作用使得大鼠在经过创伤性颅脑损伤后,减少了水肿相关蛋白AQP4和MMP-9的表达,从而减轻脑水肿达到脑保护的作用。
4 结论
当给予大鼠腹腔注射茶多酚之后,我们发现茶多酚能够明显的降低水肿相关蛋白AOP4、MMP-9的表达,从而抑制脑水肿的发生发展,进而能够减少大鼠血脑屏障的破坏,提高大鼠的神经功能表现,从而达到了脑保护的作用。
[1] Dean PJ,O'Neill D,Sterr A.Post-concussion syndrome:prevalence after mild traumatic brain injury in comparison with a sample without head injury[J].Brain Inj,2012,26(1):14 -26.
[2] 郑永汉,元少鹏,罗 伟,等.应用高压氧治疗脑外伤失语症的临床效果观察[J].安徽医药,2012,16(4):477 -478.
[3] OyetakinWhite P,Tribout H,Baron E.Protective mechanisms of green tea polyphenols in skin[J].Oxid Med Cell Longev,2012,2012:560682.
[4] Rathore K,Wang HC.Green tea catechin extract in intervention of chronic breast cell carcinogenesis induced by environmental carcinogens[J].Mol Carcinog,2012,51(3):280 -289.
[5] Wu D,Wang J,Pae M,et al.Green tea EGCG,T cells,and T cellmediated autoimmune diseases[J].Mol Aspects Med,2012,33(1):107-118.
[6] Lopez NE,Krzyzaniak MJ,Costantini TW,et al.Vagal nerve stimulation decreases blood-brain barrier disruption after traumatic brain injury[J].J Trauma Acute Care Surg,2012,72(6):1562 -1566.
[7] 张 婷,高晓平.脑卒中后认知功能障碍的康复治疗与进展[J].安徽医药,2013,17(8):1414 -1416.
[8] Ding Z,Zhang J,Xu J,et al.Propofol administration modulates AQP-4 expression and brain edema after traumatic brain injury[J].Cell Biochem Biophys,2013,67(2):615 -622.
[9] Badaut J,Fukuda AM,Jullienne A,et al.Aquaporin and brain diseases[J].Biochim Biophys Acta,2014,1840(5):1554 -1565.
[10] Liu J,Jin X,Liu KJ,et al.Matrix metalloproteinase-2-mediated occludin degradation and caveolin-1-mediated claudin-5 redistribution contribute to blood-brain barrier damage in early ischemic stroke stage[J].J Neurosci,2012,32(9):3044 -3057.
[11] Lin Y,Pan Y,Wang M,et al.Blood-brain barrier permeability is positively correlated with cerebral microvascular perfusion in the early fluid percussion-injured brain of the rat[J].Lab Invest,2012,92(11):1623 -1634.
[12] Wang JJ,Huan SK,Hsieh KH,et al.Inhibitory effect of midazolam on MMP-9,MMP-1 and MMP-13 expression in PMA-stimulated human chondrocytes via recovery of NF-κB signaling[J].Arch Med Sci,2013,9(2):332 - 339.
[13] Cui J,Chen S,Zhang C,et al.Inhibition of MMP-9 by a selective gelatinase inhibitor protects neurovasculature from embolic focal cerebral ischemia[J].Mol Neurodegener,2012,7:21.
