3个藜蒿品种的快速繁殖研究
2014-12-12张建蒋细旺
张建,蒋细旺
(江汉大学生命科学学院,武汉,430056)
藜蒿(Artemisia selengensis),别名蒌蒿,芦蒿,水艾等,为菊科多年生宿根性草本植物[1],蒌蒿味甘性凉,具有祛风湿、健脾胃、平抑肝火、化痰、助消化等功效[2]。藜蒿营养丰富,据测定,每100 g嫩茎含有蛋白质 3.70 g、脂肪 0.64 g、铁 2.9 mg、胡萝卜素4.0 mg、维生素 C 3.73 mg、维生素 B 0.28 mg、尼古酸 1.27 mg、天门冬氨酸20.4 mg、谷氨酸 3.43 mg、赖氨酸0.97 mg,并含有丰富的微量元素和酸性洗涤纤维等[3]。
藜蒿膳食纤维含量高,其TDF(总膳食纤维)占鲜质量的3.95%、干茎的50%以上,SDF(可溶性膳食纤维)在总膳食纤维中所占比重较大(SDF/TDF=34.88%),IDF(不溶性膳食纤维)持水性好,溶胀力强,所含果胶比例较高。这些特性表明,藜蒿是极好的膳食纤维源[4,5]。
目前随着农业种植结构的调整和市场的需要,在湖北省,藜蒿种植面积也逐年增加。武汉市成为华中地区藜蒿的优势产区,特别是在武汉市蔡甸区,藜蒿已经成为当地三大主导特色蔬菜之一。藜蒿种植使当地经济产值显著提高,当地藜蒿种植面积达到4 500 hm2以上,且平均每年每667 m2总产值可达10 000元[6]。
通过对藜蒿进组织培养,可加快藜蒿的繁殖速度,实现大规模工厂化生产,保证市场的全年供应,进而为藜蒿药用、保健等深层次的加工提供原料基础[7]。
近年来,藜蒿的组织培养集中在以藜蒿幼叶[8,9]、嫩茎[9,10]、离体茎尖[11]、嫩芽[12]等为外植体的研究,本试验用目前武汉市种植的3个藜蒿主栽品种为材料,以茎段为外植体,研究不同藜蒿品种的最适激素浓度,从而实现藜蒿的高效快速繁殖,为农业产业结构调整和农业增效、农民增收服务。
1 材料与方法
1.1 试验材料
本试验采用云南藜蒿、楚天藜蒿、香藜一号3个藜蒿品种,材料均由武汉荷香源农业发展有限公司提供。
1.2 试验方法
先将藜蒿茎段在流水下冲洗1 h,然后在超净工作台上,先用75%的酒精消毒30 s,无菌水冲洗3~4 次,再用 0.1%升汞(HgCl2)消毒 3 min,用无菌水冲洗5~6次,升汞消毒重复2次,将茎段接种在愈伤组织诱导培养基上。
①不同IAA、6-BA浓度对愈伤组织诱导的影响 以 MS为基本培养基,附加 6-BA(0.5、1.0、1.5 mg/L)、IAA(0.1、0.5、1.0 mg/L),进行两因素组合,共计9个组合,并设1组空白对照,记为A1~A10。每个组合5瓶,每瓶接4个茎段。黑暗条件下培养,15 d后开始观察,统计愈伤组织诱导率、愈伤组织形成所用时间及生长情况。愈伤组织诱导率(%)=形成愈伤组织的茎段数/接种茎段总数×100%。
②不同NAA、6-BA浓度对愈伤组织增殖的影响 以MS为基本培养基,研究不同NAA、6-BA浓度对愈伤组织增殖的影响,MS培养基中附加6-BA(0.5、1.0、1.5 mg/L)、NAA(0.1、0.5、1.0 mg/L),共设9个组合,并设1组空白对照,记为B1~B10。30 d后统计增殖系数,增殖系数=茎段发生的不定芽总数/接种茎段总数。
③不同IBA、NAA浓度对生根诱导的影响 以1/2 MS为基本培养基,采用二因素四水平完全随机区组试验,分别附加 IBA(0.1、0.4、0.7、1.0 mg/L)、NAA(0.1、0.4、0.7、1.0 mg/L),试验组合分别记为 C1~C9。2周后统计生根率、平均根数、平均根长。
以上培养基中加蔗糖30 g/L、琼脂7 g/L,高压灭菌前调 pH 值为 5.8~6.0,培养温度为(24±2)℃,日光灯光源光照强度为2 000~2 400 lx,光照时问为16 h/d。继代周期为30 d,试验重复3次。
④无菌苗的移栽 将装有生根的无菌苗的培养瓶移至通风有散射光处炼苗48 h,打开瓶盖,小心洗净根部培养基,移栽到消过毒的河沙中,1周后统计成活率。
1.3 数据处理及分析
试验重复3次,数据采用SPSS 19.0软件进行差异显著性分析(Duncan's新复极差法,p=0.05)。
2 结果与分析
2.1 不同IAA、6-BA浓度对愈伤组织诱导和分化的影响
观察发现,接种15 d后,外植体切口处开始膨大并且呈纺锤形,愈伤组织开始分化,20 d左右,愈伤组织的颜色开始变深。较好的愈伤组织质地紧密、颜色较深、表面出现较多绿色突点,后期可以形成健壮生长的丛生芽;生长不好的愈伤组织颜色为浅黄绿色,质地疏松,体积偏小,后期难以形成健壮的丛生芽,或者丛生芽细小,难以生长。说明不同激素组合对不同品种藜蒿愈伤组织诱导的影响存在显著差异。
由表1可知,本试验中不同IAA、6-BA浓度对藜蒿愈伤组织诱导率不同,不同品种达到最高愈伤组织诱导率时,激素浓度组合不相一致。当6-BA浓度为1.0 mg/L、IAA浓度为0.5 mg/L时,云南藜蒿愈伤组织诱导率最高,达到94%,且生长状况总体较好,而最适合楚天藜蒿和香藜一号愈伤组织诱导的激素浓度分别是6-BA 1.5 mg/L、IAA 1.0 mg/L和6-BA 1.5 mg/L、IAA 0.5 mg/L,且诱导率均能达到96%。大量的试验表明,外植体的基因型对其再生能力有直接的影响,外植体再生能力由染色体上的基因操控,因此不同基因型的外植体对愈伤组织诱导的最佳培养基是不一样的[13]。
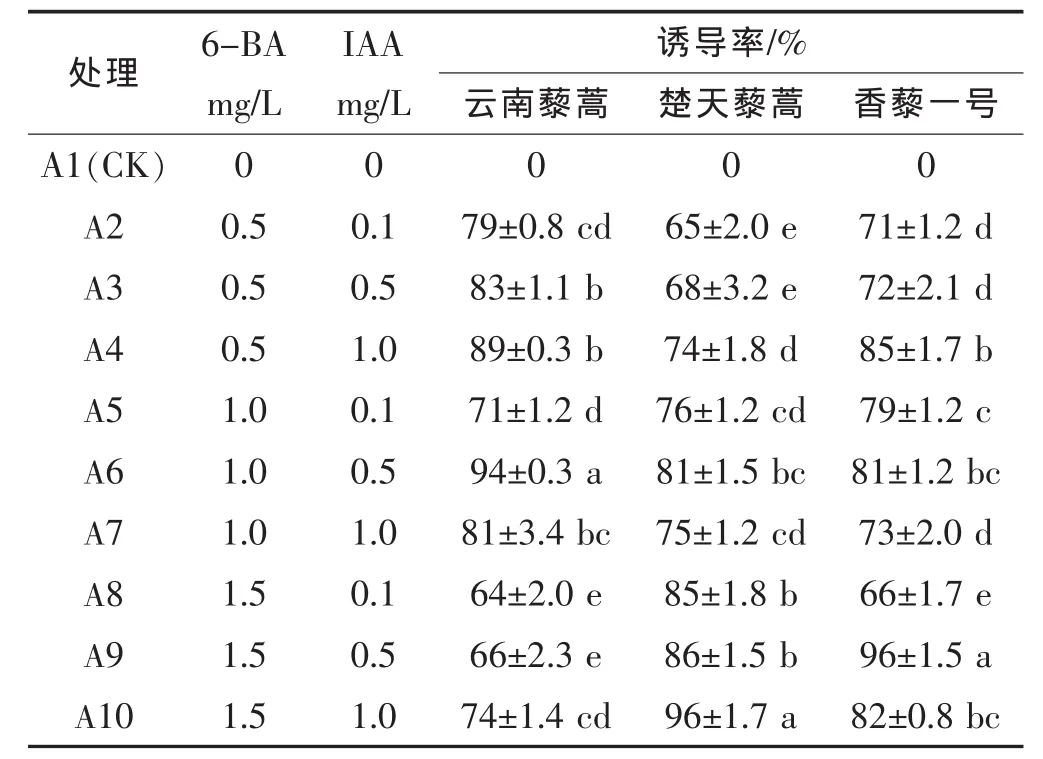
表1 不同IAA、6-BA浓度对愈伤组织诱导的影响
2.2 不同NAA、6-BA浓度对芽丛增殖的影响
将初代培养的芽丛分离,接种于增殖培养基上,14 d后,芽丛基部开始形成大量幼芽。由表2可以看出,不同浓度的激素组合对藜蒿芽丛增殖的影响差异显著,并且激素组合对不同品种藜蒿芽丛增殖的影响存在显著差异。当6-BA浓度为1.0 mg/L、NAA浓度为0.1 mg/L时,云南藜蒿芽丛增殖系数最高;而楚天藜蒿、香藜一号芽丛增殖系数最高时,激素浓度均为6-BA 1.0 mg/L、NAA 0.5 mg/L。
2.3 不同IBA、NAA浓度对生根诱导的影响
将增殖后获得的较为健壮的组培苗转入不含激素的MS培养基培养2周,以消除前设激素的影响[14],然后转入生根培养基中,15 d后统计生根情况。从表3可以看出,植株生根过程中,NAA对生根的促进作用明显大于IBA,相同激素浓度下,4个添加NAA的1/2 MS处理的组培苗的生根率与4个添加IBA的1/2 MS处理的相当或更高,4个添加NAA的1/2 MS处理的平均根数与平均根长也比添加IBA的1/2 MS及空白对照处理提高,说明NAA对藜蒿组培苗根的形成有明显的促进作用。在NAA浓度为0.1 mg/L时生根率最高,且植株生根数与根长都是最大的。综合生根率、平均根数、平均根长来看,添加0.1 mg/L NAA的1/2 MS培养基的优势最大。
2.4 移栽成苗
当无菌苗长5 cm左右、叶片舒展时,将培养瓶移至室温通风有散射光处,去除封口膜炼苗48 h,洗净幼苗根部培养基后移栽到消过毒的河沙中,1周后,幼苗成活率均达到90%以上。
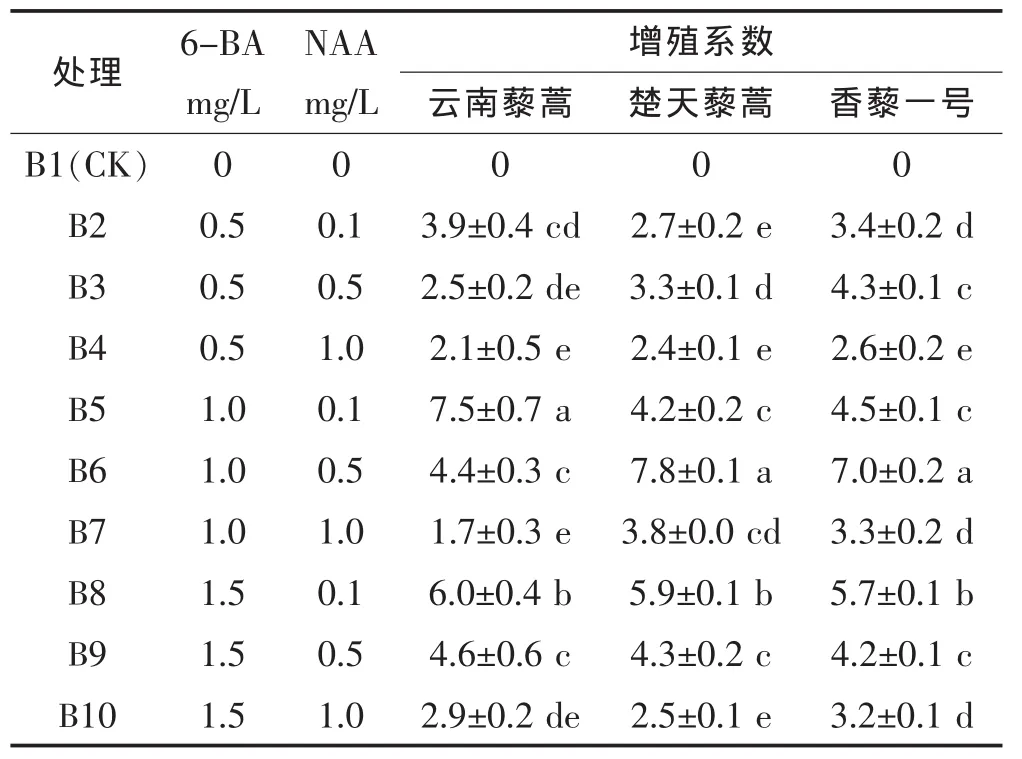
表2 不同NAA、6-BA浓度对芽丛增殖的影响
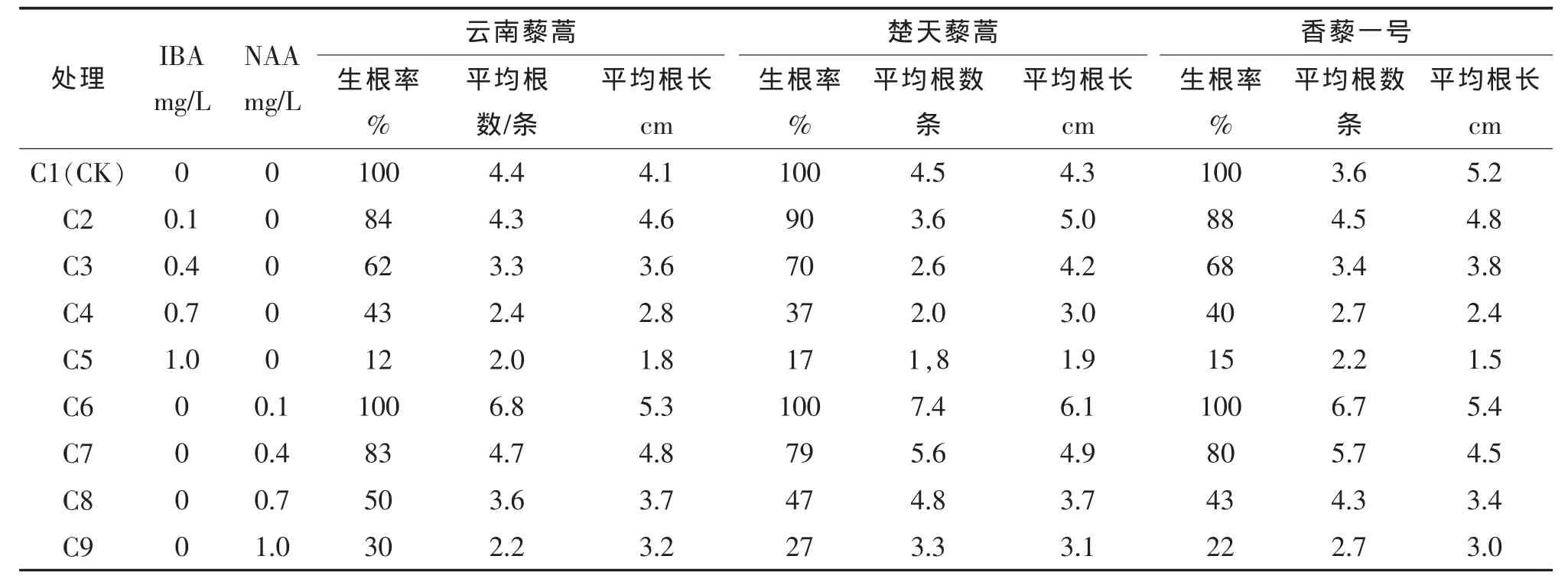
表3 不同IBA、NAA浓度对生根诱导的影响
3 结论与讨论
藜蒿的组培通过器官发生途径实现。在植物组培研究中,如何提高诱导率和增殖系数一直是各种植物组培快繁技术的关键。涂艺声等[10]研究认为,MS+NAA 0.5 mg/L+6-BA 0.5 mg/L最适合诱导藜蒿的叶片、茎段形成愈伤组织,以及愈伤组织分化成再生植株,黄白红[15]研究表明,藜蒿茎叶均适宜作为外植体进行愈伤组织诱导,最佳配方为MS+6-BA 1 mg/L+2,4-D 4 mg/L。本试验以藜蒿茎段为外植体,结果表明,最适宜愈伤组织诱导的培养基分别为云南藜蒿MS+6-BA 1.0 mg/L+IAA 0.5 mg/L、楚天藜蒿MS+6-BA 1.5 mg/L+IAA 1.0 mg/L、香藜一号MS+6-BA 1.5 mg/L+IAA 0.5 mg/L。
黄白红等[9]研究表明,最适宜诱导藜蒿叶丛芽分化的继代培养基配方为MS+6-BA 4 mg/L+NAA 0.4 mg/L。蒋向辉等[8]筛选出藜蒿丛生芽诱导的最适培养基为MS+6-BA 2.0 mg/L+NAA 1.5 mg/L。本试验结果表明,最适宜的增殖培养基分别为云南藜蒿MS+6-BA 1.0 mg/L+NAA 0.1 mg/L,楚天藜蒿和香藜一号均为 MS+6-BA 1.0 mg/L+NAA 0.5 mg/L。
藜蒿的生根培养直接影响其移栽成活率。涂艺声等[10]研究认为,MS+NAA 0.5 mg/L最适合藜蒿外植体诱导生根,黄白红[15]研究表明,藜蒿丛生苗生根的最佳培养基为1/2 MS+NAA 0.5 mg/L+IAA 0.5 mg/L。本试验结果表明,藜蒿最适宜的生根培养基为1/2 MS+NAA 0.1 mg/L;生根培养中,NAA的效果明显好于IBA,显著促进生根,这可能是藜蒿无菌苗对IBA较为迟钝造成,因此,在工厂化育苗中宜选用NAA。
[1]中国科学院植物研究所.中国高等植物图鉴[M].北京:科学出版社,1985.
[2]涂宗财,毛沅文,李志,等.野生藜蒿叶中黄酮类化合物的提取工艺[J].南昌大学学报:工科版,2011,33(3):234-238.
[3]邹峥嵘,袁宜如,计红冰,等.鄱阳湖野生藜蒿的化学成分研究[J].中国野生植物资源,2009,28(1):64-66.
[4]王艳丽,刘凌,孙慧,等.膳食纤维的微观结构及功能特性研究[J].中国食品添加剂,2014(2):98-103.
[5]薛菲,陈燕.膳食纤维与人类健康的研究进展[J].中国食品添加剂,2014(2):208-213.
[6]熊桂云,刘冬碧,胡时友,等.藜蒿肥料用量与施肥效益究[J].湖北农业科学,2003(4):81-82.
[7]李汉霞,汪淑芬,王孝琴,等.武汉蔡甸区蒌蒿(藜蒿)高产高效栽培[J].中国蔬菜,2009(9):39-41.
[8]蒋向辉,付明,佘朝文,等.藜蒿丛生芽诱导条件的筛选验[J].长江蔬菜,2008(18):65-67.
[9]黄白红,乔乃妮,龚逸,等.藜蒿离体培养再生体系的建立[J].安徽农业科学,2007,35(22):6 832-6 834.
[10]涂艺声,余兰平,王永强,等.藜蒿的组织培养和快速繁殖研究[J].中国野生植物资源,2005,24(2):59-61.
[11]马宗兴,赵红,柳申飞.芦蒿的组织培养技术[J].安徽农学报,2003,9(5):44.
[12]王新华,刘伟,赵恒国.藜蒿组织培养[J].北方园艺,2002(4):62.
[13]巩振辉,申书兴.植物组织培养.2版[M].北京:化学工业出版社,2013:13.
[14]王晓娟,金樑,沈延松,等.萱草再生植株过程中根的诱导[J].复旦学报:自然科学版,2002,41(1):89-91.
[15]黄白红.藜蒿离体培养与试管苗分泌结构的研究[D].长沙:湖南农业大学,2007.
