维A酸涂膜剂对兔耳早期增生性瘢痕的影响
2014-12-11刘群英段俊俊邵家松
刘群英 段俊俊 邵家松
维A酸涂膜剂对兔耳早期增生性瘢痕的影响
刘群英 段俊俊 邵家松
目的研究维A酸涂膜剂对兔耳早期增生性瘢痕的影响,探讨其防治瘢痕的可行性。方法选取新西兰白兔24只,建立兔耳增生性瘢痕模型后,随机分为4组,每组6只。A组:对照组,B组:涂膜剂组,C组:0.05%维A酸涂膜剂组,D组:0.1%维A酸涂膜剂组,连续用药6周,期间观察记录瘢痕大小、厚度、颜色、硬度,6周后分别切取兔耳瘢痕组织,HE染色,胶原染色(VG法),行病理学观察、检测及分析。结果A组瘢痕颜色深、厚而硬,并明显高于皮肤,表面凹凸不平;B组、C组、D组瘢痕颜色浅,质地软,厚度薄,皮下结节小,其中C、D组与周围正常皮肤接近,D组瘢痕表面有脱皮现象。HE、VG染色中,A组胶原排列紊乱,有旋涡状结构;C组和D组单位面积内成纤维细胞、微血管数量、胶原沉积量较A组和B组少,且胶原排列整齐,与瘢痕长轴平行。瘢痕增生指数(HI):A组3.17±0.26,B组2.46±0.19,C组1.91±0.21,D组1.90±0.23;成纤维细胞密度(NA):A组5836.70±527.03,B组4128.73±387.66,C组3207.59±439.17,D组3200.28±421.48;胶原纤维的面密度(AA):A组45.38±5.83,B组36.57±6.84,C组28.09±3.82,D组28.07±3.47。A组与B、C、D组比较,HI、NA、AA值差异均有统计学意义(P<0.01);B组与C、D组比较,HI、NA、AA值差异均有统计学意义(P<0.01);C组与D组比较,HI、NA、AA值差异无统计学意义(P>0.05)。结论维A酸涂膜剂可以抑制兔耳早期瘢痕增生,可为防治瘢痕提供一种新的外用方法。
瘢痕,肥大性;维生素A酸类;疾病模型,动物
瘢痕常发生于手术、外伤、烧伤和感染后,目前仍没有有效的防治方法。硅胶膜防治瘢痕有一定疗效,临床使用已有几十年的历史。维A酸作为外用制剂,广泛用于治疗角化性及硬化性皮肤病,对瘢痕增生有一定效果[1-2]。本研究基于硅胶膜和维A酸对瘢痕的有效性,将维A酸加入有机成膜溶剂中,制成新型涂膜剂,探讨其对兔耳早期增生性瘢痕的影响。
材料与方法
一、主要试剂与仪器
Van Gieson染色试剂盒(VG,上海源叶生物科技公司),维A酸涂膜剂为自制制剂。
二、动物模型建立与分组
健康新西兰纯种系大耳白兔24只,体重(2.5±0.3)kg,雌雄各半,购自桂林医学院动物实验中心,来源于北京科宇动物饲养中心,清洁级,编号为SCXK(京)2012-0003。兔耳增生性瘢痕模型的制作参考李荟元[3]和Morris等[4]的研究。24只大耳白兔适应性喂养48 h,选取兔耳腹侧面,切除全层皮肤并刮除软骨膜,形成2 cm×2 cm的方形创面。每只兔耳2个创面,创面间隔2 cm以上,创面暴露直至愈合。28 d后,造模成功。将24只兔随机分成4个组,A组:对照组,B组:涂膜剂组,C组:0.05%维A酸涂膜剂组,D组:0.1%维A酸涂膜剂组。
三、实验方法
术后第29天,A组不给予任何治疗,B组采用涂膜剂外用2次/d,C组采用0.05%维A酸涂膜剂外用2次/d,D组采用0.1%维A酸涂膜剂外用2次/d,持续6周。药物干预6周后,处死动物,手术切取瘢痕组织及其周边<0.5 cm的正常组织,切片后做HE染色和VG染色。
四、观察指标与方法
1.大体观察:观察瘢痕颜色、大小、厚度、柔软度的变化。
2.组织学观察:观察瘢痕增生情况,计算瘢痕增生指数(hypertrophic index,HI)[5]、成纤维细胞密度(numerical density on area,NA)[3]、胶原纤维的面密度(area density on area,AA)[3]。 ①HI:将切取的瘢痕及周围正常组织制作成切片HE染色,低倍镜下用测微尺测出耳腹侧正常皮肤厚度a、耳软骨厚度b、耳背皮肤厚度c、耳增生块全厚度最大径d,按以下公式计算HI,HI=(d-b-c)/a;②NA:于400倍视野下观察VG染色切片,在瘢痕中央浅部和深部及其两侧各随机选取10个矩形视野,目测计数并计算切片内单位面积成纤维细胞的数量,结果取均数,即为NA;③AA:方法同上,各随机选取10个矩形视野,利用计算机辅助病理图像分析系统计算红染胶原的面密度,结果取均数,即为AA。
3.统计分析及数据处理:采用SPSS19.0统计软件,各组 HI、NA、AA 均用±s表示,各组比较采用方差分析,方差不齐时作秩和检验,以P<0.05为差异有统计学意义。
结 果
一、大体标本观察结果
1.造模期:取预实验3只兔子的造模切片,术后第28天(图1a),所有创面完全上皮化,创面增生性瘢痕形成,明显高于周围正常皮肤,质硬,色红。
2.药物干预期:A组:瘢痕继续增生,中心呈火山堆形隆起,并且明显高于周围正常皮肤,隆起的瘢痕体积较大,触感硬(图2a);B组:瘢痕颜色逐渐变淡,隆起的瘢痕体积渐变小变平,触感稍软(图3a);C组:瘢痕颜色已与周围正常皮肤接近,表面触感软(图4a);D组:瘢痕颜色逐渐变淡,表面触感软,体积变小变平,与周围正常皮肤接近,但有表皮剥脱现象(图5a)。
二、组织病理学观察
1.HE染色:28 d造模成功后(图1b),可见成纤维细胞肥大,核浓染,胶原纤维排列紊乱。药物干预6周后,A组(图2b):炎性细胞浸润,胶原紊乱排列,可见漩涡结构,核大深染,组织内常见毛细血管增生;B组(图3b):表皮细胞层数较A组明显减少,炎性细胞浸润,胶原排列较为整齐,组织内可见毛细血管增生;C组(图4b):成纤维细胞纤细,胶原纤维排列疏松;D组(图5b):瘢痕组织均较B组厚度薄,成纤维细胞较少,胶原纤维排列疏松,可见上皮不完整。

图1 术后28 d,兔耳增生性瘢痕模型造模成功 1a:创面增生性瘢痕形成,明显高于周围正常皮肤,质硬,色红;1b:成纤维细胞肥大,核浓染,胶原排列紊乱(HE×400)
2.VG染色:A组(图2c)胶原纤维染红色,排列紊乱,可见旋涡状结构,并有微血管形成。B组(图3c)、C组(图4c)、D组(图5c)胶原排列均比A组整齐且疏松。与B组相比,C组和D组胶原纤维排列更为整齐,形态更为纤细,微血管形成少。
3.各组 HI、NA、AA 比较:HI、NA、AA 值除 C 组与D组之间差异无统计学意义(P>0.05)外,其余组间比较差异均有统计学意义(P<0.01)。维A酸涂膜剂对增生性瘢痕的抑制作用比单纯涂膜剂好,而0.05%维A酸涂膜剂和0.1%维A酸涂膜剂对增生性瘢痕的抑制差异无统计学意义。见表1。
表1 4组兔耳创面瘢痕增生指数、瘢痕成纤维细胞密度及胶原纤维的面密度比较(±s)

表1 4组兔耳创面瘢痕增生指数、瘢痕成纤维细胞密度及胶原纤维的面密度比较(±s)
注:A组:对照组;B组:涂膜剂组;C组:0.05%维A酸涂膜剂组;D组:0.1%维A酸涂膜剂组。a:与A组比较,P<0.01;b:与B组比较,P<0.01;c:与C组比较,P>0.05
组别 n 瘢痕增生指数 成纤维细胞密度 胶原纤维面密度A组 24 3.17±0.26 5836.70±527.03 45.38±5.83 B组 24 2.46±0.19a 4128.73±387.66a 36.57±6.84a C组 24 1.91±0.21ab 3207.59±439.17ab 28.09±3.82ab D组 24 1.90±0.23abc 3200.28±421.48abc 28.07±3.47abc F值 173.21 185.24 61.14 P值 <0.01 <0.01 <0.01
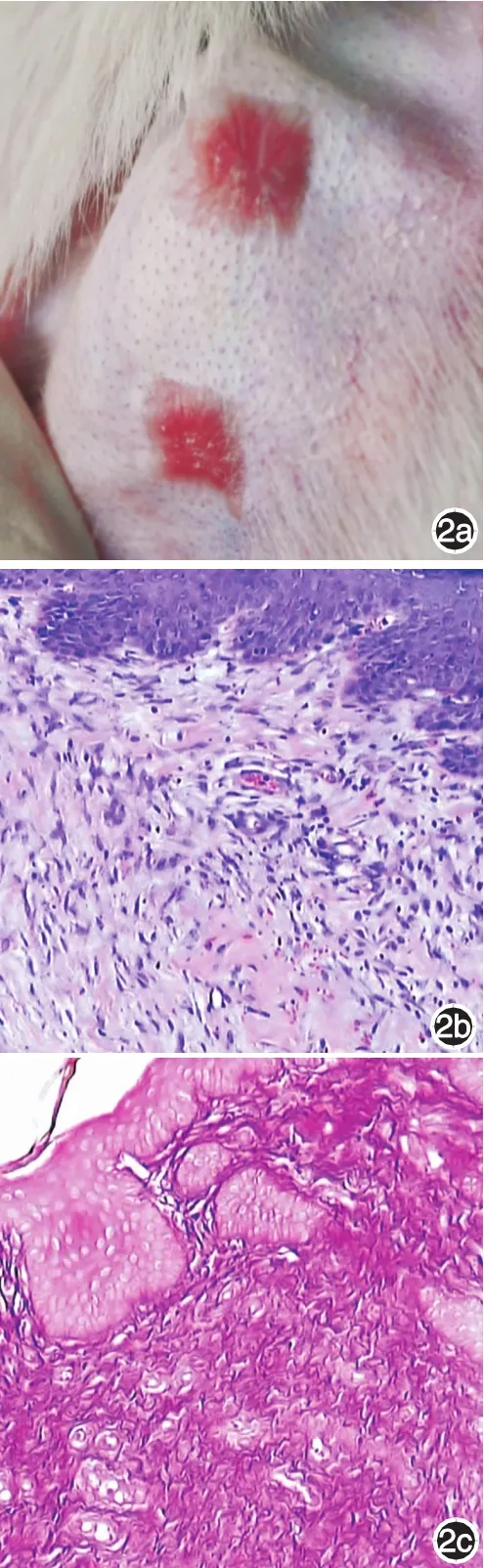
图2 兔耳增生性瘢痕对照组6周 2a:隆起的瘢痕体积较大;2b:成纤维细胞排列紊乱,核大深染,微血管形成,可见胶原漩涡状结构(HE×100);2c:胶原密度高,排列较整齐(VG染色×400)

图3 兔耳增生性瘢痕涂膜剂治疗6周 3a:瘢痕体积变小变平;3b:成纤维细胞较多,胶原致密,排列较整齐(HE×100);3c:胶原密度较低,排列紊乱(VG染色×400)

图4 兔耳增生性瘢痕0.05%维A酸涂膜剂治疗6周 4a:瘢痕表面平而软,颜色已与周围正常的皮肤颜色接近;4b:成纤维细胞纤细,胶原纤维排列疏松(HE×100);4c:胶原密度低,排列整齐(VG染色×400)

图5 兔耳增生性瘢痕0.1%维A酸涂膜剂治疗6周 5a:瘢痕平而软,表皮有剥脱现象;5b:成纤维细胞较少,胶原纤维排列疏松(HE×100);5c:胶原密度低,排列较整齐(VG染色×400)
讨 论
维A酸外用制剂临床上主要用于治疗痤疮、银屑病、皮肤老化、色素性皮肤病、角化性皮肤病、硬化及萎缩性皮肤病、癌前病变以及加速创面的愈合等。Christophers和Lagner等[6]证实,维A酸对上皮细胞的生长有较强的促进作用。Uchida等[7]研究发现,维A酸通过影响人的成纤维细胞基质金属蛋白酶,减少胶原的沉积,达到抑制瘢痕的目的。宋维铭等[8]采用成纤维细胞体外培养技术,将3H TdR(胸腺嘧啶核苷)掺入成纤维细胞DNA中,研究维A酸对体外培养成纤维细胞生长增殖、DNA合成及超微结构的影响。结果显示,维A酸对成纤维细胞生长增殖、DNA合成有不同程度的抑制作用,呈剂量效应关系;扫描电镜和透射电镜观察亦显示,维A酸对成纤维细胞合成胶原有抑制作用。临床研究[9]表明,维A酸对创伤后瘢痕抑制有一定作用。
硅胶膜敷贴在瘢痕防治中的效果得到肯定。Perkins等[10]在加压疗法中使用硅胶膜衬垫,发现在无压力下硅胶膜也有松弛软化瘢痕和使瘢痕平坦的作用。此后硅凝胶和硅弹力膜在增生性瘢痕的治疗中得到较多应用。Quinn等[11]对125例增生性瘢痕和瘢痕疙瘩患者用含硅酮的霜剂治疗增生性瘢痕,按覆盖方式分成纱布覆盖组和塑料膜闭合覆盖组,纱布覆盖组仅有22%获得轻微改善,而闭合覆盖有82%获得明显改善,提示闭合和水化是其作用的主要方式。Sawada和Sone[12]采用不含硅酮的霜剂闭合覆盖技术治疗瘢痕,治疗组的疗效明显优于凡士林对照组,因此认为闭合和水化是治疗瘢痕的主要机制,而硅酮的存在是非必需的。Chang等[13]的工作也支持这一观点。Ricketts等[14]在对未治疗、用水胶体治疗和用胶膜治疗增生性瘢痕过程中,观察到组织细胞分裂mRNA水平的一些差异,提出闭合可改变瘢痕细胞分裂水平,从而对瘢痕塑形产生作用。我们将维A酸加入有机成膜溶剂中,制成0.05%和0.1%维A酸凝胶后密闭待用。该涂膜剂涂抹于兔耳瘢痕后迅速成膜,具有硅凝胶膜的特性,同时又能发挥维A酸的作用。
实验结果表明:①维A酸涂膜剂对兔耳瘢痕组织中成纤维细胞及血管增生具有抑制作用;②维A酸涂膜剂抑制兔耳瘢痕增生,使瘢痕变平、变软,颜色变浅;③维A酸涂膜剂对兔耳瘢痕的抑制效果显著好于涂膜剂组;④0.1%维A酸与0.05%维A酸涂膜剂疗效相当,但高浓度的维A酸有表皮剥脱现象。
虽然本试验证明了外用维A酸涂膜剂对兔耳早期增生性瘢痕有良好抑制效果,但仍有问题需做进一步研究,①本次试验只选用了0.05%和0.1%维A酸,并不清楚疗效与药物浓度的关系以及维A酸涂膜剂中维A酸的最佳有效浓度;②虽然目前已分别提出了维A酸和硅凝胶膜治疗增生性瘢痕可能的机制,但这种新型的涂膜剂抑制瘢痕并没有更进一步理论依据;③目前仍缺乏对于维A酸涂膜剂药理毒理实验。
[1]Panabiere-Castaings MH.Retinoic acid in the treatment of keloids[J].J Dermatol Surg Oncol,1988,14(11):1275-1276.
[2]Daly TJ,Weston WL.Retinoid effects on fibroblast proliferation and collagen synthesis in vitro and on fibrotic diseasein vivo[J].J Am Acad Dermatol,1986,15(4 Pt 2):900-902.
[3] 李荟元.创伤研究动物模型-兔耳瘢痕模型的建立与应用[M].西安:第四军医大学出版社,2005:43-75.
[4]Morris DE,Wu L,Zhao LL,et al.Acute and chronic animal models for exeessive dermal scarring:quantitative studies[J].Plast Reconstr Surg,1997,100(3):674-681.
[5] 吴志远,罗少军,汤少明,等.丹参酮ⅡA对免耳增生性瘢痕组织形成的影响[J].广东医学院学报,2002,20(4):255,259.
[6]Christophers E,Lagner A.In vitro-effects of vitamin A acid on cultured fibroblasts,lymphocytes and epidermal cells: a comparativestudy[J].ArchDermatolForsch,1974,251(2):147-153.
[7]Uchida G,Yoshimura K,Kitano Y,et al.Tretinoin reverses upregulation of matrix metalloproteinase-13 in human keloid derived fibroblasts[J].Exp Dermatol,2003,12 Suppl 2:35-42.
[8] 宋维铭,管正玉,孙广慈,等.维甲酸对体外培养成纤维细胞DNA合成的影响[J].中华整形烧伤外科杂志,1995,11(2):135-136.
[9] 陈惠平,张余光,张涤生.创伤后瘢痕的临床评估及综合治疗[J].整形再造外科杂志,2004,1(2):113-117.
[10]Perkins K,Davey RB,Wallis KA.Silicone gel:a new treatment for burn scars and contractures[J].Burns Incl Therm Inj,1983,9(3):201-204.
[11]Quinn KJ,Evans JH,Courtney JM,et al.Non-pressure treatment of hypertrophic scars[J].Burns Incl Therm Inj,1985,12(2):102-108.
[12]Sawada Y,Sone K.Hydration and occlusion treatment for hypertrophic scars and keloids[J].Br J Plast Surg,1992,45(8):599-603.
[13]Chang CC,Kuo YF,Chiu HC,et al.Hydration,not silicone,modulates the effects of keratynocytes on fibroblasts[J].J Surg Res,1995,59(6):705-711.
[14]Ricketts CH,Martin L,Faria DT,et al.Cytokine mRNA changes during the treatment of hypertrophic scars with silicone and nonsilicone gel dressings[J].Dermatol Surg,1996,22(11):955-959.
2013-11-04)
(本文编辑:颜艳)
Effect of tretinoin gel sheeting on early-stage hyperplastic scars in rabbit ears
Liu Qunying*,Duan Junjun,Shao Jiasong.*Department of Dermatology,Affiliated Hospital,Guilin Medical College,Guilin 541001,China
Shao Jiasong,Email:shao1126@126.com
ObjectiveTo estimate the effect of tretinoin gel sheeting on early-stage hyperplastic scars in rabbit ears,and to evaluate the feasibility to prevent and treat hyperplastic scars with it.MethodsThe ears of 24 rabbits were used to establish a model of hyperplastic scar according to previously reported methods.Then,the rabbit ears were randomly divided into four groups:control group receiving no treatment,gel sheeting group treated with the vehicle of the tretinoin gel sheeting,0.05%tretinoin group treated with 0.05%tretinoin gel sheeting,0.1%tretinoin group treated with 0.1%tretinoin gel sheeting.All the gel sheetings were topically used twice daily for six consecutive weeks.During the treatment,the size,thickness,color and texture of scars were estimated.After six weeks of treatment,all the scar tissues were resected from the rabbit ears and subjected to hematoxylin and eosin(HE)staining and van Gieson(VG)staining.Statistical analysis was carried out by analysis of variance and rank sum test.ResultsThe scars were deeply colored,thickened,hard and elevated with an uneven surface in the control group,but lightly colored,thinned and soft with the presence of small subcutaneous nodules in the other three groups.The surface of scars in the two tretinoin groups was similar to that of adjacent normal skin,and scaling was observed on the scar surface in the 0.1%tretinoin group.HE and VG staining showed a disarrangement of collagen fibers with the formation of vortex-like structures in the control group.A significant decrease was noted in the number of fibroblasts and microvessels as well as amount of collagen deposition per unit cross-sectional area in the two tretinoin groups compared with the control group and gel sheeting group.Additionally,the collagen fibers were regularly arranged and parallel to the long axis of scars in the two tretinoin groups.The scar hyperplasia index(HI)was 3.173±0.26,2.465±0.19,1.906±0.21 and 1.903±0.23 in the control group,gel sheeting group,0.05%tretinoin group and 0.1%tretinoin group respectively,the fibroblast density(NA)was 5836.7±527.03,4128.73±387.66,3207.59±439.17 and 3200.28±421.48 respectively,and the area density of collagen fiber(AA)was 45.38±5.83,36.57±6.84,28.09±3.82 and 28.07±3.47 respectively.As far as HI,NA and AA were concerned,the control group differed significantly from the other three groups(allP<0.01),and the gel sheeting group from the two tretinoin groups(allP<0.01),but no significant difference was observed between the two tretinoin groups(allP>0.05).ConclusionsTopical tretinoin gel sheeting can inhibit scar proliferation at early stage in rabbit ears,and may provide a new choice for the prevention and treatment of hyperplastic scars.
Cicatrix,hypertrophic;Retinoids;Disease models,animal
10.3760/cma.j.issn.0412-4030.2014.07.007
541001广西,桂林医学院附属医院皮肤科(刘群英),整形外科(段俊俊、邵家松)
邵家松,Email:shao1126@126.com
