安石榴苷对中波紫外线诱导HaCaT细胞光损伤的预防作用研究
2014-12-11杨明美马月红李锁王仕忠郭盛华
杨明美 马月红 李锁 王仕忠 郭盛华
安石榴苷对中波紫外线诱导HaCaT细胞光损伤的预防作用研究
杨明美 马月红 李锁 王仕忠 郭盛华
目的探讨安石榴苷对中波紫外线(UVB)诱导角质形成细胞损伤的保护机制。方法培养的HaCaT细胞分为空白对照组、安石榴苷组、UVB组、安石榴苷+UVB组。噻唑蓝(MTT)法检测细胞增殖能力,Hoechst/碘化丙锭(PI)染色和流式细胞仪检测细胞凋亡,RT-PCR法测定金属基质蛋白酶1(MMP1)及其组织抑制因子1(TIMP1)mRNA表达水平,Western印迹检测丝裂原活化蛋白激酶(MAPK)通路相关蛋白P38、JNK、ERK的磷酸化水平变化。结果MTT试验示,10~40 μmol/L安石榴苷对UVB诱导的HaCaT细胞损伤有较佳的预保护作用。UVB组HaCaT细胞强Hoechst和强PI双染细胞较空白对照组增多,安石榴苷+UVB组较UVB组减少。流式细胞仪分析,UVB组凋亡细胞百分率(9.82%±0.11%)高于空白对照(1.24%±0.91%,P<0.01),而安石榴苷(10、20、40 μmol/L)+UVB组凋亡细胞百分率(分别为6.38%±0.14%、5.24%±0.17%、3.77%±0.11%)较UVB组低,差异有统计学意义(均P<0.01)。UVB组MMP1 mRNA相对表达量(12.376±0.602)高于空白对照组(1.007±0.147,P<0.01),而TIMP1 mRNA相对表达量(0.103±0.006)低于空白对照组(1.006±0.139,P<0.01),安石榴苷组MMP1及TIMP1 mRNA与空白对照组比较,差异无统计学意义(均P>0.05)。安石榴苷预处理的HaCaT细胞经30 mJ/cm2UVB照射后MMP1 mRNA相对表达量较UVB组降低(均P<0.01),而TIMP1 mRNA较UVB组升高(均P<0.01)。Western印迹示,经UVB照射后,HaCaT细胞p-ERK、p-JNK及p-p38表达升高(均P<0.01)。安石榴苷组HaCaT细胞p-ERK、p-JNK及p-p38表达没有明显改变(P>0.05),而安石榴苷+UVB组有不同程度下降(均P<0.01)。结论安石榴苷对UVB引起HaCaT细胞损伤有一定的预防作用。
角蛋白细胞;紫外线;基质金属蛋白酶1;细胞外信号调节MAP激酶类;安石榴苷;基质金属蛋白酶抑制因子
石榴提取物中的活性成分有着广泛的生物学效应,其对人体的药理作用主要体现在抗氧化、抗癌、抗菌、抗病毒、抗紫外线损伤以及改善代谢综合征等方面[1-3],这些作用主要与石榴中含有的安石榴苷、没食子酸等酚类、鞣花单宁以及尿石素等成分有关[2,4],而安石榴苷是石榴提取物中主要活性成分。我们检测了安石榴苷对中波紫外线(UVB)照射后HaCaT细胞凋亡的影响,观察安石榴苷单独或联合UVB照射对金属基质蛋白酶1(MMP1)、组织抑制因子1(TIMP1)以及丝裂原活化蛋白激酶(MAPK)通路相关分子磷酸化的影响,探讨安石榴苷预防UVB诱导的角质形成细胞凋亡的作用。
材料与方法
一、材料
UVB辐照仪为德国Waldmann Medizintechnik公司产品,波长280~320 nm,照射强度1.35 mW/cm2。安石榴苷为美国Sigma公司产品,纯度≥98%。HaCaT细胞株购于中国科学院细胞库。噻唑蓝(MTT)、RPMI 1640培养基、0.25%胰酶、胎牛血清均为美国Gibco公司产品。细胞凋亡坏死试剂盒(Hoechst和PI染色)为上海碧云天生物技术有限公司产品。Annexin V/PI凋亡检测试剂盒为美国BD公司产品。Trizol为美国Invitrogen公司产品。cDNA第一链合成试剂盒、Taq酶为美国Thermo Fisher公司产品。SYBR Green试剂盒为日本Toyobo公司产品。p-JNK(T183/Y185)、p-P38(T180/Y182)、p-ERK(T202/Y204)、Akt、JNK、P38MAPK 抗 体 均 为 美 国CST公司产品。β肌动蛋白、羊抗兔二抗、全蛋白抽提试剂盒,ECL检测试剂盒为南京凯基生物科技发展有限公司产品。
二、方法
1.实验分组及设置:安石榴苷溶于二甲基亚砜溶液(DMSO)中制成1 000 mmol/L储存液,-20℃保存,临用时用新鲜培养基调至终浓度为5、10、20、40、80 μmol/L,DMSO终浓度0.1%(v/v),不加安石榴苷组加入含同等浓度DMSO的培养基,实验分为空白对照组(不加入安石榴苷,不照射UVB)、安石榴苷组、UVB组、安石榴苷 +UVB组。加药组细胞经安石榴苷处理24 h后行UVB照射。
2.细胞培养及UVB照射:HaCaT细胞用含10%小牛血清的RPMI 1640培养基培养24 h后,吸去培养皿内的培养液,磷酸盐缓冲液(PBS)洗涤1次,加入0.5 ml或2 ml PBS,置于UVB辐照仪下,照射剂量为30 mJ/cm2,照射结束后吸去PBS,加入无血清培养基继续培养。
3.MTT法检测HaCaT细胞活性:将传代细胞调整至1×104~2×104/ml后接种入96孔培养板,每孔150 μl,每一处理因素设立3个复孔。长至60%细胞融合后对各组细胞进行处理,再置37℃5%CO2条件下继续培养24 h。每孔加入10 μl MTT溶液(5 g/L),在37℃、5%CO2下孵育2 h后弃上清液,加入DMSO 100 μl/孔溶解,置酶标仪于490 nm波长测吸光度(A值)。
4.Hoechst和PI染色:经过步骤2处理,将细胞继续培养12 h后,吸尽培养液,PBS漂洗3次,加1 ml细胞染色缓冲液,依次加入5 μl Hoechst染液和5 μl PI染液,混匀,4℃孵育30 min,置荧光显微镜下观察。正常细胞呈现弱蓝色荧光或伴有弱红色荧光,凋亡或坏死细胞呈现强蓝色和强红色荧光。
5.Annexin V-FITC和PI标记细胞后流式细胞仪检测:经过步骤2处理后,细胞继续培养12 h,用0.25%胰酶消化液(不含EDTA)消化后收集细胞悬液,离心,弃上清,预冷PBS漂洗3次,加100 μl缓冲液混匀后吸入流式细胞仪上样管,依次加入5 μl Annexin和5 μl PI,摇匀,室温避光孵育15 min,每管加入400 μl缓冲液,上机。单标记Annexin VFITC细胞亚群处于早期凋亡,双标记Annexin VFITC和PI为中晚期凋亡,单标记PI为坏死。
6.实时PCR检测:步骤2处理后,将细胞在培养基中继续培养6 h,使用Trizol法提取细胞总RNA,逆转录试剂盒合成第一链cDNA。按SYBR Green荧光定量检测试剂盒说明书进行定量检测,终体系为20 μl,引物序列及产物大小见表1。反应条件为95℃5 min,95℃15 s,60℃30 s,72℃30 s,40个循环。所有样品的目的基因和GAPDH进行荧光定量 PCR 反应,分别取得 Ct值,采用 2-ΔΔCt方法分析样品各基因的相对表达差异。
7.Western印迹:步骤2处理后,将细胞在培养基中继续培养1 h,收集细胞前彻底吸除培养液,冷PBS洗1次后,加入150 μl含有蛋白酶抑制剂的细胞裂解液,在冰上操作收获细胞,Bradford法测定蛋白浓度后进行12%聚丙烯酰胺凝胶电泳(SDSPAGE)和转膜(PVDF)。PVDF膜常温下5%牛血清白蛋白(BSA)封闭1 h后,加入一抗(1∶1 000),4℃摇床过夜,磷酸盐吐温缓冲液(PBST)洗涤3次,每次5 min。然后加入二抗(1∶2 000),常温下作用1 h,PBST洗涤3次,每次5 min。然后ECL发光、压片。应用生物图像分析软件Gel-Pro32分析各样本的蛋白水平,以β肌动蛋白作为内参照。
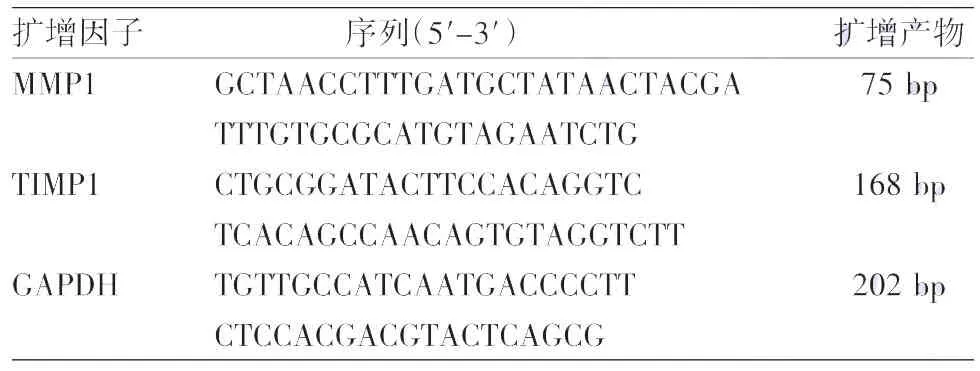
表1 定量PCR检测的引物序列及产物大小
结 果
一、安石榴苷对HaCaT细胞活性的影响以及对UVB的预防作用
MTT法检测各组细胞活性,空白对照组A值为0.824±0.014,UVB 组为 0.410±0.023,5、10、20、40、80 μmol/L 安石榴苷组分别为 0.824±0.008、0.827±0.016、0.824±0.009、0.825±0.010、0.820±0.008。 5、10、20、40、80 μmol/L 安石榴苷 +UVB 组分别为0.449±0.007、0.497±0.012、0.591±0.020、0.720±0.046、0.457±0.015。与空白对照组比较,UVB组细胞活性显著降低(P<0.01),而安石榴苷组与空白对照组细胞活性差异无统计学意义;与UVB组比较,5~80 μmol/L安石榴苷 +UVB组的细胞活力有不同程度上升(均P<0.05),其中10~40 μmol/L安石榴苷有较佳的预保护作用(均P<0.01),故后续试验采用了 10、20、40 μmol/L 作为预处理浓度。
二、凋亡相关检测
1.Hoechst和PI染色:UVB组HaCaT细胞凋亡水平较空白对照组增加。安石榴苷+UVB组凋亡细胞较UVB组减少。见图1。

图1 Hoechst和PI染色观察HaCaT细胞凋亡 空白对照组(1a)和安石榴苷组(1b~1d)细胞呈淡蓝色伴有淡红色荧光,UVB组(1e)出现部分强蓝色强红色双染细胞,安石榴苷+UVB组(1f~1h)强蓝色强红色细胞减少,凋亡水平减低。1a:空白对照;1b:10 μmol/L安石榴苷;1c:20 μmol/L 安石榴苷;1d:40 μmol/L 安石榴苷;1e:UVB;1f:10 μmol/L 安石榴苷 +UVB;1g:20 μmol/L 安石榴苷 +UVB;1h:40 μmol/L 安石榴苷+UVB
2.Annexin V-FITC和PI标记细胞后流式细胞仪分析:凋亡细胞百分率为早期凋亡+晚期凋亡细胞群比例(即Q2+Q4群细胞百分比)。安石榴苷(10、20、40 μmol/L)组与空白对照组比较,差异无统计学意义(均P>0.05),UVB组凋亡细胞百分率明显高于空白对照组(P<0.01),而安石榴苷(10、20、40 μmol/L)+UVB组凋亡细胞百分率与UVB组比较有不同程度降低,差异有统计学意义(均P<0.01),见表 2。
三、RT-PCR测定 MMP1 mRNA及 TIMP1 mRNA的表达
UVB组MMP1 mRNA相对表达量明显高于空白对照组(P< 0.01), 空白对照组与 10、20、40 μmol/L安石榴苷组比较差异无统计学意义(F=0.42,P>0.05)。UVB 组与 10、20、40 μmol/L安石榴苷 +UVB组MMP1 mRNA相对表达量组间比较差异有统计学意义(F=270.71,P<0.01),分别与UVB组比较(Dunnett-t检验),均P<0.01,见表2。
UVB组TIMP1 mRNA相对表达量明显低于空白对照组(P< 0.01),空白对照组与 10、20、40 μmol/L安石榴苷组组间比较差异无统计学意义(F=1.35,P> 0.05)。UVB组与10、20、40 μmol/L安石榴苷 +UVB组间比较差异有统计学意义(F=1053.21,P<0.01),各组间经Dunnett-t检验,均P<0.01,见表2。
四、HaCaT细胞MAPK信号通路在安石榴苷保护下经UVB的激活和变化
UVB组与空白对照组比较,HaCaT细胞总ERK、JNK及p38未见明显改变,磷酸化ERK、JNK及p38表达均升高。 10、20、40 μmol/L 安石榴苷组HaCaT 细胞磷酸化ERK、JNK及p38表达无明显改变,而10、20、40 μmol/L安石榴苷+UVB组细胞磷酸化ERK、JNK及p38表达均有不同程度下降,见图2。
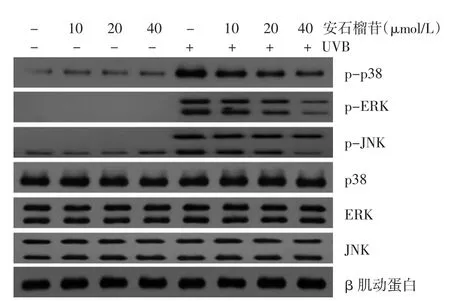
图2 HaCaT细胞MAPK信号家族在安石榴苷和UVB作用下表达的变化
表2 安石榴苷及UVB照射对HaCaT细胞凋亡率、MMP1和TIMP1 mRNA表达的影响(±s)

表2 安石榴苷及UVB照射对HaCaT细胞凋亡率、MMP1和TIMP1 mRNA表达的影响(±s)
注:n=3;a:与空白对照组比较,P>0.05;b:与空白对照组比较,P<0.01;c:与UVB组比较,P<0.01
?
讨 论
石榴提取物具有明确的光保护作用[5],安石榴苷是石榴提取物中的主要有效单体成分[6]。
本实验结果显示,5~80 μmol/L安石榴苷单独处理对细胞活性无影响,而同等浓度的安石榴苷在一定程度上可减轻UVB照射对HaCaT细胞的损伤,其中10~40 μmol/L安石榴苷有较佳的预防UVB光损伤的能力,5~40 μmol/L安石榴苷的防光能力随浓度增高而增强,而80 μmol/L安石榴苷防光能力较弱,推测可能安石榴苷浓度过高,影响了细胞增殖。30 mJ/cm2UVB照射可诱使HaCaT细胞发生凋亡,安石榴苷预处理可明显降低UVB照射所致的HaCaT细胞凋亡,表明安石榴苷可减轻UVB照射对HaCaT细胞的刺激损伤,但对细胞增殖作用的影响不明显。
TIMP与MMP的平衡在细胞外基质的合成和降解中发挥作用,MMP1及TIMP1的表达失去平衡,可致胶原降解增加,引起光损伤的发生[7]。目前认为,UVB可诱导三个MAPK亚族激活,包括ERK、JNK和P38,诱导角质形成细胞凋亡[8]。本实验中我们发现,30 mJ/cm2UVB照射可以显著增加MMP1 mRNA的水平,抑制TIMP1 mRNA的产生,导致了二者间动态平衡的改变,与Zaid等[9]的研究结果一致。30 mJ/cm2UVB组HaCaT细胞对MAPK信号家族有着不同程度的激活作用,与Rattan等[8]研究相符。安石榴苷预处理再照UVB的HaCaT细胞 MMP1、TIMP1表达量变化以及MAPK信号通路标记物较UVB组明显有差异,而安石榴苷组对这些指标没有影响。Kaur和Saraf[10]研究发现,许多草本提取物具有很强的紫外线吸收能力;Kapoor和Saraf[11]研究证实,石榴皮提取物是强效遮光剂,因此我们推测,安石榴苷可能是通过对紫外线的吸收作用减少紫外线对细胞的损害,但是UVB致细胞凋亡的信号传导通路是一个复杂的过程,TIMP、MMP和MAPK虽然起着重要作用,但并不代表全部,安石榴苷是否还有其他的途径影响细胞的凋亡进程还有待进一步探讨。
[1]Johanningsmeier SD,Harris GK.Pomegranate as a functional food and nutraceutical source[J].Annu Rev Food Sci Technol,2011,2:181-201.
[2]Seeram NP,Aronson WJ,Zhang Y,et al.Pomegranate ellagitanninderived metabolites inhibit prostate cancer growth and localize to the mouse prostate gland[J].J Agric Food Chem,2007,55(19):7732-7737.
[3]Afaq F,Khan N,Syed DN,et al.Oral feeding of pomegranate fruit extractinhibitsearly biomarkersofUVB radiation-induced carcinogenesis in SKH-1 hairless mouse epidermis[J].Photochem Photobiol,2010,86(6):1318-1326.
[4]Lansky EP,Jiang W,Mo H,et al.Possible synergistic prostate cancer suppression by anatomically discrete pomegranate fractions[J].Invest New Drugs,2005,23(1):11-20.
[5]Bekir J,Mars M,Vicendo P,et al.Chemical composition and antioxidant,anti-Inflammatory,and antiproliferation activities of pomegranate(punica granatum)flowers[J].J Med Food,2013,16(6):544-550.
[6]Mena P,Calani L,Dall'Asta C,et al.Rapid and comprehensive evaluation of(poly)phenolic compounds in pomegranate(Punica granatum L.)juice by UHPLC-MSn[J].Molecules,2012,17(12):14821-14840.
[7]Herrmann G,Wlaschek M,Lange TS,et al.UVA irradiation stimulatesthe synthesisofvariousmatrix-metalloproteinases(MMPs)in cultured human fibroblasts[J].Exp Dermatol,1993,2(2):92-97.
[8]Rattan SI,Sejersen H,Fernandes RA,et al.Stress-mediated hormetic modulation of aging,wound healing,and angiogenesis in human cells[J].Ann N Y Acad Sci,2007,1119(1):112-121.
[9]Zaid MA,Afaq F,Syed DN,et al.Inhibition of UVB-mediated oxidative stress and markers of photoaging in immortalized HaCaT keratinocytes by pomegranate polyphenol extract POMx[J].Photochem Photobiol,2007,83(4):882-888.
[10]Kaur CD,Saraf S.In vitrosun protection factor determination of herbal oils used in cosmetics[J].Pharmacognosy Res,2010,2(1):22-25.
[11]Kapoor S,Saraf S.Efficacy study of sunscreens containing various herbs for protecting skin from UVA and UVB sunrays[J].Pharmacogn Mag,2009,5(19):238-248.
2013-10-11)
(本文编辑:吴晓初)
Preventive effects of punicalagin against ultraviolet B-induced damage to human HaCaT keratinocytes
Yang Mingmei*,Ma Yuehong,Li Suo,Wang Shizhong,Guo Shenghua.*Department of Dermatology,Changzhou No.2 People's Hospital Affiliated to Nanjing Medical University,Changzhou 213003,China
Guo Shenghua,Email:czeygsh@163.com
ObjectiveTo investigate the mechanisms underlying the protection by punicalagin against ultraviolet B(UVB)-induced damage to keratinocytes.MethodsCultured human HaCaT keratinocytes were divided into several groups:blank control group receiving no treatment,punicalagin groups treated with various concentrations of punicalagin,UVB group irradiated with UVB at 30 mJ/cm2,combination groups pretreated with different concentrations of punicalagin followed by UVB radiation at 30 mJ/cm2.The concentrations of punicalagin were 5,10,20,40 and 80 μmol/L in the cell proliferation assay,10,20 and 40 μmol/L in the other assays.After additional culture for different durations,methyl thiazolyl tetrazolium(MTT)assay was performed to evaluate the proliferation of HaCaT cells,Hoechst and propidium iodide(PI)staining as well as flow cytometry to detect the apoptosis in cells,reverse transcription-PCR to quantify the mRNA expressions of matrix metalloproteinase-1(MMP1)and tissue inhibitor of metalloproteinase-1(TIMP1)in HaCaT cells,Western blot to determine the phosphorylation levels of the mitogen-activated protein kinase(MAPK)pathway-related proteins including P38,JNK and ERK.Statistical analysis was carried out byttest,one-way analysis of variance,and Dunnett'st-test.ResultsAs the MTT assay showed,punicalagin at 10-40 μmol/L showed stronger pre-protective effects against UVB-induced damage to HaCaT cells compared with punicalagin at the other concentrations.The number of cells highly positive for both Hoechst and PI staining was larger in the UVB group than that in the blank control group,but smaller in the combination groups than in the UVB group.The percentage of apoptotic cells increased significantly in the UVB group compared with the blank control group(9.82%±0.11%vs.1.24%±0.91%,P<0.01),but decreased significantly in the three combination groups(punicalagin(10,20 and 40 μmol/L)+UVB)compared with the UVB group(6.38%±0.14%,5.24%±0.17%and 3.77%±0.11%vs.9.82%±0.11%,allP<0.01).The expression of MMP1 mRNA was significantly higher,but that of TIMP1 mRNA was significantly lower in the UVB group than in the blank control group(bothP<0.01),whereas no statistically significant difference was observed in the expression of MMP1 or TIMP1 mRNA between the punicalagin groups and blank control group(allP>0.05).The pretreatment with punicalagin significantly reduced the expression level of MMP1 mRNA(P<0.01),but elevated that of TIMP1 mRNA(P<0.01)in the combination groups compared with the UVB group.As Western blot showed,the phosphorylation levels of P38,JNK and ERK were markedly increased in the UVB group(allP<0.01),but experienced no significant changes in the punicalagin groups(allP>0.05)compared with the blank control group,and decreased to different degrees in the combination groups compared with the UVB group(allP<0.01).ConclusionPunicalagin has a pre-protective effect on UVB-induced damage to HaCaT cells.
Keratinocytes;Ultraviolet rays;Matrix metalloproteinase 1;Extracellular signal-regulated MAP kinases;Punicalagin;Matrix metalloproteinase inhibitory factor
10.3760/cma.j.issn.0412-4030.2014.07.008
213003江苏常州,南京医科大学附属常州第二人民医院皮肤科(杨明美、马月红、李锁、郭盛华),中心实验室(王仕忠)
郭盛华,Email:czeygsh@163.com
