白芍总苷对HaCaT细胞表达白细胞介素18的影响及相关信号通路的研究
2014-12-09张洪英王小艳陈星宇逄明杰史同新
张洪英 王小艳 陈星宇 逄明杰 史同新
白芍总苷对HaCaT细胞表达白细胞介素18的影响及相关信号通路的研究
张洪英 王小艳 陈星宇 逄明杰 史同新
目的观察白芍总苷(TGP)对角质形成细胞(KC)表达白细胞介素(IL)-18的影响,并初步探讨ERK1/2、JNK1/2信号通路在其中的作用。方法将部分HaCaT细胞分为3个组,即对照组加入0.031%二甲基亚砜的细胞培养液,TGP组分别加入6种不同浓度的TGP(0.5、2.5、12.5、62.5、125.0、312.5 mg/L),抑制剂组分别加入10 μmol/L ERKl/2抑制剂PD98059和JNK1/2抑制剂SP600125预处理2 h后,再加入125 mg/L TGP。细胞继续培养48 h。实时反转录(RT)-PCR方法和ELISA方法检测HaCaT细胞IL-18的表达。部分HaCaT细胞分为两组,一组用125 mg/L TGP分别处理15,30,60 min,另一组分别用10 μmol/L ERKl/2抑制剂PD98059和JNK1/2抑制剂SP600125预处理后再加入125 mg/L TGP分别处理15,30,60 min。免疫印迹技术观察两组HaCaT细胞ERK1/2、JNK1/2磷酸化水平。结果TGP在低浓度(0.5、2.5 mg/L)时对HaCaT细胞IL-18 mRNA和蛋白的表达有促进作用,62.5~125.0 mg/L时可抑制IL-18 mRNA和蛋白的表达,125 mg/L TGP抑制作用最强。TGP(125 mg/L)作用15 min后磷酸化ERKl/2蛋白表达达到高峰,表达水平为0.448±0.018,与对照组(0.204±0.005)比较,差异有统计学意义(P<0.01);30 min后表达水平降低至0.213±0.005,60 min后为0.217±0.005,与对照组相比差异无统计学意义(均P>0.05)。PD98059预处理组磷酸化ERK1/2表达水平为0.237±0.010,与单独125 mg/L TGP给药组相比,差异有统计学意义(P<0.01)。125 mg/L TGP对JNK蛋白的磷酸化作用不明显,各组相比差异无统计学意义(P>0.05)。结论TGP可抑制IL-18 mRNA和蛋白的表达, ERK1/2信号途径可能介导这一抑制作用。
白芍;角蛋白细胞;白细胞介素18;丝裂原激活蛋白激酶类
我们在临床中应用白芍总苷胶囊(TGP,商品名帕夫林,宁波立华制药有限公司生产)治疗银屑病取得了较好的疗效[1-2],但其作用机制尚未明确。通过既往实验,我们知道,TGP可通过p38MAPK途径抑制血管内皮生长因子(VEGF)和IL-23的表达,从而参与抑制角质形成细胞(KC)增殖的过程[3]。近来研究发现,IL-18能促进机体产生Thl型免疫反应,同时能够抑制Th2免疫应答,在寻常性银屑病的发生发展过程中起重要作用[4]。在正常人皮肤中,KC是IL-18的主要来源[5]。本实验中,我们检测TGP对体外培养的HaCaT细胞表达IL-18的影响,同时观察TGP对ERK1/2、JNK1/2通路中相关分子磷酸化影响,及ERK/JNK相关抑制剂预处理后TGP对HaCaT细胞IL-18表达的影响,从而探讨TGP治疗银屑病的作用机制。
材料与方法
一、材料
TGP由宁波朗生医药有限公司提供。临用前按1∶1(g/ml)以二甲基亚砜(DMSO)溶解,再用培养液配成所需浓度,过滤除菌分装。RPMI1640细胞培养液、新生牛血清产自杭州四季青生物公司,抗总细胞外信号调节蛋白激酶(T-ERK1/2)、总Jun氨基末端激酶(T-JNK1/2)单克隆抗体产自美国Cell Signaling Technology 公 司 ,ERK1/2 抑 制 剂PD98059、JNK1/2阻断剂SP600125产自美国Gibco公司,抗磷酸化ERK1/2(p-ERK1/2)、磷酸化JNK 1/2 (p-JNK 1/2)单克隆抗体产自美国Santa Cruz公司, IL-18 ELISA试剂盒产自深圳晶美生物工程有限公司,SYBR Green实时荧光定量PCR检测试剂盒产自大连Takara公司,总RNA提取试剂盒产自北京天根生化科技有限公司。
二、方法
1.细胞培养:HaCaT细胞由韩国延世大学丁擘晓博士惠赠。培养基采用含有10%新生牛血清的1640培养基,将HaCaT细胞按1×105/ml接种于25或50ml细胞培养瓶中,置于37℃、5%CO2培养箱中培养。
2.ELISA法检测细胞培养上清液中IL-18蛋白含量:细胞培养于50 ml培养瓶中。①对照组:含0.031%DMSO的细胞培养液;②TGP组:参照文献[3]分别加入6种浓度TGP(0.5、2.5、12.5、62.5、125.0、312.5 mg/L);③抑制剂组:10 μmol/L ERKl/2抑制剂PD98059和JNK l/2抑制剂SP600125分别预处理2 h后,加入125 mg/L TGP。细胞继续培养48 h后,收集细胞培养上清液,采用双抗体夹心ELISA试验检测IL-18蛋白含量,按照操作说明书进行,结束后立即上机测吸光度A值(450 nm),根据各个样品的A450值,在标准曲线上得出相应的浓度值。
3.反转录(RT)-PCR检测IL-18 mRNA的表达:检索基因库,应用Primer 5.0软件设计上、下游引物,IL-18上游引物为5′-GCCTGGACAGTCAGCA AGGA-3′,下游引物5′-TCTACTGGTTCAGCAGCCA TCTTTA-3′,扩增产物片段大小342 bp;β肌动蛋白上游引物5′-ACACTGTGCCCATCTACG-5′,下游引物5′-TGTCACGCACGATTTCC-3′,扩增产物片段大小153 bp,由上海生工生物工程技术服务有限公司合成。实验分组同上述蛋白检测。收集细胞提取总RNA。将提取的总RNA按试剂盒说明书反转录合成cDNA。取cDNA 2 μl,加2.5×RealMasterMix/ SYBR solution 25 μl,上下游引物各1 μl,加DEPC水至反应总体积50 μl,进行定量PCR反应。IL-18反应条件:94℃变性2 min,58℃退火45 s,72℃延伸60 s,共反应40个循环。反应结束后,在ABI Prism SDS 2.0软件上进行自动分析,查看每个基因的扩增情况,导出相应的域值循环数(Ct),校正cDNA模板的细胞拷贝数,实时RT-PCR结果的计算采用△Ct值法(△Ct值=样品Ct均值-内参照Ct均值,计算相对量采用2-△△Ct),比较不同待测标本DNA的△Ct值与正常标本DNA△Ct值的变化,对未知标本靶基因的原始拷贝数作出判断。
4.免疫印迹试验检测ERK1/2、JNK1/2:取细胞悬液以5×104细胞/孔接种于50 ml培养瓶中。待细胞长至70%~80%融合状态时,进行如下处理:①参照文献[3]用125 mg/L TGP分别刺激细胞15、30、60 min;②分别以 10 μmol/L ERKl/2抑制剂PD98059、JNK1/2抑制剂SP600125预处理2 h后,加入125 mg/LTGP刺激15、30、60 min。收集细胞,检测p-ERKl/2、T-ERKl/2、p-JNK1/2、T-JNK1/2。加入封闭液稀释的一抗(p-ERK1/2 1∶1 000、ERK1/2 1∶200,p-JNK1/2 1∶200,JNK1/2 1∶200),置37℃水浴摇床温育2 h,含吐温的乙醇胺缓冲盐溶液(TBST)洗膜,继与辣根过氧化物酶标记的抗兔二抗(1∶400)室温孵育1 h,ECL显色系统X光片感光显影。胞质内蛋白表达水平以ERK1/2、JNK1/2与β肌动蛋白光密度比值表示,磷酸化ERK1/2、JNK1/2蛋白表达水平以p-ERK1/2、p-JNK1/2与β肌动蛋白光密度比值表示,应用Qwin图像分析软件进行定量分析。
5.统计学处理:应用SPSS 17.0软件进行统计。统计数据以±s表示,两组间比较采用t检验。P<0.05为差异有统计学意义。
结果
一、TGP对HaCaT细胞表达和分泌IL-18影响
见表1。0.5、2.5 mg/L TGP作用于HaCaT细胞48 h,IL-18的分泌量及mRNA的表达高于对照组(均P<0.05);12.5 mg/L TGP作用48 h后HaCaT细胞IL-18的分泌量及mRNA的表达与对照组之间差异无统计学意义(均P>0.05);TGP在62.5、125 mg/L时,IL-18的分泌及mRNA的表达显著低于对照组(均P<0.05),其中在125 mg/L时分泌水平最低(P<0.01)。
经ERKl/2抑制剂PD98059预处理2 h后,再给予125 mg/L TGP作用24 h,HaCaT细胞IL-18的分泌量及mRNA的表达较单独125 mg/L TGP作用时明显增高(均P<0.01)。经JNK l/2拮抗剂SP600125预处理2 h后,再给予125 mg/L TGP作用24 h,HaCaT细胞IL-18的分泌量及mRNA的表达较单独125 mg/L TGP作用时,差异无统计学意义(均P>0.05)。
表1 白芍总苷及相关信号阻断剂对HaCaT细胞表达和分泌IL-18的影响(±s)
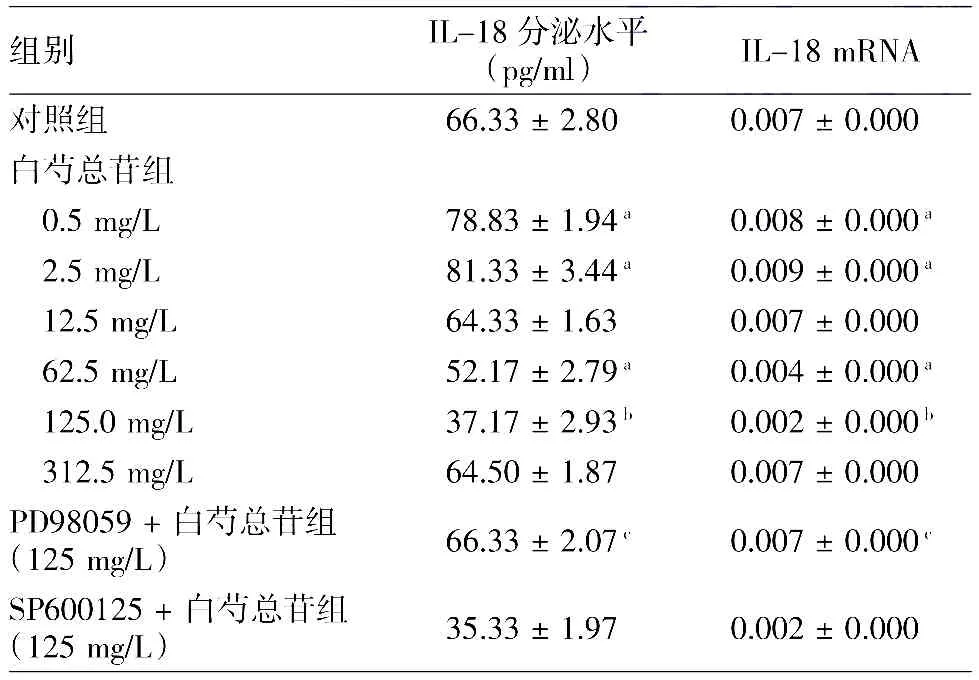
表1 白芍总苷及相关信号阻断剂对HaCaT细胞表达和分泌IL-18的影响(±s)
注:n=6。与对照组相比,a:P<0.05,b:P<0.01;与125 mg/L白芍总苷组比较,c:P<0.05
组别 IL-18分泌水平(pg/ml) IL-18 mRNA对照组 66.33±2.80 0.007±0.000白芍总苷组0.5 mg/L 78.83±1.94a 0.008±0.000a 2.5 mg/L 81.33±3.44a 0.009±0.000a 12.5 mg/L 64.33±1.63 0.007±0.000 62.5 mg/L 52.17±2.79a 0.004±0.000a 125.0 mg/L 37.17±2.93b 0.002±0.000b 312.5 mg/L 64.50±1.87 0.007±0.000 PD98059+白芍总苷组(125 mg/L) 66.33±2.07c 0.007±0.000c SP600125+白芍总苷组(125 mg/L) 35.33±1.97 0.002±0.000
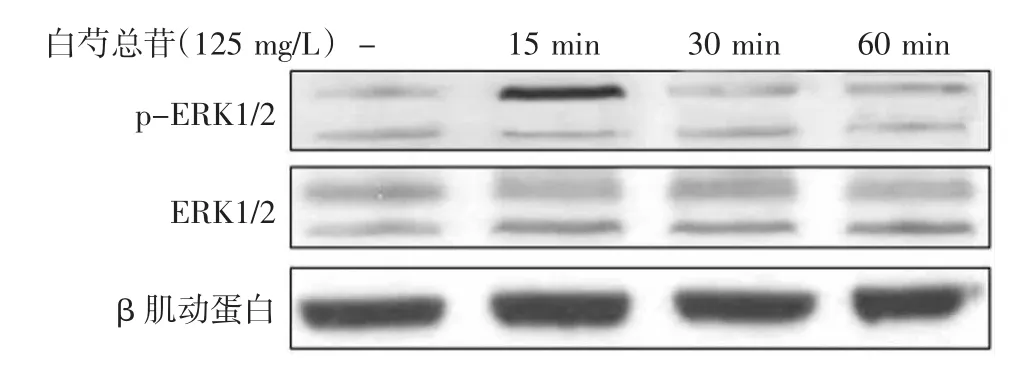
图1 125 mg/L白芍总苷作用于HaCaT细胞,磷酸化ERK1/2 (P-ERK1/2)蛋白表达于15 min达到最高
二、TGP对HaCaT细胞ERK1/2、JNK1/2磷酸化的影响
125 mg/LTGP作用于孵育的HaCaT细胞后,磷酸化ERK1/2(p-ERK1/2)蛋白表达于15 min达到最高,表达水平为0.448±0.018,与对照组(0.204± 0.005)比较,差异有统计学意义(t=50.263,P<0.01),见图1。30 min后p-ERK1/2表达水平逐渐降低至0.213±0.005,60 min后p-ERK1/2表达水平为0.217±0.005,与对照组相比差异无统计学意义(均P>0.05)。125 mg/L TGP作用于HaCaT细胞15、30、60 min时JNK蛋白的磷酸化水平与对照组相比,差异无统计学意义(均P>0.05),见图2。125 mg/L TGP作用于HaCaT细胞15、30、60 min时T-ERK1/2、T-JNK1/2蛋白表达分别与对照组比较,差异无统计学意义(均P>0.05)。

图2 125 mg/L白芍总苷对HaCaT细胞JNK1/2蛋白的磷酸化水平影响不明显

图3 HaCaT细胞经ERKl/2抑制剂PD98059预处理2 h后,再给予125 mg/L白芍总苷孵育15 min,p-ERK1/2表达水平与单独125 mg/L相比明显下降

图4 HaCaT细胞经JNK1/2抑制剂SP600125预处理2 h后,再给予125 mg/L白芍总苷孵育15 min,p-JNK1/2表达水平与单独125 mg/L白芍总苷给药组相比,差异无统计学意义
HaCaT细胞分别经ERKl/2抑制剂PD98059预处理2 h后,再给予125 mg/L TGP孵育15 min,结果p-ERK1/2表达水平为0.237±0.010,与单独125 mg/L TGP给药组相比,差异有统计学意义(t=35.598,P<0.01),见图3。JNK1/2抑制剂SP600125(10 μmol/L)预处理2 h后,再给予125 mg/L TGP孵育15 min, p-JNK1/2表达水平与单独125 mg/L TGP给药组相比,差异无统计学意义(P>0.05),见图4。
讨论
MAPK通路是细胞内的重要信号转导系统,调控细胞的分裂、增殖,主要包括:ERK1/2、JNK和p38。其中,ERK是MAPK家族的经典转导通路之一,有ERK1和ERK2两种亚型,在受到刺激时,通过转录调节诱发多种癌基因的相继激活,参与细胞的增生和分化[6]。JNK是哺乳动物细胞中MAPK的另一亚类,JNK家族已克隆10个JNK异构体,它们分别由JNK1、JNK2和JNK3基因编码,其中JNK1和JNK2在各种组织细胞中广泛表达。MAPK信号传导途径的异常与银屑病发病密切相关。Haase等[7]认为MAPK激酶的活化可以使角质形成细胞增殖率升高致使表皮过度增生,皮炎发生。Zhang等[8]研究表明与银屑病患者非皮损区表皮及正常人表皮相比,银屑病患者皮损中MAPK活性明显增高,而非皮损区表皮与正常人表皮MAPK活性无明显差异。Takahashi等[9]研究显示磷酸化的ERK和JNK在银屑病受累皮肤较非受累皮肤表达升高。
IL-18是IL-1超家族的成员,在神经系统、内分泌系统和免疫系统间是一种重要的介质[10]。IL-18在皮肤免疫应答中发挥重要作用。角质形成细胞IL-18表达异常,与慢性炎症性皮肤病密切相关,如银屑病、特应性皮炎等。角质形成细胞来源的IL-18参与银屑病皮损局部的Thl免疫反应的发生,其活性受到皮肤炎症反应的调节,在炎症反应中具有重要作用[11-13]。研究发现IL-18在银屑病皮损表皮基底层上KC中表达增加,推测IL-18可能通过诱导IFN-γ在银屑病的初始炎症中发挥作用[14]。
TGP药理作用广泛,具有抗炎、调节免疫功能,影响细胞增殖、止痛、保肝等作用。目前TGP治疗银屑病作用机制的研究较多集中在Thl/Th2细胞失衡及其相关细胞因子水平的调节。我们在前期研究中发现[3],TGP可抑制VEGF和IL-23的表达,从而参与抑制KC的增殖,p38MAPK途径可能参与该过程。本研究显示,TGP可以呈时间依赖性地促进ERK1/2磷酸化,JNK磷酸化不明显。ERKl/2抑制剂PD98059可以拮抗 TGP对 HaCaT细胞 IL-18 mRNA和蛋白表达的抑制作用。从以上结果我们推测,TGP可以通过ERK1/2途径,抑制HaCaT细胞对IL-18的表达和分泌,从而减轻银屑病的炎症反应。角质形成细胞增殖和表达炎症因子的信号调控是一个复杂的网络系统,MAPK、蛋白激酶B(PKB)、核因子kB(NF-kB)、激活蛋白1(AP-1)等信号分子均参与角质形成细胞调控过程,MAPK通路与其他的许多通路之间存在广泛的交互作用,TGP治疗银屑病的更多的作用机制有待进一步研究。
[1]何渊民,钟桂书,黎昌强,等.白芍总苷联合阿维A治疗中、重度银屑病32例临床观察[J].中国皮肤性病学杂志,2012,26 (2):185-186.
[2]张宇虹,郭在培,焦晓燕,等.白芍总苷治疗寻常性银屑病的临床疗效观察[J].临床皮肤科杂志,2011,40(7):433-435.
[3]张洪英,史同新,李春阳.白芍总苷对角质形成细胞增殖及血管内皮生长因子和白介素-23表达的影响[J].中华皮肤科杂志,2011,44(5):343-346.
[4]Rasmy H,Mikhael N,Ismail S.Interleukin-18 expression and the response to treatment in patients with psoriasis[J].Arch Med Sci,2011,7(4):713-719.
[5]Companjen AR,van der Velden VH,Vooys A,et al.Human keratinocytes are major producers ofIL-18:predominant expression of the unprocessed form[J].Eur Cytokine Netw,2000,11(3):383-390.
[6]Aebersold DM,Burri P,Beer KT,et al.Expression of hypoxiainducible factor-1alpha:a novelpredictive and prognostic parameter in the radiotherapy of oropharyngeal cancer[J].Cancer Res,2001,61(7):2911-2916.
[7]Haase I,Hobbs RM,Romero MR,et al.A role for mitogen-activated protein kinase activation by integrins in the pathogenesis of psoriasis[J].J Clin Invest,2001,108(4):527-536.
[8]Zhang X,Yang D,Ma S,et al.Up-regulation of activities of mitogen-activated protein kinase in psoriatic lesions[J].J Dermatol Sci,2005,37(2):118-119.
[9]Takahashi H,Ibe M,Nakamura S,et al.Extracellular regulated kinase and c-Jun N-terminal kinase are activated in psoriatic involved epidermis[J].J Dermatol Sci,2002,30(2):94-99.
[10]Sugama S,Conti B.Interleukin-18 and stress[J].Brain Res Rev,2008,58(1):85-95.
[11]Ohta Y,Hamada Y,Katsuoka K.Expression of IL-18 in psoriasis [J].Arch Dermatol Res,2001,293(7):334-342.
[12]Wittmann M,Macdonald A,Renne J.IL-18 and skin inflammation [J].Autoimmun Rev,2009,9(1):45-48.
[13]Kawase Y,Hoshino T,Yokota K,et al.Exacerbated and prolonged allergic and non-allergic inflammatory cutaneous reaction in mice with targeted interleukin-18 expression in the skin[J].J Invest Dermatol,2003,121(3):502-509.
[14]Naik SM,Cannon G,Burbach GJ,et al.Human keratinocytes constitutively express interleukin-18 and secrete biologically active interleukin-18 aftertreatmentwith pro-inflammatory mediators and dinitrochlorobenzene[J].J Invest Dermatol,1999,113(5):766-772.
2014-03-09)
(本文编辑:尚淑贤)
Effect of total glucosides of paeony on the expression of interleukin-18 in human HaCaT keratinocytes and its related signaling pathways
Zhang Hongying*,Wang Xiaoyan,Chen Xingyu,Pang Mingjie,Shi Tongxin.*Department of Dermatology,Qingdao Municipal Hospital,Qingdao 266011,China
Shi Tongxin,Email:shitx2006@163.com
ObjectiveTo evaluate the effect of total glucosides of paeony(TGP)on the expression of interleukin-18(IL-18)in human HaCaT keratinocytes,and to explore the roles of extracelluar signal-regulated protein kinase1/2(ERK1/2)and c-Jun N-terminal kinase 1/2(JNK1/2)signaling pathways in the effect.MethodsSome cultured human HaCaT keratinocytes were classified into three groups:control group treated with dimethyl sulfoxide(0.031%),TGP groups treated with 6 different concentrations(0.5,2.5,12.5,62.5,125.0 and 312.5 mg/L) of TGP respectively,inhibitor groups treated with TGP of 125 mg/L after 2-hour pretreatment with PD98059(an ERK1/2 inhibitor)and SP600125(a JNK1/2 inhibitor)of 10 μmol/L respectively.After additional culture for 48 hours,reverse transcription(RT)-PCR was performed to measure the mRNA expression level of IL-18,and enzymelinked immunosorbent assay(ELISA)to determine the level of IL-18 protein in the culture supernatant of HaCaT cells.Some HaCaT keratinocytes were classified into two groups to be treated with TGP of 125 mg/L for 15,30 and 60 minutes with or without the pretreatment with PD98059 and SP600125 of 10 μmol/L;then,Western blot was carried out to determine the phosphorylation levels of ERK1/2 and JNK1/2 in HaCaT cells.ResultsThe levels of IL-18 mRNA and protein in culture supernatant were significantly increased by TGP of 0.5 and 2.5 mg/L,but decreased by TGP of 62.5 and 125.0 mg/L,and TGP of 125.0 mg/L showed the strongest inhibitory effect.After treatment with TGP of 125.0 mg/L,the level of phosphorylated ERK1/2 in HaCaT cells peaked at 15 minutes(0.448 ±0.018),decreased to 0.213±0.005 at 30 minutes and 0.217±0.005 at 60 minutes,with significant differences between TGP-treated and untreated cells at 15 minutes(0.448±0.018 vs.0.204±0.005,P<0.05)but not at 30 or 60 minutes(bothP>0.05).The phosphorylation level of ERK1/2 was 0.237±0.010 in HaCaT cells pretreated with PD98059 prior to the treatment with TGP,significantly different from that in HaCaT cells treated with TGP only(P<0.01).TGP of 125.0 mg/L had no obvious effect on JNK phosphorylation,and there was no significant difference in the level of phosphorylated JNK1/2 between HaCaT cells untreated and those treated with TGP of 125.0 mg/L for different durations(allP>0.05).ConclusionsTGP can inhibit the expression of IL-18 mRNA and protein in HaCaT cells,likely through the ERK1/2 signaling pathway.
RADIX PAEONIAE ALBA;Keratinocytes;Interleukin-18;Mitogen-activated protein kinases
10.3760/cma.j.issn.0412-4030.2014.10.012
青岛市科技局课题(10-3-3-4-20-nsh)
260011青岛市市立医院皮肤科(张洪英、王小艳、陈星宇、史同新),耳鼻喉科(逢明杰)
史同新,Email:shitx2006@163.com
