VEGF、COX-2、MMP-9在乳腺癌组织中的表达对乳腺钼靶X线征象的影响
2014-12-09李同飞
张 勇,李同飞,张 蕾,杨 帆
(1.泰山医学院校医院,山东 泰安271000;2.泰山医学院附属医院肿瘤科,山东 泰安271000;3.泰山医学院附属医院病理科,山东 泰安271000)
乳腺癌是一种严重危害女性身心健康的恶性肿瘤,发病年龄也呈逐渐年轻化的趋势[1]。乳腺钼靶X线检查是目前诊断乳腺疾病的首选,且分辨率高,简便易行,不受年龄、体形的限制。随着现代分子医学的发展和应用,人们对乳腺癌的研究已从传统的病理形态学研究发展到了分子生物学水平,而分子生物学因素决定了肿瘤的生物学行为和组织病理学改变,进而决定肿瘤的影像学表现[2]。乳腺癌患者乳腺钼靶X 线重要征象与血管及淋巴管生成存在着密切关系,而血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)、环氧化酶-2(cycloxygenase-2,COX-2)、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)在肿瘤血管及淋巴管的生成中起着重要作用,因此探讨乳腺癌组织中这3 种生物学指标与乳腺钼靶X 线征象的关系具有一定的生物学意义。
1 资料与方法
1.1 一般资料
1.1.1 病例资料 收集泰山医学院附属医院2008年1月至2011年12月接受乳腺钼靶X 线检查并手术切除的69 例乳腺浸润性导管癌患者,均为女性,年龄31~65 岁,平均(43.5 ±7.9)岁。
1.1.2 仪器设备 采用德国西门子公司全数字化乳腺钼钯X 线摄影机,69 例患者均行双侧乳腺钼靶X 线检查,所有病例常规拍摄双乳轴位(CC 位)片和内外侧斜位(MLO 位)片。
1.2 分析方法
1.2.1 影像学分析方法 全部X 线片均进行双盲法影像学诊断,并参照美国放射学会创立并推荐的乳腺影像报告及数据系统[3]进行X 线读片及描述,按乳腺钼靶X 线特征性表现分为有无毛刺征组、有无钙化征组、有无异常血管征组及有无淋巴结转移征组分别进行统计分析。见表1。
1.2.2 结果判定标准 显微镜下观察:VEGF、COX-2、MMP-9 阳性信号均定位于细胞浆,呈棕黄色颗粒型表达,不着色为阴性。计数肿瘤细胞中阳性细胞所占比例,参照Miyake 等[4]的方法,阳性细胞≤30%为阴性,>30%为阳性。
1.3 统计学处理 应用SAS 8.1 进行数据分析,计数资料通过χ2检验分析,检验水准α=0.05。
2 结果
2.1 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线毛刺征影像的关系 见表2。

表2 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线毛刺征影像的关系 %
2.2 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线钙化征影像的关系 见表3。

表3 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线钙化征影像的关系 %
2.3 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线异常血管征影像的关系 见表4。
2.4 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线淋巴结转移征影像的关系 见表5。

表4 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线异常血管征影像的关系 %
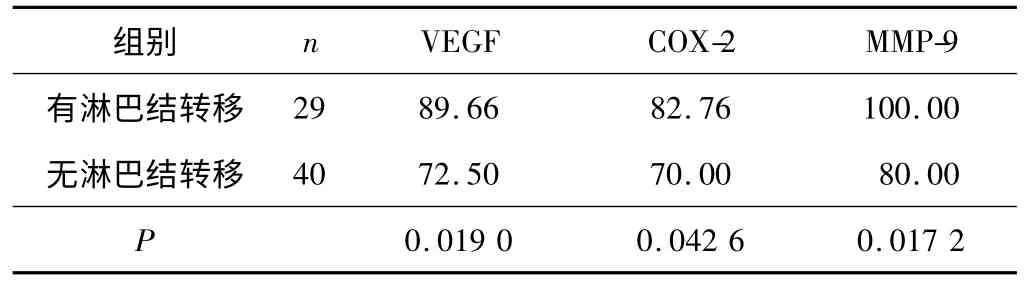
表5 VEGF、COX-2、MMP-9 表达与乳腺钼靶X 线淋巴结转移征影像的关系 %
3 讨论
3.1 VEGF、COX-2、MMP-9 的表达对乳腺钼靶X 线毛刺征的影响 毛刺征是乳腺钼靶X 线诊断乳腺癌的重要征象之一,恶性可能性为81% ~97%,主要是以肿块为中心,向周围呈放射状分布的条索状致密影。可分为以下几类:肿瘤组织浸润毛刺由肿瘤组织直接向外扩散形成,有根粗尖细的特点;淋巴管型毛刺是以肿块为中心从周围淋巴管向外浸润形成放射状细条状毛刺;乳腺导管型毛刺是由肿块周围导管受肿瘤细胞浸润所致,毛刺既粗又长,且易合并导管内钙化;血管型毛刺是由肿块供血血管、部分新生血管及扩张毛细血管组成的以肿瘤为中心向周围放射的血管群。2008年史春颖等[5]也研究发现乳腺癌肿块边缘毛刺征与肿瘤细胞中VEGF 表达密切相关。本组研究结果显示,乳腺癌肿块有毛刺的VEGF、COX-2、MMP-9 的阳性表达率明显高于无毛刺组。有毛刺征的肿块,MMP-9 表达最高,其溶解Ⅳ型胶原,破坏各层基底膜,使肿瘤向周围组织浸润,这是毛刺征产生的病理基础,而VEGF、COX-2 的升高,促使更多的肿瘤微血管形成,使肿瘤向周围组织的浸润性生长成为可能,说明肿瘤组织的增殖能力旺盛,使毛刺征的出现也成为可能。本组研究表明,VEGF、COX-2、MMP-9 的高表达对乳腺癌在乳腺钼靶X 线征象中毛刺征的产生有着一定的影响,并存在着一定的关系,共同提示了乳腺肿块增殖较活跃及向周围组织生长较快,预示了有此类乳钼靶X线征象的乳腺癌患者预后较差。
3.2 VEGF、COX-2、MMP-9 的表达对乳腺钼靶X 线钙化征的影响 钙化在乳腺疾病的诊断中也占据特别重要的位置,作为乳腺癌的一个重要征象,可以帮助确诊乳腺癌。通常可从钙化的形态特点、钙化的密度及大小差异、钙化分布的差异、钙化与并发病变的关系进行分析和鉴别,而乳腺钼靶X 线对钙化检出有着明显优势。出现钙化的原因很复杂,而且目前关于乳腺癌微小钙化的发生机制,尚不十分清楚,主要存在2 种观点[6-7]:一种是细胞活跃分泌钙化论,认为生长旺盛肿瘤细胞钙质新陈代谢增强,分泌大量钙质,导致超饱和,引起钙质沉着,逐渐形成大小不同、分布不均和密度不等的钙化点;另一种是细胞坏死钙化论,认为肿瘤细胞代谢旺盛,肿瘤组织局部缺血坏死,细胞裂解为碎屑,同时分解出大量磷酸根,与局部钙离子结合,从而形成磷酸钙盐沉积。病理上60% ~83%的乳腺癌可见到钙化,与病理对照也显示,乳腺钼靶X 线上群集钙化的数量越多,恶性的可能性越大。有时肿块不明显,钙化可能是恶性的惟一征象[8],但本组研究表明,虽然钙化可作为恶性诊断的重要特征之一,但其与VEGF、COX-2、MMP-9 的表达无明显关系。我们分析原因可能有以下几方面:首先,钙化产生的部位不同,其产生的机制不同,位于肿块中央的钙化的产生可能是由于肿瘤代谢旺盛,血液供应不足,产生坏死钙盐沉积,形成钙化。而位于肿块周围组织的钙化可能是由于细胞分泌产生,其与肿块生长是否旺盛无明确关系。其次,钙化的数目不同,其反映的肿块生长速度是否存在差异,目前无明确理论依据。关于乳腺癌肿块钙化与VEGF、COX-2、MMP-9 的关系有待于进一步研究。
3.3 VEGF、COX-2、MMP-9 的表达对乳腺钼靶X 线异常血管征的影响 异常血管征也是乳腺癌的乳腺钼靶X 线间接征象的一项特征。而在乳腺癌演变的过程中,血管生成已经成为肿瘤生长和转移的先决条件,血管生长在原发肿瘤生长与侵袭中至关重要。其中VEGF 又是血管的形成过程中最重要的血管刺激因子[9],VEGF 的表达程度已被认为在一些肿瘤中是影响患者生存的独立预后指标。本组研究结果显示,异常血管征组的VEGF、COX-2、MMP-9 的阳性表达率明显高于无异常血管征组。VEGF 与COX-2、MMP-9 同时表达,使新生内皮细胞重排和吻合形成新生血管,使肿瘤代谢旺盛,出现乳腺钼靶X 线血管影增多增粗。因而在乳腺钼靶X 线摄影中肿块周围异常血管征象自然成为乳腺癌的特征之一,表现为肿瘤病灶周围的迂曲扩张、密集形成网状分布血管或沿肿块周围呈毛刺状、放射状或排笔状密集排列。本组研究表明,VEGF、COX-2、MMP-9 的高表达反映乳腺癌组织的增生、增殖活跃,对乳腺癌在乳腺钼靶X 线中异常血管征的产生有着一定的影响,并存在着一定的关系,预示了有此类乳腺钼靶X 线特征的乳腺癌患者预后较差[10]。
3.4 VEGF、COX-2、MMP-9 的表达对钼靶X 线淋巴结转移征的影响 乳腺癌准确的术前分期是治疗成败的关键,而乳腺癌的淋巴结转移是判断术前分期的重要依据。临床判断淋巴结转移误差较大,最终确诊依靠淋巴结穿刺和手术病理结果。乳腺腋窝转移性淋巴结主要表现为淋巴结密度的改变,与其大小相关性较低。乳腺钼靶X 线能较好地区分脂肪、腺体、肌肉、淋巴结和皮肤的密度,观察到淋巴结形态、密度及全貌,对判断乳腺腋窝淋巴结转移有明显的优势。本组研究结果显示,有淋巴转移征组的VEGF、COX-2、MMP-9的阳性表达率明显高于无淋巴结转移征组。而观察已经发现,VEGF、COX-2、MMP-9 在血管和淋巴管新生中起着相同的介导作用,其中COX-2 能直接刺激内皮细胞的迁移、上调MMP-9、刺激肿瘤细胞增殖、抑制肿瘤细胞调亡,在适当的部位形成管样结构,完成淋巴管的重塑,实现乳腺癌淋巴管的转移。血管和淋巴管除了具有相似的重塑过程之外,在诸多体内的研究中,血管丛又经常与淋巴管丛相伴,虽然淋巴管与血管的比例依赖于组织类型和功能而有所不同,但邻近丰富的血供为淋巴管提供了必不可少的营养,这也是淋巴管产生足够的功能、维持淋巴管内皮细胞内在的收缩性以及产生快速应答所需要的,并成为在有机体内维持液体平衡不可缺少的过程。因此本研究也表明了,VEGF、COX-2、MMP-9 的高表达对乳腺癌在乳腺钼靶X 线中淋巴结转移征的出现有着一定的影响,并存在着一定的关系,共同提示了乳腺癌的淋巴及远处转移,预示了有此类乳腺钼靶X 线特征的乳腺癌患者预后较差。
乳腺钼靶X 线检查是临床筛查和诊断乳腺癌的首选方法,把乳腺钼靶X 线检查作为预测乳腺癌患者VEGF、COX-2、MMP-9 表达情况的无创手段,为间接判断肿瘤生物学行为、评价患者预后及指导治疗提供辅助理论依据。
[1]毕晔,边莉,黄椠,等. 我国乳腺癌热点问题研究的现状分析[J].中华肿瘤防治杂志,2006,13(16):1205 -1211.
[2]Greenlee RT,Hill-Harmon MB,Murray T,et al. Cancer statistics,2001.CA Cancer J Clin,2001,51(1):15 -36.
[3]陈圆圆,李智贤,刘军杰.常规超声结合超声弹性成像对乳腺癌的鉴别诊断价值[J].广东医学,2012,33(23):3560 -3562.
[4]Miyake M,Taki T,Hitomi S,et al.Correlation of expression of H/Le(y)/Le(b)antigens with survival in patients with carcinoma of the lung[J].N Engl J Med,1992,327(1):14 -18.
[5]史春颖,陈颖.乳腺癌X 线特征与VEGF-C 表达及肿瘤腋窝淋巴结转移的相关性研究[J].临床放射学杂志,2008,27(6):792-795.
[6]林玉斌. 乳腺肿瘤的钼靶X 线诊断[J]. 实用放射学杂志,2003,19(4):356 -358.
[7]彭庆蓥,胡大章.全数字化乳腺X 线引导下钙化灶导丝定位活检对早期乳腺癌诊断的意义[J]. 肿瘤基础与临床,2012,25(1):63 -64.
[8]Stomper PC,Connolly JL. Ductal carcinoma in situ of the breast:correlation between mammographic calcification and tumor subtype[J].AJR Am J Roentgenol,1992,159(3):483 -485.
[9]Weidner N. Tumoural vascularity as a prognostic factor in cancer patients:the evidence continues to grow[J]. J Pathol,1998,184(2):119 -122.
