十枣汤对肺纤维化大鼠血清TNF-α和TGF-β1浓度的影响※
2014-12-04宋启兰王燕青
宋启兰 王燕青 王 宁
(1青岛大学医学院,青岛266021;2山东省青岛市海慈医疗集团,青岛266033)
十枣汤对肺纤维化大鼠血清TNF-α和TGF-β1浓度的影响※
宋启兰1王燕青2*王 宁2
(1青岛大学医学院,青岛266021;2山东省青岛市海慈医疗集团,青岛266033)
目的 通过检测博莱霉素所致肺纤维化大鼠血清中肿瘤坏死因子-α(TNF-α)和转化生长因子-β1(TGF-β1)浓度,探讨十枣汤对肺纤维化大鼠的治疗作用及疗效机制。方法 108只雄性健康Wistar大鼠随机分为6组:空白对照、模型对照、强的松、十枣汤低剂量、十枣汤中剂量、十枣汤高剂量组,每组18只。空白对照组以气管内注入生理盐水的方法设立对照,余各组气管内注入博莱霉素建立肺纤维化模型,造模第2天始进行药物干预,第14天、28天各处死9只大鼠,采集血清,取右肺,光镜下观察肺组织病理变化,ELISA法检测血清中TNF-α和TGF-β1浓度。结果 给药后第14、28天,与空白对照组相比,模型对照组出现典型肺纤维化改变,血清TNF-α和TGF-β1的浓度明显升高 (P<0.01);与模型对照组相比,各药物治疗组肺纤维化程度明显改善,血清TNF-α和TGF-β1的浓度显著降低(P<0.01);十枣汤高剂量组血清TNF-α和TGF-β1的浓度较其余各组显著降低 (P<0.01)。给药第14d时,强的松组与十枣汤低、中剂量组大鼠血清TNF-α浓度无显著差异(P>0.05),与十枣汤中剂量组血清中TGF-β1浓度无显著差异 (P>0.05);28天时,强的松组大鼠血清TNF-α含量较十枣汤低剂量组低,有显著差异 (P<0.05),与十枣汤中剂量组无显著差异 (P>0.05);强的松组与十枣汤低剂量组大鼠血清中TGF-β1浓度无显著性差异 (P>0.05),十枣汤中剂量组比强的松组大鼠血清中TGF-β1低,有显著差异 (P<0.05)。结论十枣汤可减轻博来霉素所致肺纤维化大鼠血清中TNF-α、TGF-β1的含量,延缓肺纤维化进展,减轻肺纤维化程度。
肺纤维化;十枣汤;大鼠;肿瘤坏死因子-α;转化生长因子-β1;实验研究
肺纤维化 (PF)是在炎症损伤和修复过程中形成的一种病理改变,病情凶险,发病率逐年增高[1]。特发性肺纤维化 (IPF)是一种致死性疾病,预后极差[2-3],现代医学治疗乏策,国内外有众多研究,但均无重大突破[4]。大量研究表明TNF-α、TGF-β1和PF形成密切相关[5],研究表明IPF患者和博莱霉素所致小鼠血清中TGF-β1含量均较正常组升高[6]。十枣汤治疗顽固性咳嗽等肺系疾病疗效显著[7],导师在临床中以十枣汤治疗PF,短期内即可改善症状,然其机制尚不明确,故设立本实验,观察十枣汤对肺纤维化大鼠血清中TNF-α、TGF-β1浓度的影响,为十枣汤治疗PF提供实验依据。
1 实验材料
1.1 实验动物 健康清洁级雄性Wsitar大鼠108只,许可证号:SCXK鲁20170001。
1.2 实验药物及试剂
1.2.1 十枣汤 甘遂、大戟、芫花各等分,研末,由青岛健联药店有限公司提供,用药剂量据大鼠与人每公斤体重折算系数计算[8],十枣汤低、中、高剂量组大鼠,每次每只需用上述生药各9mg、18mg、54mg,即三药总量分别为27mg、54mg、162mg,大枣每次每只大鼠540mg,临用前将三组药物粉末混合均匀,分别用枣汤配制成9mg/ml、18mg/ml、54mg/ml的混悬液,其中每ml含大枣生药180mg。
1.2.2 药品及试剂 注射用盐酸博莱霉素:日本化药株式会社,规格15mg,批号Y20262。配制成5mg/ml的溶液。强的松片:上海信谊药厂,规格5mg,研末,以生理盐水制成浓度为0.5mg/ml悬浊液。水合氯醛:海慈医疗集团制剂室提供。TNF-α、TGF-β1ELISA试剂盒(欣博盛生物科技有限公司)。
1.3 仪器 PYX-DHS-X隔水式电热恒温培养箱:上海市跃进医疗器械厂;Nikon YS100光学显微镜:日本Olympus公司;酶标仪(Multi skan Ascent V 1.24 345-0063T浙江分析仪器厂)。
2 实验方法
2.1 动物分组 按随机数字表法将108只wistar大鼠分为正常对照、模型对照、强的松、十枣汤低剂量、十枣汤中剂量、十枣汤高剂量组,每组18只。
2.2 动物模型的制备 模型对照及各药物治疗组共90只大鼠,按照文献报道[9],以经咽喉气管插管注入博莱霉素的方法复制PF模型。腹腔注射水合氯醛麻醉大鼠,以泵前软管行气管插管,于大鼠吸气瞬间,迅速向气管内注入博莱霉素溶液(1ml/kg),再向气管内注入空气,将鼠板直立左右旋转数次,并轻揉胸部片刻,促使药物均匀地分布于肺组织内。空白对照组采用同样方法注入生理盐水(1ml/kg)。
2.3 给药方法和途径 各组均从造模第2天开始给药,用药量据大鼠与人每公斤体重折算系数[7]计算,以灌胃方式给药,每天一次。强的松组给予强的松5mg/kg/d;十枣汤低、中、高剂量组大鼠按三药总量135mg/kg/d、270mg/kg/d、710mg/kg/d给药;空白对照和模型对照组均给予相同体积的生理盐水。
2.4 观察指标与检测方法 给药后第14天各组随机抽取9只大鼠处死,第28天处死剩余大鼠。腹腔注射水合氯醛麻醉,打开腹腔,腹主动脉取血5ml,低温下离心,取上清液,-20℃保存备测;摘取右肺,甲醛固定24h,行HE染色,观察所选取肺组织的病理变化情况,按定量分级标准定量肺泡炎和肺纤维化的程度[10];ELISA法检测大鼠血清TNF-α、TGF-β1含量,操作严格按说明书的步骤进行。
2.5 统计学处理 以SPSS17.0进行分析,结果以均数±标准差(±s)表示,符合正态分布及方差齐性,则进行单因素方差分析,多重比较用LSD法;若方差不齐,采用多重秩和检验。以P<0.05为差异有统计学意义。
3 结果
3.1 大鼠存活率 十枣汤中剂量组大鼠于造模第二天死亡1只,强的松组第9天死亡1只,其余各组无大鼠死亡,各组存活率比较差异无统计学意义(P>0.05)。
3.2 各组大鼠肺组织的病理表现
3.2.1 肺整体形态观察 空白对照组:呈粉红色,表面光滑,弹性好。模型对照组:表面凹凸不平,颜色暗,可见斑点状出血,部分肺叶体积缩小,可见灰白色结节,弹性差。强的松组和十枣汤低、中剂量组:颜色略暗红,表面稍粗糙,弹性可,出血点、结节等情况较轻。十枣汤高剂量组较空白对照组大鼠肺组织外观无明显差异。
3.2.2 HE染色 光镜下观察:空白对照组肺内结构清晰,肺泡结构完整,大小均匀,肺泡壁及肺泡间隔未见增厚,肺泡腔内未见渗出。模型对照组:第14天可见肺泡间隔增厚,大量炎症细胞浸润,部分肺泡结构破坏;第28天,肺泡壁增厚,肺泡腔缩小,部分肺泡塌陷、融合,间质有胶原纤维沉积,肺纤维化程度明显加重,与文献报道[10]一致,证明造模成功。
光镜下观察HE染色结果,依据Szapiel[10]等提供之方法确定肺泡炎和纤维化的程度。第14天、28天大鼠肺泡炎病理学积分结果见表1。
表1 各组大鼠第14天、28天肺泡炎病理学积分结果±s,分)

表1 各组大鼠第14天、28天肺泡炎病理学积分结果±s,分)
注:F=13.713,13.778。●与空白对照组相比,P<0.05;※与模型对照组相比,P<0.05;△与强的松组比较,P>0.05;▲与强的松组相比,P<0.05;☆与空白对照组相比,P>0.05,与十枣汤高剂量相比,P<0.05
组别14d 28d空白对照组1.470±0.284 1.549±0.296模型对照组2.598±0.339●2.475±0.291●强的松组2.137±0.296●※2.208±0.223●※十枣汤低剂量组2.223±0.337●※△★2.153±0.202●※△★十枣汤中剂量组2.121±0.347●※△★2.125±0.188●※△★十枣汤高剂量组1.814±0.176☆※▲1.863±0.344●※▲
3.3 各组大鼠血清TNF-α、TGF-β1含量比较
3.3.1 给药第14天时各组大鼠血清中TNF-α、TGF-β1含量的比较 第14天时,模型对照组及各药物治疗组大鼠血清TNF-α、TGF-β1含量均较空白对照组高,有显著差异 (P<0.01);各药物治疗组大鼠血清中TNF-α、TGF-β1的含量较模型对照组低,有显著差异(P<0.01);十枣汤高剂量组大鼠血清中TNF-α、TGF-β1含量较余治疗组低,有显著差异 (P<0.01);强的松组与十枣汤低、中剂量组相比,大鼠血清TNF-α的含量差异无统计学意义 (P>0.05);强的松组与十枣汤低剂量组大鼠血清中TGF-β1含量差异无统计学意义 (P>0.05);十枣汤低剂量组与十枣汤中剂量组相比,大鼠血清TNF-α、TGF-β1含量差异无统计学意义 (P >0.05)。
表2 第14天各组大鼠血清中TNF-α、TGF-β1含量比较 (±s,pg/ml)
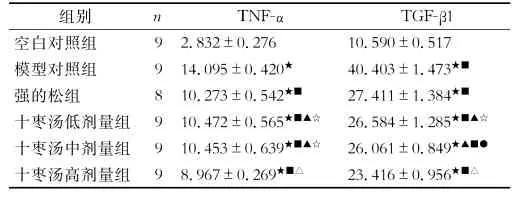
表2 第14天各组大鼠血清中TNF-α、TGF-β1含量比较 (±s,pg/ml)
注:F=510.726,599.905;★与空白对照组比较,P<0.01;■ 与模型组比较,P<0.01;△与强的松组比较,P<0.01;▲与十枣汤高剂量组比较,P<0.01;☆与强的松组比较,P>0.05;●与强的松组比较,P<0.05
?
3.3.2 第28天各组大鼠血清TNF-α、TGF-β1含量的比较 第28天时,模型对照组及各药物治疗组大鼠血清TNF-α、TGF-β1含量均较空白对照组高,有显著性差异 (P<0.01);各药物治疗组大鼠血清中TNF-α、TGF-β1的含量均较模型对照组低,有显著性差异 (P<0.01);十枣汤高剂量组大鼠血清中TNF-α、TGF-β1含量均较其他各治疗组低,有显著性差异 (P<0.01);强的松组大鼠血清中TNF-α含量较十枣汤低剂量组低,有显著性差异 (P<0.05);十枣汤中剂量组与强的松组相比较,大鼠血清TNF-α的含量差异无统计学意义 (P>0.05);强的松组与十枣汤低剂量组大鼠血清中TGF-β1含量差异无统计学意义 (P>0.05);十枣汤中剂量组大鼠血清中TNF-α含量比十枣汤低剂量组低,有显著性差异 (P<0.05);十枣汤低剂量组和十枣汤中剂量组大鼠血清中TGF-β1含量差异无统计学意义 (P>0.05)。
表3 第28天各组大鼠血清TNF-α、TGF-β1含量比较±s,pg/ml)

表3 第28天各组大鼠血清TNF-α、TGF-β1含量比较±s,pg/ml)
注:F=594.663,842.268;★与空白对照组比较,P<0.01;■与模型组比较,P<0.01;△与强的松组比较,P>0.05;▲与强的松组比较,P<0.05;◆与十枣汤高剂量组比较,P<0.01;☆与十枣汤低剂量组比较,P>0.05
组别n TNF-α(pg/ml)TGF-β1(pg/ml)空白对照组9 2.641±0.297 10.444±0.524模型对照组9 12.686±0.551★41.953±1.473★■强的松组9 10.107±0.513★■25.544±1.040★■十枣汤低剂量组9 10.670±0.420★■▲◆25.087±1.374★■△◆十枣汤中剂量组9 10.138±0.516★■△◆24.452±0.800★■▲◆☆十枣汤高剂量组9 7.822±0.311★■▲22.082±0.927★■▲
4讨论
肺纤维化是现代医学间质性肺疾病范畴,病理上以炎性病变和损伤所致的肺组织结构破坏为特征[11]。具体发病机制尚未完全阐明,大量研究发现细胞因子对PF的形成与发展有重要作用。
PF属于中医学气短、咳嗽、喘证、肺痿、肺痹等范畴[12];导师王燕青主任认为PF病因无论痰饮、瘀血、邪毒等均为实证,病机为邪气壅实,且因其病情凶险,治疗需以猛药峻剂攻其邪。十枣汤乃仲景治疗咳喘常用方,方中甘遂、大戟、芫花三药功可逐水散结止咳喘,且皆入肺经,肺与大肠相表里,十枣汤可引起峻泻,使邪气从大肠而去。且气能行津,津能载气,泻水实为泻肺中邪气,实乃 “洁净府,去菀陈莝法也。”
TNF-α可介导众多炎症和免疫调节反应,生物学活性广泛,过度表达的内源性TNF-α可促进PF的形成[13]。TNF-α可聚集炎症细胞,激活嗜中性粒细胞,介导肺泡炎症反应,刺激、促进胶原合成,诱导生成TGF-β1,诱导细胞凋亡和坏死,在PF发生和发展过程中发挥免疫调节作用[14-15]。TGF-β1是目前已知最有效直接刺激胶原纤维合成的细胞因子,被喻为细胞因子网络的开关,参与PF的诱导及启动,制约着PF发展的方向[13]。它可促进成纤维细胞的增殖聚集,刺激合成胶原蛋白,增加肺间质胶原纤维含量[15],抑制纤溶酶原和胶原蛋白酶活性,减少细胞外基质降解[16],影响血小板源性生长因子、血管内皮生长因子等的表达和白介素、干扰素等的合成分泌,促进PF的形成。综上,TNF-α与TGF-β1在PF的发病中有重要意义。
本研究显示,模型对照组大鼠血清中TNF-α与TGF-β1含量较空白对照组显著升高,与文献报道一致[6],说明博莱霉素不仅诱导大鼠肺纤维化,还介导了全身的炎症反应。十枣汤各剂量组大鼠肺泡炎评分和血清中TNF-α和TGF-β1含量均低于模型对照组,提示十枣汤能够有效缓解博莱霉素诱导的PF程度,其机制可能与降低血清中TNF-α和TGF-β1水平有关。
综上所述,十枣汤对博莱霉素所诱导的大鼠PF有治疗作用,为峻下逐水法治疗肺纤维化提供了初步实验依据,为PF的治疗提供了新的出路,但其发病机制复杂,还需大量后续实验及临床研究。
[1]陈灏珠,林果为.实用内科学[M].13版.北京:人民卫生出版社,2009:1817-1825.
[2]Raghu G,et al.An Official ATS/ERS/JRS/ALAT Statement:Idiopathic Pulmonary Fibrosis:Evidence-based Guidelines for Diagnosis and Management.Am J Respir Crit Care Med.2011 Mar 15;183(6):788-824.
[3]Nathan SD,Shlobin OA,Weir N,et al.Long-term course and prognosis of idiopathic pulmonary fibrosis in the new millennium[J].Chest,2011 Jul,40(1):221-229.
[4]Cottin V.Changing the idiopathic pulmonary fibrosis treatment approach and improving patient outcomes[J].Eur Respir Rev.2012,Jun 1,21(124):161-167.
[5]Francesca LS,Ekaterina G,Ann R,et al.Human eosinophils regulate human lung-and skin-derived fibroblast properties in vitro:A role for transforming growth factorβ(TGF-β)[J].PNAS 1999,96(7):9660-9665.
[6]芮炜玮,易祥华.转化生长因子β1及相关细胞因子在肺纤维化发生中的作用[J].同济大学学报,2010,31(3):133-136.
[7]姜宗瑞.十枣汤的临床运用[J].中国社区医师,2003,19(8):37-38.
[8]黄继汉,黄晓晖,陈志扬,等.药理试验中动物间和动物与人体间的等效剂量换算[J].中国临床药理学与治疗学,2004,9(9):1069-1072.
[9]齐曼古丽·吾守尔,夏宇,巴哈尔古丽·米吉,提等.博莱霉素致大鼠肺纤维化模型的建立方法及比较[J].新疆医科大学学报,2005,28(6),495-498.
[10]Szapiel SV,Elson NA,Fulmer JD,et al.Bleomycin induced interstitial pulmonary disease in the nude,athymic mouse[J].Am Rev Respir Dis,1979,120(4):893-899.
[11]SongJS,KangCM,RheeCK,et al.Effects of elastase inhibitor on the epithelial cell apoptosis in bleomycin-induced pulmonary fibrosis[J].Exp Lung Res,2009,35(10):817-829.
[12]侯志英.肺纤维化的中医药研究进展[J].中医药学报,2009,37(3):82-84.
[13]杨霞,肺纤维化中细胞因子网络[J].武警医学院学报,2009,18,(3):245-248.
[14]Zhu Z,Zheng T,Homer RJ,et al.Acidic mammalian chitinase in asthmatic Th2 inflammation and IL-13 pathway activation[J].Science,2004,304:1678-1682.
[15]于露,刘跃建.肿瘤坏死因子-α及转化生长因子-β1在肺纤维化形成中的作用研究进展[J].实用医院临床杂志,2012,9(3):163-165.
[16]Branton M H,Kopp J B.TGF-beta and fibrosis[J].Microbes Infect,1999,1(15):1349-1365.
The Ef f e c t o f Shiz ao tan g on Se r um TNF-αan d TGF-βLe v el s-αan d TGF-βLe v els in r at s wit h Pulmo na r y Fib r o sis Rat s
Song Qilan1W ang Yanqing2Wang N ing2
(1 Qingdao University M edical College'QingDao'266021'China;2 Qin Dao H iser M edical G roup'QingDao 266033'China'China)
Objective To assess the efficacy and mechanism of Shizao Tang in the treatment of pulmonary fibrosis in rats through detecting the levels of serum Tumor necrosis actor-alpha(TNF-α)and Transforming growth factor betal(TGF-β1).Methods 108 male Wistar rats were equally randomized to six groups as normal control,model control,prednisone,Shizao Tang low dose,Shizao Tang middle dose,Shizao Tang high dose.Normal control group was given normal saline instead,while the rest of the 5 groups induced pulmonary fibrosis with bleomycin endotracheally.Corresponding drugs were given the next day upon completion of the model.After 14 and 28 days of medication,9 rats in each group were sacrificed respectively.The pathology of lung tissue was observed microscopically.Serum samples were collected for TNF-αand TGF-βdetection by ELLISA.Results Compared with normal control group,the lung tissue in the model control group showed obvious pulmonary alveolitis and fibrosis.and the levels of TGF-β1and TNF-αin serum were significant higher(P<0.01).Compared with model control group,pulmonary fibrosis in each treatment group significantly improved,and TNF-αand TGF-β1levels were lower(P<0.01);TNF-αand TGF-β1levels in Shizao Tang high dose group were much lower than other groups(P<0.01);Deference between prednisone group and Shizao Tang low dose,prednisone group and Shizao Tang middle dose on TNF-αlevels was not markedly(P>0.05),and there had not significant difference between prednisone group and Shizao Tang middle dose group on TGF-β1levels(P>0.05)on the 14th day.On the 28th day,compared with prednisone group,
the TNF-αlevels in Shizao Tang low dose group were higher(P<0.05),but the difference between prednisone group and Shizao Tang middle dose group was not significantly(P>0.05),TGF-β1levels in Shizao Tang middle dose group were much lower(P<0.05),but there was not significantly difference between Shizao Tang low dose group and prednisone group on TGF-β1levels(P>0.05).Conclusion Shizao Tang may decline TNF-αand TGF-β1levels in rats with pulmonary fibrosis induced by bleomycin and relieve the degree of pulmonary fibrosis.
Pulmonary fibrosis;rats;Shizao Decoction;TNF-α;TGF-β1
doo:10.3969/j.issn.1672-2779.2014.08.100
1672-2779(2014)-08-0001-02
山东省青岛市中医科研计划项目[No:2014-ZYY007]
*通讯作者
杨 杰 本文校对:
2013-12-19)
