抗胆碱酯酶药对寻常型天疱疮鼠模型棘层松解的影响
2014-12-04韦高郑文军周琼
韦高 郑文军 周琼
抗胆碱酯酶药对寻常型天疱疮鼠模型棘层松解的影响
韦高 郑文军 周琼
目的通过鼠模型研究抗胆碱酯酶药对寻常型天疱疮(PV)棘层松解的影响。方法将55只Balb/c新生鼠分为4组,模型组:15只,将PV患者血清通过皮下注射BALB/c新生鼠建立PV鼠模型;溴吡斯的明组、甲硫酸新斯的明组:各15只,在注射患者血清的同时,分别注射溴吡斯的明及甲硫酸新斯的明;对照组:10只,皮下注射生理氯化钠溶液。从临床表现、组织病理和直接免疫荧光三方面评价抗胆碱酯酶药对PV鼠棘层松解的影响。结果模型组单独注射PV患者血清能在BALB/c新生鼠中诱导出PV的改变。模型组棘层松解程度高于溴吡斯的明组(H=21.584,P<0.001)及甲硫酸新斯的明组(H=20.641,P<0.001),对照组BALB/c新生鼠未发生明显变化。结论抗胆碱酯酶药可降低PV鼠模型的棘层松解程度。
天疱疮;疾病模型,动物;胆碱酯酶抑制剂
天疱疮是一种自身免疫性大疱性皮肤病,随着对天疱疮发病机制研究的深入,有学者提出“多重打击学说”[1],即天疱疮发病是由于抗胆碱能受体抗体造成棘层松解,使桥粒芯蛋白等细胞间黏附因子的抗原表位暴露,从而产生相应抗体。同时也有学者报道,85%的天疱疮患者血清中抗胆碱能受体抗体阳性[2]。基于“多重打击学说”,拟胆碱能药物对天疱疮的非激素治疗引起了重视。拟胆碱能药物分为乙酰胆碱受体激动剂及抗胆碱酯酶药两类,其中乙酰胆碱受体激动剂卡巴胆碱对天疱疮棘层松解的阻断作用已有动物实验证实,而抗胆碱酯酶药是否也存在同样的效果,仅见个别病例报道[3],尚缺乏实验论证。我们拟通过鼠模型探讨抗胆碱酯酶药对寻常型天疱疮棘层松解的影响。
资料与方法
一、资料
1.天疱疮患者血清采集及测定:取自1例广西医科大学第一附属医院皮肤科住院患者。病情处于活动期,经临床、常规病理、直接免疫荧光(DIF)与间接免疫荧光(IIF)检查确诊为寻常型天疱疮,未经糖皮质激素及免疫抑制剂治疗。采血80 ml后保存于-70℃冰箱。
2.主要试剂:溴吡斯的明干粉(美国Sigma公司),甲硫酸新斯的明注射液(河南润弘制药公司),异硫氰酸荧光素(FITC)标记免抗人IgG抗体(北京博奥森公司)。
二、方法
1.实验动物:BALB/c新生鼠55只,清洁级,出生后3 d,体重1~2 g,广西医科大学实验动物中心提供(SCXK桂2009-0002)。
2.分组:采用随机数字表法将实验动物分为4组,模型组、溴吡斯的明组及甲硫酸新斯的明组各15只,对照组10只。模型组:于鼠背部皮下注射PV患者血清100 μl/g体重,每天1次,连续注射2次;溴吡斯的明组:于鼠背部皮下注射PV患者血清(100 μl/g体重)+溴吡斯的明(0.1 μg/g体重),每天 1次,连续注射2次;甲硫酸新斯的明组:于鼠背部皮下注射PV患者血清(100 μl/g体重)+甲硫酸新斯的明(0.01 μg/g体重),每天 1次,连续注射 2次;对照组:于鼠背部皮下注射生理氯化钠溶液(100 μl/g体重),每天1次,连续注射2次。
3.结果观察:第1次注射后24 h及48 h观察各BALB/c新生鼠皮肤黏膜有无自发水疱及糜烂面,有无尼氏征出现,48 h后处死。出现尼氏征的BALB/c新生鼠取皮损及其周围皮肤、未出现尼氏征的取背部皮肤行常规病理检查,取腹部皮肤行直接免疫荧光检查。
4.病理检查:皮肤标本用4%甲醛溶液固定,脱水,石蜡包埋,切片,常规苏木精-伊红(HE)染色,光镜下观察并摄片。按文献[4]方法判定棘刺松解程度。
5.直接免疫荧光检查:腹部皮肤置于生理氯化钠溶液,OCT(optimum cutting temperature)组织液包埋,-20℃冰冻切片,切片厚度4 μm,用0.01 mol/L PBS按1∶40稀释FITC标记的兔抗人IgG抗体,每份标本加入20 μl,置37℃湿盒30 min,PBS冲洗,荧光显微镜观察结果并摄片。按文献[5]方法判定免疫荧光强度。
6.统计学分析:用Kruskal-WallisH检验比较四组间BALB/c新生鼠棘层松解程度及免疫荧光强度,P<0.05认为差异有统计学意义。
结 果
一、临床表现
第1次注射后24 h内观察,模型组有3只新生鼠出现自发性糜烂面、水疱,尼氏征均为阳性;注射后48 h内,模型组有5只出现自发性水疱及糜烂面,15只均出现尼氏征(图1a)。溴吡斯的明组、甲硫酸新斯的明组及对照组所有BALB/c新生鼠均未出现自发性糜烂面及水疱;注射后48 h内,溴吡斯的明组及甲硫酸新斯的明组各有2只新生鼠出现尼氏征。
二、病理改变
棘层松解程度模型组明显高于溴吡斯的明组(H=21.584,P<0.001)及甲硫酸新斯的明组(H =20.641,P<0.001),差异均有统计学意义,溴吡斯的明组与甲硫酸新斯的明组间差异无统计学意义(H=0.009,P > 0.05)。见表 1、图 1。
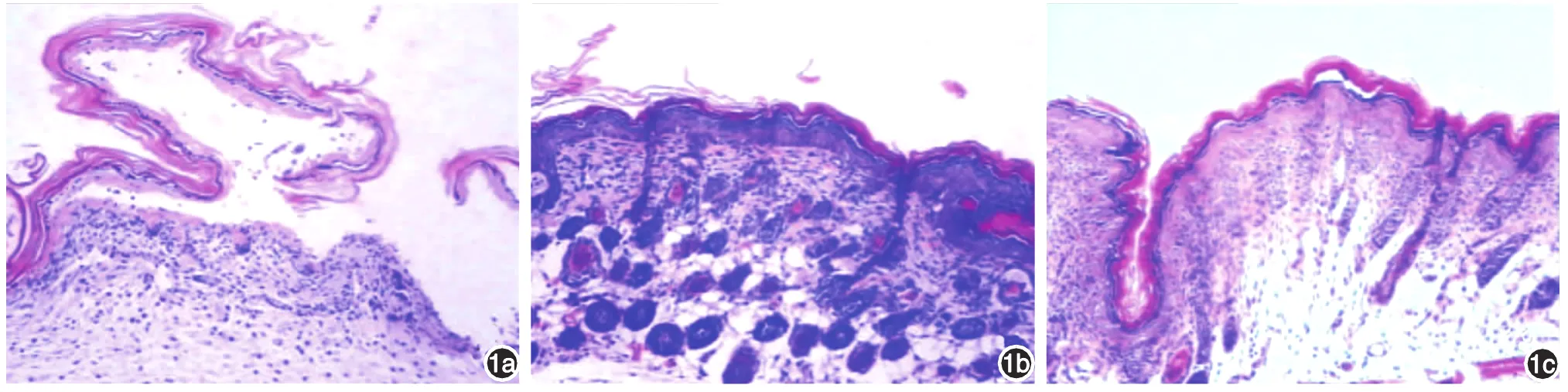
图1 BALB/c新生鼠第1次注射后48 h组织病理表现(HE×100) 1a:模型组出现典型棘层松解、表皮内水疱,部分表皮脱失;1b:溴吡斯的明组表皮结构紧密完整,未见棘层松解或表皮内水疱;1c:甲硫酸新斯的明组表现同溴吡斯的明组

图2 BALB/c新生鼠第1次注射后48 h取材行直接免疫荧光检查(×100) 2a:模型组荧光较暗,模糊可见IgG抗体在表皮内呈网状沉积;2b:溴吡斯的明组绿色荧光明亮,清晰可见IgG抗体在表皮内呈网状沉积;2c:甲硫酸新斯的明组可见耀眼的亮绿色荧光,清晰可见IgG抗体在表皮内呈网状沉积

表1 BALB/c新生鼠棘层松解程度及免疫荧光强度比较
三、直接免疫荧光检查结果
模型组、溴吡斯的明组及甲硫酸新斯的明组间免疫荧光强度差异无统计学意义(H=1.559,P>0.05),模型组、溴吡斯的明组及甲硫酸新斯的明组与对照组比较,差异有统计学意义(H=29.619,P<0.001)。见表 1、图 2。
讨 论
Nguyen等[3]证实,在注射天疱疮抗体建立天疱疮鼠模型的同时注射卡巴胆碱能够阻断天疱疮鼠模型棘层松解的产生,从而间接说明胆碱能受体激动剂可能对天疱疮具有治疗作用。Mehta等[6]报道1例PV患者通过吸烟及外用尼古丁贴片获得显著治疗效果。Nguyen等[3]报道l例难治性鼻部PV患者,通过口服溴吡斯的明片,皮损得到显著改善,泼尼松量顺利减少。一项双盲研究报道[7]PV患者外用毛果芸香碱也有确切疗效。
在我们的实验中,注射天疱疮患者血清建立PV鼠模型的同时,无论是注射溴吡斯的明还是甲硫酸新斯的明,都可以显著减少天疱疮鼠模型的棘层松解程度,说明抗胆碱酯酶药能有效减少天疱疮棘层松解程度,也进一步证实乙酰胆碱系统在天疱疮发病机制中的重要作用。而抗胆碱酯酶药能否对天疱疮患者进行有效的治疗,还有待进一步临床实验论证。
另外,本实验显示,在注射天疱疮患者血清建立天疱疮鼠模型的同时注射抗胆碱酯酶药,表皮细胞间免疫荧光强度无明显变化。这与国外报道的同为拟胆碱能药物的胆碱能受体激动剂卡巴胆碱能使天疱疮鼠模型角质形成细胞间免疫荧光强度增加这个结果有所不同[8]。这种差异的原因尚不清楚,可能与药物本身有关,也可能与免疫荧光强度测定方法不同有关。
在我们的实验中,为提高造模成功率,采用注射方法,将国内常用的100 μl血清/只的造模剂量[9]改进为 100 μl血清/g 体重,连续注射2次。因考虑到BALB/c新生鼠在第1次注射血清后48 h内死亡率高,若待PV鼠模型形成后进行药物注射再观察,则新生鼠存活时间难以达到,故我们将抗胆碱酯酶药物与患者血清同时注射,以缩短新生鼠在实验中所需的存活时间,而由此造成的不足之处在于无法排除二者之间可能存在的相互影响、干扰。在PV鼠模型尚未形成之前即给予抗胆碱酯酶药物干涉,与PV鼠模型形成之后再给予干涉,实验结果是否会存在差别?抗胆碱酯酶药物与其他天疱疮治疗药物对PV鼠模型棘层松解程度的影响是否存在差异?这些将是我们在进一步实验中要探讨的问题。
[1]Grando SA.Autoimmunity to keratinocyte acetylcholine receptors in pemphigus[J].Dermatology,2000,201(4);290-295.
[2]Vu TN,lee TX,Ndoye A,et al.The pathophysiological significance of nondesmoglein targets of pemphigus autoimmunity.Developmentofantibodies againstkeratinocyte cholinergic receptors in patients with pemphigus vulgaris and pemphigus foliaceus[J].Arch Dermatol,1998,134(8);971-980.
[3]Nguyen VT,Arredondo J,Chernyavsky AI,et al.Pemphigus vulgaris acantholysis ameliorated by cholinergic agonists[J].Arch Dermatol,2004,140(3);327-334.
[4]王鹰,刁庆春,钟白玉,等.白介素2、干扰素γ、白介素10对天疱疮棘层松解影响的研究[J].中华皮肤科杂志,2004,37(7);425-427.
[5]Schaerer L,Trüeb RM.Direct immunofluorescence of plucked hair in pemphigus[J].Arch Dermatol,2003,139(2);228-229.
[6]Mehta JN,Martin AG.A case of pemphigus vulgaris improved by cigarette smoking[J].Arch Dermatol,2000,136(1);15-17.
[7]Iraji F,Yoosefi A.Healing effect of Pilocarpine gel 4%on skin lesions of pemphigus vulgaris[J].Int J Dermatol,2006,45(6);743-746.
[8]Mahoney MG,Wang Z,Rothenberger K,et al.Explanations for the clinical and microscopic localization of lesions in pemphigus foliaceus and vulgaris[J].J Clin Invest,1999,103(4);46l-468.
[9]赵肖庆,薛峰,潘萌,等.抗Dsg-3 EC3-4的单链抗体片段在寻常型天疱疮鼠模型中的作用[J].中华皮肤科杂志,2006,39(6);338-340.
2013-10-28)
(本文编辑:尚淑贤)
Effect of anticholinesterase agents on acantholysis in a mouse model of pemphigus vulgaris
Wei Gao,Zheng Wenjun,Zhou Qiong.Department of Dermatology,First Affiliated Hospital of Guangxi Medical University,Nanning 530021,China
;Zheng Wenjun,Email;591292777@qq.com
ObjectiveTo study the effect of anticholinesterase agents on acantholysis in pemphigus vulgaris(PV) by using a mouse model.MethodsFifty-five neonatal BALB/c mice were divided into four groups;model group injected subcutaneously with the sera of patients with PV (n=15),pyridostigmine bromide group (n=15)and neostigmine methylsulfate group (n=15)subcutaneously injected with pyridostigmine bromide and neostigmine methylsulfate respectively,in addition to the sera of PV patients,control group subcutaneously injected with sodium chloride physiological solution (n=10).The effect of anticholinesterase agents on acantholysis in PV was evaluated in terms of clinical presentation,histopathological manifestations and direct immunofluorescence findings.ResultsThe injection of sera from PV patients induced characteristic changes of PV in neonatal BALB/c mice in the model group.The degree of acantholysis in the model group was higher than that in the pyridostigmine bromide group(H=21.584,P<0.001)and neostigmine methylsulfate group (H=20.641,P<0.001).No changes were observed in the control group.ConclusionAnticholinesterase agents can reduce the degree of acantholysis in the mouse model of PV.
Pemphigus;Disease models,animal;Cholinesterase inhibitors
10.3760/cma.j.issn.0412-4030.2014.011.006
530021南宁,广西医科大学第一附属医院皮肤科
郑文军,Email:591292777@qq.com
