42℃热处理在UVB诱导黑素细胞氧化损伤中的作用
2014-12-04胡文治祃丽娟赵广
胡文治 祃丽娟 赵广
42℃热处理在UVB诱导黑素细胞氧化损伤中的作用
胡文治 祃丽娟 赵广
目的探讨热处理在UVB诱导的人黑素细胞氧化应激损伤中的作用。方法体外培养原代人表皮黑素细胞,将纯化的MC分为4个处理组:对照组(37℃正常培养)、热处理组(42℃孵育1 h)、UVB处理组(100 mJ/cm2UVB照射)、联合处理组(42℃孵育1 h后给予100 mJ/cm2UVB照射),各组连续处理3 d。MTT法检测细胞活率,生物化学法检测超氧化物歧化酶活力和丙二醛浓度,流式细胞仪检测细胞内活性氧和细胞凋亡率。结果对照组细胞活率、细胞凋亡率、超氧化物歧化酶活力、丙二醛浓度、活性氧荧光强度分别为:(100 ± 6.14)%、(4.66 ± 0.58)%、(53.39 ± 8.23)U/gprot、(1.09 ± 0.32)mmol/gprot、1070.85 ± 42.07。 UVB 照射可以明显提高MC凋亡率[(24.14±2.90)%]、丙二醛[(1.65±0.33)mmol/gprot]和细胞内活性氧(1416.45±79.12)水平,降低细胞活率[(50.23±5.36)%]和超氧化物歧化酶活力[(31.98±11.89)U/gprot],而热处理可以显著降低UVB诱导的凋亡[(14.9±1.49)%],降低丙二醛[(1.10±0.26)mmol/gprot]、活性氧(1033.30±68.41)的含量,同时恢复细胞的活率[(74.12±6.17)%)]和超氧化物歧化酶活力[(51.63±6.55)U/gprot]。结论热处理对UVB诱导的黑素细胞的氧化应激损伤具有保护作用。
黑素细胞;热;中波紫外线;氧化性应激
白癜风是一种进行性色素脱失性疾病,其主要的病理特征为表皮功能性黑素细胞(melanocytes,MC)的破坏和缺失。治疗手段包括:紫外线、308 nm准分子激光、局部外用免疫调节剂或维生素D衍生物等。其中,窄谱中波紫外线(NB-UVB)局部照射是有效的治疗方法之一。但是,有研究表明,紫外线照射,特别是UVB(290~320 nm),可以诱导组织产生自由基和相关的活性氧,直接损伤DNA,最终导致皮肤老化和皮肤癌[1]。多项研究发现,白癜风患者MC存在抗氧化功能的缺陷[2],提示我们用UVB治疗白癜风,必须要考虑到过量UVB对MC的损伤。另一方面,有研究证实,热照射也可以应用于白癜风治疗。Nakazawa等[3]首次比较了人表皮MC对UVB和热的反应,发现热照射可以促使MC树突增多延长、胞体增大,细胞酪氨酸酶活性和黑素合成增加。研究还提示,适量的热处理可以减少外部环境对细胞的损伤。我们通过检测人表皮MC在体外环境下的活率、凋亡率、超氧化物歧化酶(SOD)活力、丙二醛(MDA)浓度、细胞内活性氧(ROS),分析热处理、UVB照射、联合处理对细胞的影响。
材料与方法
一、材料
1.主要试剂与仪器:黑素细胞培养基(M-254)、黑素细胞生长添加物(HMGS-1)产自美国Gibco公司;真表皮分散酶产自美国Roche公司;噻唑蓝(MTT)、2′,7′-二氯荧光黄双乙酸盐(DCFH-DA)产自美国Sigma公司;FITC Annexin V Apoptosis试剂盒产自美国BD公司;胎牛血清产自杭州天杭生物公司;胰蛋白酶消化液产自南京凯基生物公司;SOD、MDA、蛋白定量试剂盒产自南京建成生物工程研究所。紫外线光疗仪产自上海希格玛高科技有限公司(光源波长310~313 nm,峰值311 nm);UVB辐照仪由北京师范大学光电仪器厂生产;BX60荧光显微镜由日本Olympus公司生产。
二、方法
1.人黑素细胞的培养和传代:取成人包皮环切后标本,碘伏浸泡消毒10 min,清除皮下组织,剪切为0.5 cm×0.5 cm皮片。置于0.5%真表皮分散酶中,4℃静置12 h,37℃消化1 h。分离真表皮,将表皮置于胰蛋白酶内室温消化20 min,胎牛血清终止消化,吹打为单细胞悬液,200目细胞筛过滤。离心后加入M-254培养液,接种于培养瓶中,置于37℃、5%CO2、饱和湿度孵箱培养,待细胞铺满培养瓶后进行传代。经传代获得纯化的黑素细胞培养系,传至3~5代收获细胞备用。
2.实验分组:3~5代MC长至80%融合时,胰蛋白酶消化收集。根据不同实验需要,以不同密度接种于培养皿。细胞活率实验:96孔板,2 000/孔;细胞凋亡实验:35 mm培养皿,1×105/孔;MDA浓度、SOD活力检测:100 mm培养皿,密度8×105/孔;细胞内ROS检测:60 mm培养皿,密度3×105/孔。待细胞长至70%融合,更换培养液,随机分为对照组、热处理组、UVB处理组、联合处理组,每组6个样本,重复3次。
3.细胞干预方法:UVB处理组:超净台内,紫外线治疗仪以0.64 mW/cm2照射强度UVB照射156 s(照射剂量100 mJ/cm2)。为避免培养基颜色的影响,照射时根据培养皿面积,以25 μl/cm2PBS替换培养基,照射后重新添加培养基(非UVB处理组,以等量PBS处理相同时间)。热处理:42℃、5%CO2、饱和湿度孵箱内培养1 h。联合处理组:热处理后给予UVB处理。对照组:37℃、5%CO2、饱和湿度孵箱内培养,不做任何处理。各组连续干预3 d,每天干预1次,末次处理12 h后检测各项指标。
4.不同处理对MC活率的影响:将处理后的96孔板,置于超净台内。每孔加入5 mg/ml的MTT 20 μl,37℃孵育4 h,弃去培养液,每孔加入 150 μl DMSO充分溶解结晶物,将不同处理组DMSO移入同一96孔板,酶标仪490 nm波长进行比色,以空白孔调零,细胞活率 =A处理组/A对照组×100%。
5.不同处理对细胞凋亡的影响:胰蛋白酶消化收集各处理组细胞。按照FITC Annexin V Apoptosis试剂盒说明书操作,将消化细胞用预冷PBS漂洗2遍后,用适量结合缓冲液[0.01 mol/L Hepes/NaOH(pH 7.4),0.14 mol/L NaCl,2.5 mmol/L CaCl2]重悬细胞,将细胞密度调整至1×106/ml。取100 μl细胞悬液移至上样管,每管加Annexin V和PI各5 μl。室温避光孵育15 min后,每管加300 μl结合缓存液,立即上机检测。
6.检测不同处理组SOD活力和MDA浓度:胰蛋白酶消化并收集各处理组细胞,加入预冷PBS漂洗1遍,加入0.5 ml PBS将细胞吹打为细胞悬液,在冰浴器上用超声裂解细胞(60 W,0.5 s间隔,15 min)。4℃下,10 000×g离心15 min,将上清液移入新试管中。测量样本蛋白浓度:取样品上清适当稀释后,参考试剂盒说明书,用BCA法测定总蛋白量。测量MDA:取样品上清,参考试剂盒说明书,应用硫代巴比妥(TBA)法,测定MDA含量。测量SOD活力:取样品上清,适当稀释后,参考试剂盒说明,应用WST-1法测定样品SOD活力。
7.细胞内ROS测定:各处理组弃去培养基,加入不含添加因子的M-254培养基,加入DCFH-DH使终浓度达到2.5 μmol/l,37℃孵育细胞30 min。取部分样本,经荧光显微镜488 nm波长蓝光激发绿色荧光,软件采集图像。剩余样本经胰蛋白酶消化收集细胞,加入200 μl的PBS吹打为细胞悬液。应用流式细胞仪检测10 000个细胞的平均荧光强度,应用CELL QuestTM软件分析。
8.统计学分析:用SPSS16.0进行统计学分析,所有数据以±s表示。对各组数据进行方差分析和LSD-t检验,P<0.05为差异有统计学意义。
结 果
1.黑素细胞活率:MTT实验显示,对照组、热处理组、UVB处理组、联合处理组的活率分别为(%):100 ± 6.14、105.85 ± 5.32、50.23 ± 5.36、74.12 ± 6.17。统计分析显示,热处理可以促进MC的增殖(P<0.01),UVB处理组和联合处理组MC活率均显著降低(P<0.01),但联合处理组活率明显高于UVB组(P<0.01)。
2.黑素细胞凋亡率:对照组、热处理组、UVB处理组、联合处理组MC的凋亡率(%)分别为:4.66±0.58、8.87 ± 1.67、24.14 ± 2.90、14.9 ± 1.49,3 个处理组凋亡率均高于对照组(P<0.001),但较热处理组和联合干预组,UVB处理组凋亡率明显增高(P<0.001),见图 1。
3.黑素细胞SOD活力和MDA浓度:UVB处理组,较其他3组SOD活力明显降低(均P<0.01),MDA浓度明显增高(均P<0.01);对照组、热处理组、联合处理组间SOD活力与MDA浓度,差异均无统计学意义,见表1。
表1 不同处理组黑素细胞SOD活力和MDA浓度(±s,n=6)
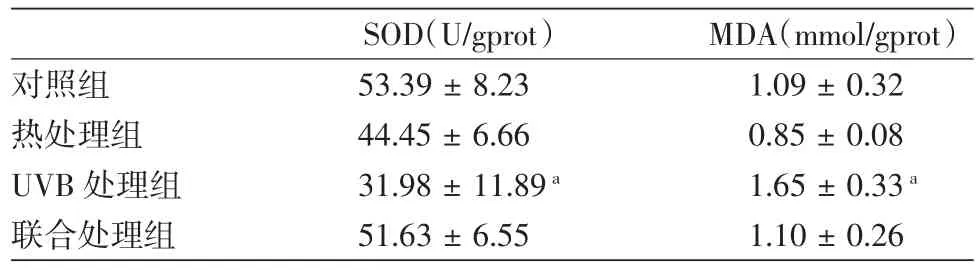
表1 不同处理组黑素细胞SOD活力和MDA浓度(±s,n=6)
注:a:与其他3个组相比,均P<0.01
SOD(U/gprot) MDA(mmol/gprot)对照组 53.39±8.23 1.09±0.32热处理组 44.45±6.66 0.85±0.08 UVB处理组 31.98±11.89a 1.65±0.33a联合处理组 51.63±6.55 1.10±0.26
4.细胞内ROS:荧光显微镜下,UVB处理组绿色荧光明显增强。流式细胞仪检测显示:对照组、热处理组、UVB处理组、联合处理组荧光强度分别为:1 070.85 ± 42.07、1 101.90 ± 44.99、1 416.45 ± 79.12、1 033.30±68.41。UVB处理组平均荧光强度明显高于其他3个组(均P<0.01),对照组、热处理组、联合处理组之间,差异无统计学意义,见图2。
讨 论
在MC的体外实验中,有学者发现热处理(42℃,60 min,连续3 d)可以促进MC增殖,增强酪氨酸酶活性和黑素合成[4]。祃丽娟等[5]通过角质形成细胞(keratinocytes,KC)与MC的共培养模型发现,热处理后MC与KC α-MSH分泌增加,MSH前体POMC基因表达水平上升。这些研究都提示,热处理可以提高MC活性及功能。不仅如此,其他研究发现,热处理联合UVB照射,可以增加UVB的治疗效果,促进MC内酪氨酸酶活性,增加黑素合成[6],邵丽芳等[7]发现,热处理联合UVB照射,可以引起细胞HSP72水平增高,提示热处理可能对UVB诱导的损伤具有保护作用。鉴于以上研究,我们针对不同处理方法对MC的影响进行了观察。
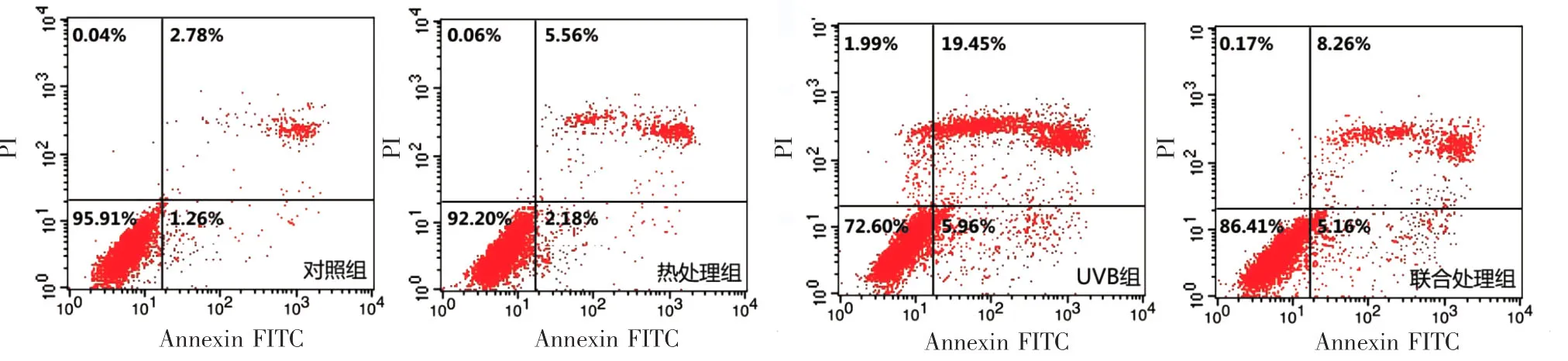
图1 不同处理对细胞凋亡的影响 Annexin V、PI双标法检测细胞凋亡,流式细胞仪计数,图中左下象限为正常细胞,左上象限为坏死细胞,右下象限为早凋细胞,右上象限为晚凋细胞。其中热处理组、UVB组、联合处理组细胞凋亡率均高于对照组,但热处理组和联合处理组凋亡率均低于UVB组

图2 不同处理对细胞内ROS的影响 不同处理组DCFH-DH(2.5 μmol/l)孵育30 min后,胞质内呈黄绿色荧光(荧光显微镜,×200)。图中细胞荧光强度反应细胞内ROS水平,结果显示UVB处理组荧光强度明显高于其他3个组
实验中我们观察到,MC活率随UVB照射剂量的增加而减低,当UVB照射剂量大于50 mJ/cm2连续3 d时,MC的活率受到明显抑制(数据未呈现)。当UVB照射达到100 mJ/cm2连续3 d时,为MC的半效抑制剂量,此时MC的凋亡率明显增加,细胞内SOD活力明显减低,细胞内ROS累积,并引发脂质过氧化作用,导致脂质过氧化物(MDA)浓度的显著增加。研究显示,UVB可以通过多种途径对细胞造成损伤,特别是产生过量的ROS诱导细胞氧化损伤。ROS具有调节生长、损伤应答等多种功能,但过量ROS会导致明显的毒副作用,诸如蛋白失活、诱导凋亡、损伤细胞核和线粒体DNA、促进炎性介质释放。UV照射不仅可以活化核黄素、色氨酸、卟啉等小分子产生ROS[8],还可以损伤线粒体,加速氧化失衡。线粒体在氧化损伤中发挥重要作用,线粒体是内源性ROS的重要来源,同样也是ROS损伤的主要靶点,线粒体失能会诱发细胞内ROS的恶性循环,最终导致氧化应激损伤[9]。而线粒体DNA由于缺乏组蛋白和完善的修复系统,容遭受紫外线照射的损伤[10]。因此,过量的UVB照射容易造成MC的氧化应激损伤。临床中白癜风患者通常以50%~70%的最小红斑量(MED)作为起始照射剂量(通常为200 mJ/cm2),以后逐渐增加。但是由于患者肤色、联合用药、治疗部位等的不同,治疗剂量差异较大,照射剂量常根据经验调整,有可能导致UVB照射剂量过大,造成MC细胞损伤,促进皮损发展。因此,寻求一种简单经济的治疗措施,预防UVB过量造成的MC损伤十分必要。
本实验显示,单纯热处理(42℃,60 min,连续3 d)虽然可以轻度增加细胞的凋亡率,但总体上以促进细胞增殖为主,其效果与低剂量UVB照射(20 mJ/cm2)类似。Nakazawa等[3]认为这种作用可能与p53和p21蛋白表达上调有关。同时,我们还发现,热联合大剂量UVB(100 mJ/cm2)处理细胞,可以降低单纯UVB照射导致的细胞凋亡。这与Bivik等[11]的结果一致,他们认为热应激诱导的HSP70,可以通过抑制组织蛋白酶和细胞色素c的释放,减少UVB诱导的细胞凋亡。在氧化应激方面,热处理组与对照组差异无统计学意义,其中热处理组SOD活力和MDA含量均有轻度下降(均P>0.05),可能与热处理后细胞代谢水平升高,总蛋白含量增加有关。与UVB照射组相比,联合处理可以明显降低UVB诱导的ROS和MDA水平,促进SOD活力恢复,对UVB诱导的氧化损伤具有拮抗作用。综上所述,我们推测热处理虽然对MC有轻度的损伤作用,但是这种轻度的损伤,可能激活了细胞的防御机制,引发防御反应,进而对UVB照射引起的氧化应激起到了保护作用。虽然本实验仍缺乏热处理拮抗氧化损伤机制的深入研究,但是以上数据可以初步提示:适度热处理(42℃,60 min)对大剂量UVB(100 mJ/cm2)损伤具有保护作用,也提示热疗联合UVB不仅可以增强细胞活性和功能,促进皮损恢复,还可减少UVB治疗的不良反应,具有良好的应用前景,也为临床治疗色素脱失性疾病提供了新的思路。
[1]Katiyar SK,Mukhtar H.Green tea polyphenol(-)-epigallocatechin-3-gallate treatmentto mouse skin prevents UVB-induced infiltration of leukocytes,depletion of antigen-presenting cells,and oxidative stress[J].J Leukoc Biol,2001,69(5):719-726.
[2]SchallreuterKU,BahadoranP,PicardoM,etal.Vitiligopathogenesis:autoimmune disease,genetic defect,excessive reactive oxygen species,calcium imbalance,or what else?[J].Exp Dermatol,2008,17(2):139-140.
[3]Nakazawa K,Sahuc F,Damour O,et al.Regulatory effects of heat on normal human melanocyte growth and melanogenesis:comparative study with UVB[J].J Invest Dermatol,1998,110(6):972-977.
[4] 牛建荣,杨庆琪,孟如松,等.热处理对体外培养正常人黑素细胞活性的影响[J].中华皮肤科杂志,2011,44(2):114-116.
[5] 祃丽娟,赵广,顾伟杰,等.热处理对体外人黑素细胞及HaCaT细胞分泌α黑素细胞刺激素的影响[J].中华皮肤科杂志,2013,46(6):401-403.
[6] 宋文婷,赵广,牛建荣,等.热处理对UVB辐射后体外培养人黑素细胞活性的影响[J].中华皮肤科杂志,2012,45(5):340-343.
[7] 邵丽芳,赵广,牛建荣,等.热处理、UVB辐射及两者联合作用对人表皮黑素细胞合成热休克蛋白72的影响[J].中华皮肤科杂志,2012,45(5):337-339.
[8]Tyrrell RM.Role for singlet oxygen in biological effects of ultraviolet A radiation[J].Methods Enzymol,2000,319:290-296.
[9]Glassman SJ.Vitiligo,reactive oxygen species and T-cells[J].Clin Sci(Lond),2011,120(3):99-120.
[10]Wu S,Wang L,Jacoby AM,et al.Ultraviolet B light-induced nitric oxide/peroxynitrite imbalance in keratinocytes--implications for apoptosis and necrosis[J].Photochem Photobiol,2010,86(2):389-396.
[11]Bivik C,Rosdahl I,Ollinger K.Hsp70 protects against UVB induced apoptosis by preventing release of cathepsins and cytochrome c in human melanocytes[J].Carcinogenesis,2007,28(3):537-544.
2013-07-19)
(本文编辑:吴晓初)
Effect of heat treatment at 42℃on ultraviolet B-induced oxidative injury to human melanocytes
Hu Wenzhi*,Ma Lijuan,Zhao Guang.*Department of Dermatology,Xijing Hospital,Fourth Military Medical University,Xi′an 710032,China
Zhao Guang,Email:guangfen@yahoo.com
ObjectiveTo evaluate the effect of heat treatment on ultraviolet B(UVB)-induced oxidative injury to human melanocytes.MethodsMelanocytes were isolated from adult foreskins,and subjected to a primary culture.After 3-4 passages of subculture,the melanocytes were classified into 4 groups:control group incubated at 37 ℃,heat treatment group incubated at 42 ℃ for 1 hour,UVB group exposed to UVB irradiation at 100 mJ/cm2,combination group receiving heat treatment at 42℃for 1 hour followed by UVB irradiation at 100 mJ/cm2.After three successive days of treatment,MTT assay was performed to evaluate cell viability,a biochemical method to determine the activity of superoxide dismutase(SOD)and concentration of malonaldehyde(MDA),and flow cytometry to detect intracellular reactive oxygen species(ROS)and apoptosis in melanocytes.ResultsThe cell survival rate,apoptosis rate,SOD activity,MDA concentration and ROS level were(100 ± 6.14)%,(4.66 ± 0.58)%,(53.39 ± 8.23)U/gprot,(1.09 ± 0.32)mmol/gprot,and 1070.85 ± 42.07 in the control group respectively.UVB exposure induced a significant increase in apoptosis rate(24.14% ±2.90%,P<0.001),MDA concentration(1.65±0.33 mmol/gprot,P<0.01)and ROS level(1416.45±79.12,P<0.01),but a significant decrease in cell survival rate(50.23% ±5.36%,P<0.01)and SOD activity(31.98 ± 11.89 U/gprot,P< 0.01)in the UVB group compared with the control group,while the heat pretreatment markedly downregulated the UVB-induced increase in apoptosis rate(14.9% ±1.49%,P<0.001),MDA concentration(1.10±0.26 mmol/gprot)and ROS level(1033.30±68.41,P<0.01),as well as the decrease in cell survival rate(74.12%±6.17%,P<0.01)and SOD activity(51.63±6.55 U/gprot,P<0.01)in the combination group.ConclusionHeat treatment could protect melanocytes from UVB-induced oxidative injury.
Melanocytes;Heat;UVB;Oxidative stress
10.3760/cma.j.issn.0412-4030.2014.05.010
国家自然科学基金(81271745)
710032西安,第四军医大学西京皮肤医院(胡文治);解放军空军总医院皮肤病医院(赵广、祃丽娟)
赵广,Email:guangfen@yahoo.com
